微波辅助提取果桑花色苷的工艺研究
2010-10-19张朝红古月华房红娟樊明涛李巨秀
张朝红,古月华,房红娟,樊明涛,李巨秀*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
微波辅助提取果桑花色苷的工艺研究
张朝红,古月华,房红娟,樊明涛,李巨秀*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
以果桑为试验材料,以花色苷提取率为考察指标,采用pH示差法测定总花色苷含量。通过单因素和正交试验,分析料液比、乙醇体积分数、pH值、微波功率和提取时间对桑椹花色苷提取效果的影响,并优化微波辅助提取果桑花色苷工艺参数。结果表明:料液比1:20(g/mL)、乙醇体积分数70%、pH1、微波功率540W和提取时间100s为最佳工艺参数,果桑花色苷的提取率为2.89mg/g;各因素影响的主次顺序为料液比>微波功率>提取时间>乙醇体积分数,且4个因素对花色苷提取率的影响都达到了显著水平。微波辅助提取果桑花色苷是一种简单可行、高效的提取方法。
果桑;花色苷;微波辅助;提取工艺
Abstract:Mulberry fruit (Morus Lhou Koidz.) is rich in anthocyanins, which are associated with many health benefits. In this work, we optimized the microwave-assisted extraction process of total anthocyanins from mulberry fruit. The effects of material/liquid ratio (g/mL), ethanol concentration, pH, microwave power and length of extraction time on the extraction of anthocyanins were examined. The quantification of total anthocyanins was carried out using pH differential method. Material/liquid ratio of 1:20, pH of 1, microwave power of 540 W and extraction duration of 100 s were found optimal, and the resultant yield of anthocyanins was 2.89 mg/g. Material/liquid ratio had the most important effect on the yield of anthocyanins, followed by microwave power, extraction duration and ethanol concentration, and all these four factors had significant effect on the yield of anthocyanins. This study reveals that microwave-assisted extraction is a simple, feasible and highly efficient method for extracting anthocyanins from mulberry fruit.
Key words:mulberry;anthocyanins;microwave assistance;extraction technology
果桑是近几年叶桑基础上选育出的专用品种,主要栽培的品种有“无核大十”、”红果1号”、“红果2号”、“红果3号”和“白玉王”[1-3],其果实又名桑椹,具有独特的保健价值,富含以矢车菊-3-葡萄糖苷和矢车菊-3-芸香苷为主的花色苷[4-5],具有抗肿瘤、抗氧化、抗动脉粥样硬化、抗风湿消炎等生理功能[6]。Sakagami等[7-8]还发现果桑具有抗艾滋病的作用,其活性是蓝莓果汁的4倍多,且具有很强的清除自由基能力。Isabelle等[9]研究认为桑果中的花色苷含量、多酚化合物含量、原花青素含量与自由基清除能力间有显著的相关性。
微波是一种频率300~300000MHz的电磁波,微波辅助提取则是利用微波提高提取效率的一种新技术,具有提取时间短、效率高、能耗低等优点,在天然产物提取和分析领域应用越来越广泛[10-14]。Sutivisedsak等[15]利用微波辅助技术提取豌豆中的酚类化合物,发现微波辅助提取产物提取率是常规方法提取提取率的2~3倍。本研究以果桑“无核大十”为研究材料,分析料液比、乙醇体积分数、pH值、微波功率、提取时间对果桑花色苷提取效果的影响,优化微波辅助提取果桑花色苷的提取工艺参数,为果桑保健产品的开发和评价提供试验数据和参考。
1 材料与方法
1.1 材料与试剂
果桑:品种为“无核大十”,2009年5月采自陕西省周至县果桑产业示范园。采摘后的果桑装于保鲜袋,置于-40℃冰箱中保存。使用时解冻。
NaOH、KCl、磷酸、醋酸钠、乙醇、冰乙酸(均为分析纯)。
1.2 仪器与设备
SC-3610低速离心机 安徽中科中佳科学仪器有限公司;WD900ASL25R-2微波提取装置(根据试验要求改装,图1) 广东格兰仕集团有限公司;U V 1700 pharmaspec型紫外-可见分光光度计 日本岛津公司。

图1 微波提取装置Fig.1 Schematic diagram for a microwave-assisted extraction instrument
1.3 方法
1.3.1 果桑中总花色苷的微波辅助提取方法
将预处理过的果桑研磨,称取2.00g左右的果浆,置于100mL的圆底烧瓶中,加入一定量乙醇提取溶剂,放入微波提取装置中,在一定条件下微波辅助提取后过滤,将上清液转入50mL的离心管中, 5400r/min离心15min,定容至50mL测定其吸光度。
1.3.2 果桑花色苷最大吸收波长的确定
取果桑花色苷提取液适量,用紫外-可见分光光度计在400~700nm扫描测定提取液的吸收光谱,确定其最大吸收波长。经扫描后确定果桑花色苷在波长为515nm处有最大吸收峰。
1.3.3 微波辅助提取果桑花色苷的单因素试验
以料液比、乙醇体积分数、p H值、微波功率、提取时间作为考察因素,进行单因素试验,以确定各因素的适宜范围。
1.3.3.1 料液比对果桑花色苷提取效果的影响
分别以料液比(g/mL)1:5、1:10、1:15、1:20和1:25,乙醇体积分数为60%,pH值为1,在微波功率为450W条件下,提取100s,过滤、离心,定容后在波长515nm处测定吸光度。
1.3.3.2 乙醇体积分数对果桑花色苷提取效果的影响
分别以体积分数30%、40%、50%、60%、70%和80%,pH1的乙醇溶液,料液比1:15,在微波功率450W条件下,提取100s,过滤、离心,定容后在波长515nm处测定吸光度。
1.3.3.3 pH值对果桑花色苷提取效果的影响
以料液比为1:15,分别加入pH值为1、2、3、4和5的60%乙醇溶液,在微波功率450W条件下,提取100s,过滤、离心,定容后在波长515nm处测定吸光度。
1.3.3.4 微波功率对果桑花色苷提取效果的影响
加入pH值为1的60%乙醇溶液,料液比1:15,分别在微波功率为0、270、360、450、540、630W和720W条件下,提取100s,过滤、离心,定容后在波长515nm处测定吸光度。
1.3.3.5 微波提取时间对果桑花色苷提取效果的影响
以料液比为1:15,加入pH值为1、体积分数60%的乙醇溶液,在微波功率450W条件下分别提取40、60、80、100、120、140s,过滤、离心,定容后在波长515nm处测定吸光度。
1.3.4 微波辅助提取果桑花色苷的正交试验
依据单因素试验结果,选取L16(45)正交表进行正交试验,优化微波辅助提取的各因素试验条件,因素水平表见表1。

表1 微波辅助提取正交试验因素水平表Table 1 Factors and levels in the orthogonal array design
1.3.5 果桑总花色苷的测定方法
采取pH值示差法测定果桑花色苷的提取率[16]。

式中:A515为桑椹花色苷在最大吸光处的吸光度;A700为桑椹花色苷在700nm处的吸光度。MW为相对分子质量,以矢车菊素-3-葡萄糖苷为标准,449.4;DF为稀释倍数;ε为消光系数,26900L·cm-1·mg-1;1为光程(1cm)。V为提取液总体积/mL;m为样品质量/g。
1.4 实验数据处理方法
采用DPS7.55设计试验和处理试验数据。
2 结果与分析
2.1 微波辅助提取果桑花色苷的单因素试验
2.1.1 料液比对桑椹花色苷提取效果的影响
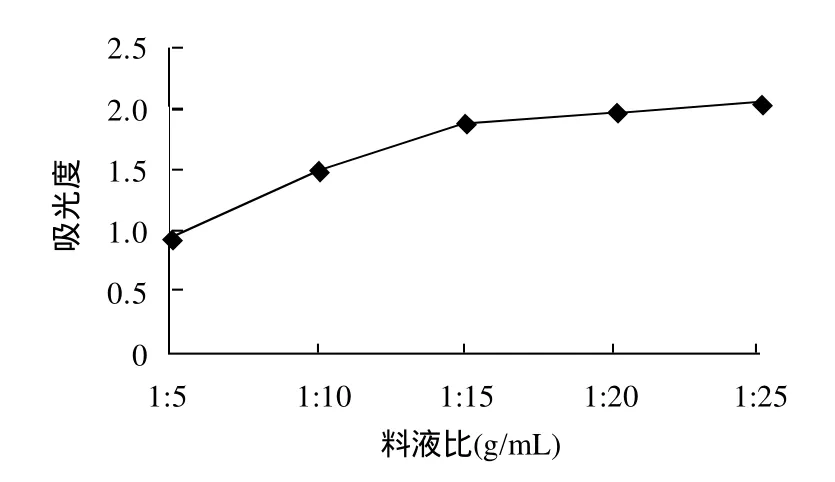
图2 料液比对果桑花色苷提取效果的影响Fig.2 Effect of material/liquid ratio on the extraction of anthocyanins
由图2可知,料液比对桑椹花色苷的提取效果有较大影响,提取液的吸光度随料液比的减小而增大。但当料液比低于1:15时,增幅开始变小。若再增大料液比对于果桑花色苷提取效果影响不大。因此,当料液比1:15为提取效果较好。
2.1.2 乙醇体积分数对果桑花色苷提取效果的影响
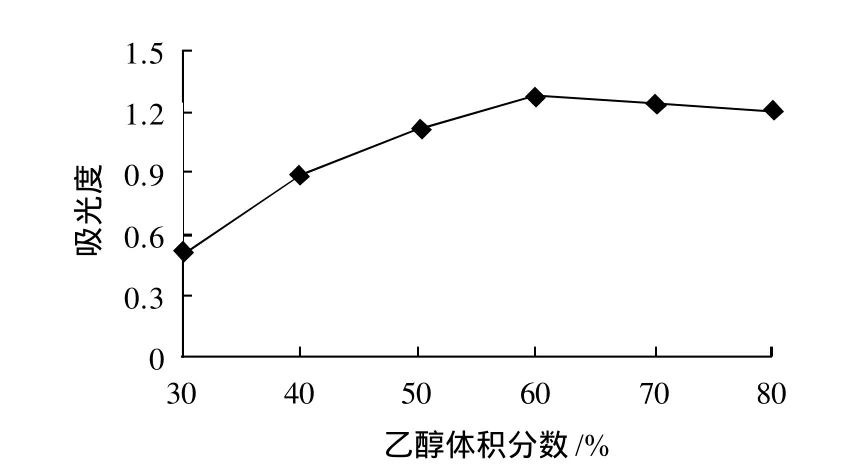
图3 乙醇体积分数对果桑花色苷提取效果的影响Fig.3 Effect of material/liquid ratio on the extraction of anthocyanins
乙醇由于成本低、毒性小、提取效率高,是提取多酚类化合物最为常用的溶剂,其体积分数对提取效果有重要的影响。乙醇体积分数对果桑花色苷的提取效果如图3所示。
由图3可知,随着乙醇体积分数的增大,提取液的吸光度也随之增大。但当乙醇体积分数达到60%后,吸光度达到最大值,再增加乙醇体积分数,吸光度变幅很小。由于乙醇是易挥发性液体,微波辅助提取时,微波瞬间发出极大热量,高体积分数的乙醇易挥发。所以,当乙醇体积分数达到一定值,再提高乙醇体积分数对于提高花色苷的提取率影响不大。
2.1.3 pH值对果桑花色苷提取效果的影响
pH值对花色苷稳定性影响较显著,不同的pH值溶液,花色苷结构不同并呈现不同的颜色,当pH值较低时,花色苷稳定性较高,当pH值逐渐增大时,花色苷的结构由红色的花烊式转化为无色的拟碱式,然后经过查耳酮式结构分解为褐色产物。pH值对果桑花色苷提取效果的影响见图4。
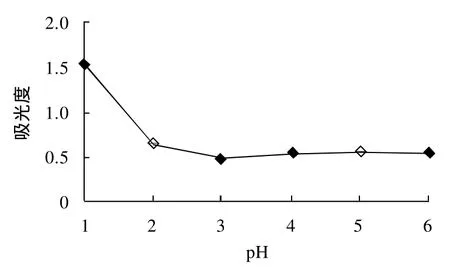
图4 pH值对果桑花色苷提取效果的影响Fig.4 Effect of pH on the extraction of anthocyanins
由图4可得出,当pH值为1时,桑椹花色苷的吸光度最大,当pH>1时,桑椹花色苷的吸光度明显降低,在pH在2~5范围内,吸光度变化不大,说明当pH值为1时提取效果最好。因此,在进行正交试验时,将pH值确定为1。
2.1.4 微波功率对果桑花色苷提取效果的影响
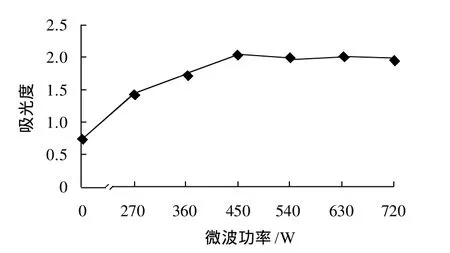
图5 微波功率对果桑花色苷提取效果的影响Fig.5 Effect of microwave power on the extraction of anthocyanins
微波加热是利用分子极化或离子导电效应直接对物质进行加热,加热效率高、升温快速均匀,不同的微波功率微波的发射强度不同,对物质的提取效果影响也不同。微波功率对果桑花色苷提取效果的影响见图5。从图5可看出,当微波功率在0~450W范围内,提取液的吸光度随着微波功率的增大而增大,当微波功率达到450W时,提取液的吸光度达到最大值,再随着微波功率的增加吸光度没有明显的变化,由此可知,微波功率为450W时为提取效果较好。
2.1.5 提取时间对果桑花色苷提取效果的影响

图6 微波提取时间对果桑花色苷提取效果的影响Fig.6 Effect of length of microwave treatment time on the extraction of anthocyanins
由图6可知,随着提取时间的延长,提取液的吸光度呈缓慢增加趋势,当提取时间为100s时,提取液的吸光度最大,说明提取效果好。当提取时间再增加时,吸光度开始有下降的趋势,其原因可能是微波可以瞬间产生大量热量,温度较高,当加热时间过长,对花色苷可能有破坏作用。所以,提取时间为100s时为宜。
2.2 微波辅助提取果桑花色苷的正交试验

表2 正交试验设计及结果Table 2 Orthogonal array design layout and experimental results

表3 方差分析表Table 3 Variance analysis for the yield of anthocyanins with various extraction conditions
根据单因素试验的结果,确定提取溶剂的pH值为1,以料液比、乙醇体积分数、微波功率、提取时间为考察因素,以花色苷提取率为指标,选择L16(45)正交表,进行四因素四水平正交试验,试验重复两次。正交试验结果见表2,方差分析结果见表3。
从表2可得,各因素对果桑花色苷提取率的影响主次顺序为A>D>C>B。微波辅助提取果桑花色苷的最优组合为A3B4C3D4,即料液比1:20、乙醇体积分数70%、提取时间100s、微波功率540W。
由表3可知,各因素对果桑花色苷提取率的影响均达到极显著(P<0.01)。
由于优化出的组合不在正交表中,因此需要进行验证试验,在优化出的提取条件下进行验证实验,重复3次。花色苷平均提取率为2.89mg/g,高于正交试验16个组合条件下的提取率,因此确定微波辅助提取果桑花色苷的工艺参数:料液比1:20(g/mL)、70%乙醇体积分数、提取时间100s、微波功率540W和pH值为1。
3 结 论
利用微波辅助提取法,通过单因素和正交试验优化果桑花色苷提取的工艺参数,最佳提取条件为料液比1:20(g/mL)、乙醇体积分数70%、pH1、微波功率540W和提取时间100s,在此条件下果桑花色苷的提取率为2.89mg/g。各因素对果桑花色苷提取率影响的主次顺序:料液比>微波功率>提取时间>乙醇体积分数,且4个因素对花色苷提取率的影响均达到了极显著水平(P<0.01)。
[1] 唐翠明, 罗国庆, 吴福泉, 等. 关于果桑品种选育的思考[J]. 果树学报, 2007, 24(6):826-829.
[2] 应霞. 果桑的主要特性和栽培技术[J]. 浙江农业科学, 2009(4):832-833.
[3] 刘利, 潘一乐. 果桑资源研究利用现状与展望[J]. 植物遗传资源科学, 2001, 2(2):61-65.
[4] 李妍, 刘学铭, 刘吉平, 等. 不同果桑品种桑椹成熟过程中非花青素酚类物质的含量变化[J]. 蚕业科学, 2008, 34(4):711-717.
[5] HASSIMOTTO N M, GENOVESE M I, LAJOLO F M. Absorption and metabolism of cyanidin-3-glucoside and cyanidin-3-rutinoside extracted from wild Mulberry (Morus nigraL.) in rats[J]. Nutr Res, 2008,28(3):198-207.
[6] KIM A J, PARK S. Mulberry extract supplements ameliorate the inflammation-related hematological parameters in carrageenan-induced arthritic rats[J]. J Med Food, 2006, 9(3):431-435.
[7] SAKAGAMI H, ASANO K, SATOH K, et al. Anti-stress, anti-HIV and vitamin C-synergized radical scavenging activity of mulberry juice fractions[J]. In Vivo, 2007, 21(3):499-505.
[8] SAKAGAMI H, ASANO K, SATOH K, et al. Anti-stress activity of mulberry juice in mice[J]. In Vivo, 2006, 20(4):499-504.
[9] ISABELLE M, LEE B L, ONG C N, et al. Peroxyl radical scavenging capacity, polyphenolics, and lipophilic antioxidant profiles of mulberry fruits cultivated in southern China[J]. J Agric Food Chem, 2008, 56(20):9410-9416.
[10] 范华均, 林广欣, 肖小华, 等. 微波辅助提取石蒜和虎杖中有效成分的热力学机理研究[J]. 高等学校化学学报, 2006, 27(12):2271-2276.
[11] 艾志录, 郭娟, 王育红, 等. 微波辅助提取苹果渣中苹果多酚的工艺研究[J]. 农业工程学报, 2006, 22(6):188-191.
[12] 朱兴一, 谢捷, 忙怡丽, 等. 微波辅助提取银杏叶萜类内酯的工艺研究[J]. 高校化学工程学报, 2009, 23(6):1080-1083.
[13] PROESTOS C, KOMAITIS M. Application of microwave-assisted extraction to the fast extraction of plant phenolic compounds[J]. LWT,2008, 41(4):652-659.
[14] SPIGNO G., DE F D M. Microwave-assisted extraction of tea phenols:a phenomenological study[J]. Journal of Food Engineering, 2009, 93(2):210-217.
[15] SUTIVISEDSAK N, CHENG H N, WILLETT J L, et al. Microwaveassisted extraction of phenolics from bean (Phaseolus vulgarisL.)[J].Food Research International, 2010, 43(2):516-519.
[16] SUN Jian, YAO Jinyan, HUANG Shaoxi, et al. Antioxidant activity of polyphenol and anthocyanin extracts from fruits ofKadsura Coccinea(Lem.) A.C. Smith[J]. Food Chemistry, 2009, 117(2):276-281.
Microwave-assisted Extraction of Total Anthocyanins from Mulberry Fruit
ZHANG Chao-hong,GU Yue-hua,FANG Hong-juan,FAN Ming-tao,LI Ju-xiu*
(College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
R284.2
A
1002-6630(2010)18-0192-04
2010-06-23
陕西省科技厅科技计划项目(2009K01-17)
张朝红(1973—),男,博士研究生,主要从事食品化学研究。E-mail:zhangchh@nwsuaf.edu.cn
*通信作者:李巨秀(1972—),女,副教授,博士,主要从事食品功能化学研究。E-mail:juxiuli@msn.com
