谷氨酰胺转氨酶改性菜籽蛋白凝胶特性的研究
2010-10-19鞠兴荣王立峰朱小虎
袁 建,鞠兴荣,何 荣,王立峰,,朱小虎
(1.南京财经大学食品科学与工程学院,江苏省粮油品质控制及深加工技术实验室,江苏 南京 210003;2.江南大学食品学院,江苏 无锡 214122)
谷氨酰胺转氨酶改性菜籽蛋白凝胶特性的研究
袁 建1,鞠兴荣1,何 荣2,王立峰1,2,朱小虎1
(1.南京财经大学食品科学与工程学院,江苏省粮油品质控制及深加工技术实验室,江苏 南京 210003;2.江南大学食品学院,江苏 无锡 214122)
为改善菜籽蛋白质的凝胶特性,采用谷氨酰胺转氨酶(TG)以单因素试验和正交试验研究影响菜籽分离蛋白(RPI)凝胶特性的主要因素——TG质量浓度、pH值、反应温度和反应时间。结果表明:反应温度和 pH 值对菜籽分离蛋白凝胶性的影响显著,同时得到谷氨酰胺转氨酶改性菜籽蛋白凝胶特性的最佳工艺条件,RPI质量浓度1.5g/10mL、加酶量50U/g RPI、pH9.0、反应温度40℃、反应时间20min。
菜籽分离蛋白;谷氨酰胺转氨酶;凝胶性
Abstract:Enzymatic modification with transglutaminase (TG) was used to improve gel property of protein. The effects of TG amount, pH, reaction temperature and reaction time were explored on the basis of single factor experiments and orthogonal experiments. Results indicated that pH and reaction temperature exhibited a significant effect on gel strength on of rapeseed protein isolate (RPI). The optimal conditions for modifying gel property of RPI with TG were protein concentration of 1.5 g/10 mL,TG addition amount of 50 U/g, pH 9.0, reaction temperature of 40 ℃ and reaction time of 20 min.
Key words:rapeseed protein isolate (RPI);transglutaminase (TG);gel property
菜籽蛋白主要是由12S 球蛋白和1.7S或2S 蛋白质组成,是一种优质蛋白质,其氨基酸组成符合FAO/WHO推荐模式值,PER值高于其他植物蛋白,甚至高于酪蛋白[1]。菜籽蛋白除了具有较好的营养特性外,其吸水性、吸油性、起泡性和乳化性都优于大豆蛋白,但是不具有形成凝胶的能力[2-3],菜籽蛋白作为添加剂改善肉或香肠质构特性的应用受到了限制。
目前,对于植物蛋白凝胶特性的研究,主要集中在对大豆分离蛋白凝胶性的研究上,通过物理、化学、酶和基因工程的方法,改变大豆蛋白的分子结构,从而改变其凝胶特性[4-6],而对菜籽蛋白凝胶特性的研究甚少,国内还未见相关报道。本实验采用谷氨酰胺转氨酶对菜籽蛋白限制性水解,通过单因素试验和正交试验,探讨谷氨酰胺转氨酶改性对菜籽蛋白凝胶特性的影响,为进一步研究菜籽蛋白的凝胶性提供了理论依据。
1 材料与方法
1.1 材料与试剂
菜籽分离蛋白[通过碱溶酸沉法制得[7],由凯氏定氮法测得粗蛋白为82.55%(占干基质量)];谷氨酰胺转氨酶(100U/g,TG) 江苏省泰兴市一鸣精细化工有限公司;实验所用试剂均为分析纯。
1.2 仪器与设备
TDL-5-A离心机 上海安亭科学仪器厂;pHS-3C精密数显pH计 上海精密科学仪器厂;85-1磁力搅拌机 金坛市医疗仪器厂;HH-4数显恒温水浴锅 国华电器有限公司;质构分析仪 英国Stable Micro System公司。
1.3 方法
1.3.1 菜籽分离蛋白凝胶的制备
参照Tang等的方法[8],并略有修改。取一定量菜籽蛋白,溶于0.1mol/L NaCl溶液中,配制成不同浓度、不同pH值的菜籽蛋白溶液;取一定量谷氨酰胺转氨酶(TG),溶于0.1mol/L NaCl溶液中,配制成不同浓度的酶溶液,调节pH值与菜籽蛋白溶液一致,将上述两溶液用磁力搅拌器搅拌2h,使其充分溶解。各取5mL已溶解的菜籽蛋白溶液和酶溶液于10mL小烧杯得到不同酶与底物浓度比的蛋白-酶混合溶液。
将装有蛋白-酶混合溶液小烧杯置于不同温度的水浴中,反应一段时间,取出置于95℃的水浴中保温15min进行灭酶,取出,冰水浴冷却后于4℃的冰箱放置24h,取出陈化30min,测试,研究不同反应时间、温度、pH值、加酶量对菜籽蛋白凝胶性的影响。
1.3.2 菜籽蛋白凝胶特性的测定
用质构仪(TPA)测定菜籽蛋白的凝胶特性,选用直径为10mm的圆柱状平头探头(p/0.5)[9]。测前速度2mm/s;测试速度1mm/s;测后速度2mm/s;穿刺距离10mm;时间5s。做3次平行试验,取平均值得到凝胶质构参数,选取胶凝性作为评价指标。
胶凝性(g):将半固体食品咀嚼至可吞咽时所做的功,与硬度和内聚性有关。按照质构仪说明书定义。
胶凝性=硬度×内聚性
式中:硬度(g)为第一次压缩(第一次咀嚼)过程中的峰值力;内聚性为表示测试样品经过第一次压缩变形后所表现出来的对第二次压缩的相对抵抗能力,在曲线上表现为两次压缩所做正功之比(面积2/面积1)。
1.3.3 单因素试验设计
1.3.3.1 加酶量对菜籽蛋白凝胶性的影响
调蛋白-酶混合溶液pH6.0,水浴温度50℃,保温30min,加酶量(U/g RPI)分别为0、20、40、80、100。
1.3.3.2 pH值对菜籽蛋白凝胶性的影响
调蛋白-酶混合溶液pH值为5.0、6.0、7.0、8.0、9.0、10.0、11.0,水浴温度50℃,保温30min,加酶量50U/g RPI。
1.3.3.3 反应温度对菜籽蛋白凝胶性的影响
调蛋白-酶混合溶液pH9.0,保温30min,加酶量50U/g RPI。水浴温度(℃)分别为 20、30、40、50、60、70、80。
1.3.3.4 反应时间对菜籽蛋白凝胶性的影响
调蛋白-酶混合溶液pH9.0,水浴温度50℃,加酶量50U/g RPI。反应时间(min)分别为10、20、30、40、50、60。
1.3.5 正交试验设计
在单因素试验的基础上,以加酶量、pH值、反应时间、反应温度为影响因素,设计L9(34)正交试验,优化谷氨酰胺转氨酶改性菜籽蛋白的凝胶特性的工艺条件,结果见表1(其中,RPI质量浓度为1.5g/10mL)。
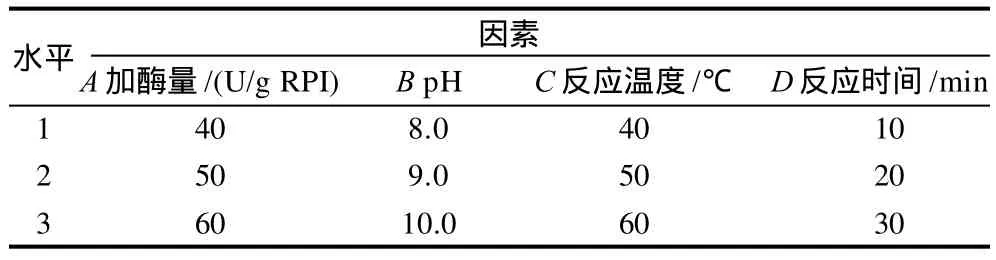
表1 工艺条件优化正交试验因素水平表Table 1 Factors and levels of the orthogonal array design
1.4 数据分析
每个实验重复3次,结果采用“平均值±标准差”表示。
2 结果与分析
2.1 单因素试验结果
2.1.1 加酶量对菜籽蛋白凝胶性的影响

图1 加酶量对菜籽蛋白凝胶性的影响Fig.1 Effect of TG amount on the gel property of rapeseed protein
由图1可以看出,随着TG加酶量的增加,RPI的凝胶强度不断升高,超过60U/g时,RPI的凝胶强度开始下降,并随着加酶量的升高,该值下降较为显著。本试验中,加酶量达到60U/g RPI时,RPI的凝胶强度达到最大值,说明维系蛋白质凝胶网络的稳定所需的共价键的数目只有一定的饱和性,过多的酶量对蛋白的水解程度加深,反而不利于凝胶的空间网络,导致凝胶破裂强度在高加酶量时下降[10];同时也可以看出,在不加TG的情况下,菜籽蛋白几乎不形成凝胶,说明TG的改性是菜籽蛋白形成凝胶的重要因素,而TG也常被用于蛋白质的改性[11-12]。由曲线图可以看出,40~60U/g RPI的加酶量变化不大,因此,以TG加酶量50U/g RPI进行以下试验。
2.1.2 pH值对菜籽蛋白凝胶性的影响

图2 pH值对菜籽蛋白凝胶性的影响Fig.2 Effect of pH on the gel property of rapeseed protein
图2显示了pH值对RPI凝胶性的影响。可以看出,在pH值较低情况下,随着pH值的升高,凝胶强度有所波动,在pH9.0时凝胶强度达到最高点,超过9.0时,随着pH值的升高,RPI的凝胶强度不断下降。这是因为体系pH值的改变一方面影响酶活性和稳定性,另一方面影响CPI的溶解性,影响蛋白质相互作用过程中的疏水作用与静电作用之间的平衡[5]。另外,pH7.0处有一个低点,是因为pH7.0是RPI的一个等电点,此pH值下其溶解性较低[13]。因此,最适 pH值为9.0,此条件下,RPI的凝胶性最好,可以达到21.5g。
2.1.3 反应温度对菜籽蛋白凝性胶的影响

图3 反应温度对菜籽分离蛋白凝性胶的影响Fig.3 Effect of reaction temperature on the gel property of rapeseed protein
由图3所示,在TG加酶量50U/g RPI的条件下,RPI的凝胶强度随反应温度的升高,呈先升高后降低趋势,温度在50℃时RPI的凝胶强度最大。这是因为,一方面温度影响酶的反应速率,温度升高,反映速度加快,另一方面也影响酶的活性,高温会使酶失活,酶对蛋白的改性能力减弱[14]。因此,反应最适温度为50℃。
2.1.4 反应时间对菜籽蛋白凝胶性的影响
由图4可以看出,在反应时间较短的情况下,随着时间的延长,RPI的凝胶强度有所升高,反应20min后RPI凝胶强度开始下降,最后趋于一个稳定值。长时间的水解反应使RPI的凝胶强度有所减弱,但在0~60min内,RPI凝胶强度变化不大,极差为3.15g。实验得出最适反应时间为20min。

图4 反应时间对菜籽蛋白凝胶性的影响Fig.4 Effect of reaction time on the gel property of rapeseed protein
2.2 工艺优化正交试验
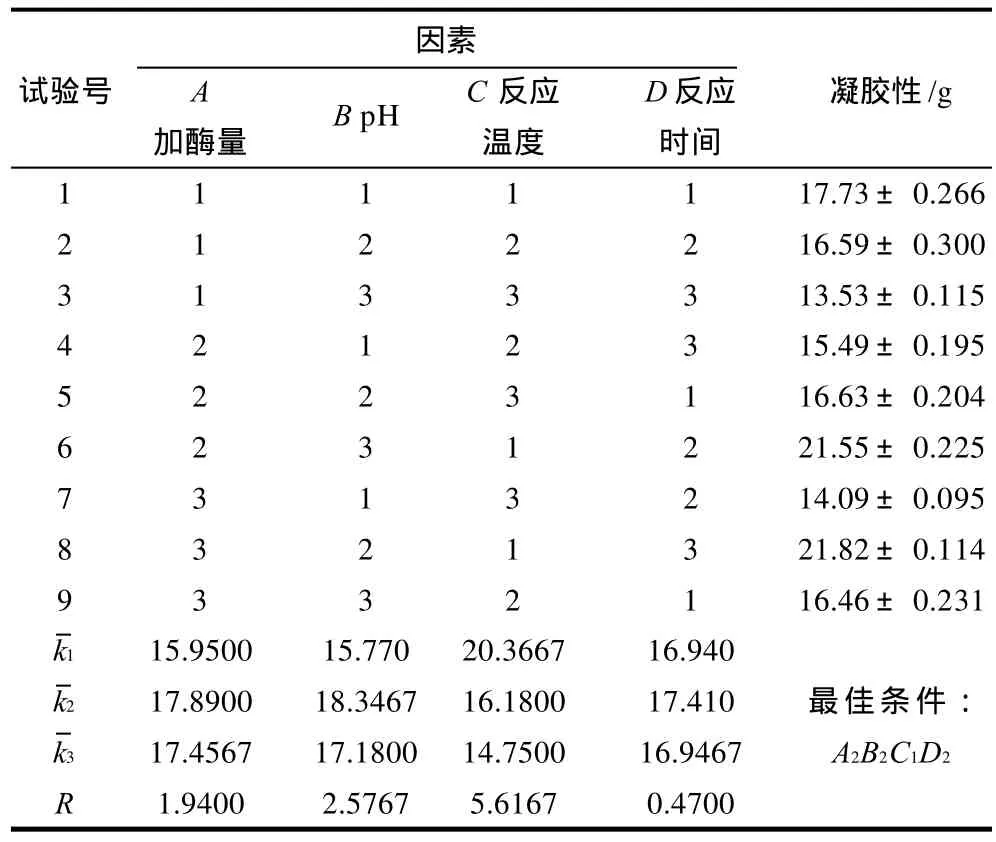
表2 正交试验结果和极差分析Table 2 Orthogonal array design matrix and experimental results
由表2可以看出,定义菜籽蛋白凝胶特性影响因素的主次顺序为C>B>A>D,即反应温度对菜籽蛋白凝胶特性的影响较大,pH值、加酶量次之,反应时间影响最小。根据试验结果分析,谷氨酰胺转氨酶改性菜籽蛋白凝胶特性的最佳条件为A2B2C1D2,即加酶量50U/g RPI、pH9.0、反应温度40℃、处理时间20min。在此条件下进行验证实验,菜籽蛋白的凝胶性可以达到23.65g,凝胶特性较好。
以影响因素D(反应时间)为误差项对上述试验结果进行方差分析,结果如表3所示,可以看出因素C(反应温度)对菜籽蛋白凝胶性的影响极显著(F=117.34>F0.01(2,2)=99.0,P<0.01),B(pH值)对菜籽蛋白凝胶性的影响显著(F=22.92>F0.05(2,2)=19.0,P<0.05),也就是说,在实际操作过程中,只有严格控制该酶反应的温度和p H值,才能达到预期的目的。
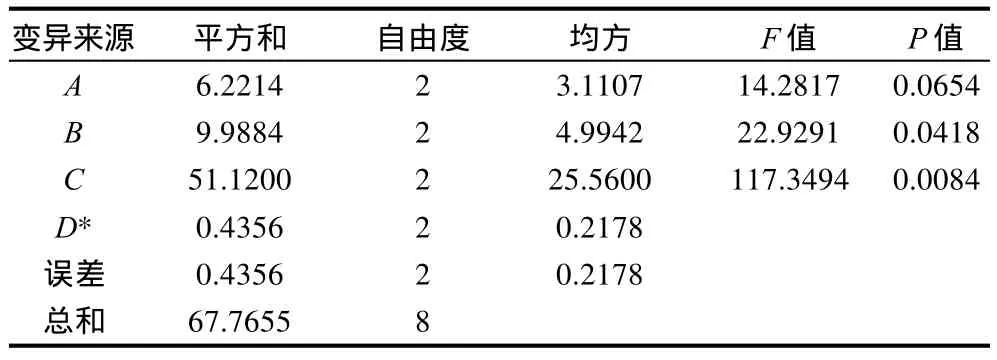
表3 方差分析表Table 3 Variance analysis for the gel property of rapeseed protein with various TG reaction conditions
3 结 论
通过单因素试验和正交试验,研究了谷氨酰胺转氨酶改性菜籽蛋白凝胶性的影响因素。结果表明:反应温度对菜籽蛋白凝胶特性的影响较大,pH值、加酶量次之,反应时间的影响最小,其中反应温度和pH值的影响较为显著,实际操作中应该严格控制这两个条件。得出谷氨酰胺转氨酶改性菜籽蛋白凝胶性的最佳工艺条件为:RPI质量浓度1.5g/10mL、加酶量50U/g RPI、pH9.0、反应温度40℃、反应时间20min,该条件下菜籽蛋白的凝胶性可以达到23.65g,凝胶性较好。
[1] BEROT S, COMPOINT J P, LARR C, et al. Large scale purification of rapeseed proteins (Brassica napusL.) [J]. Journal of Chromatography B,2005, 818(1):35-42.
[2] MOURE A, SINEIRO J, DOMINGUEZ H, et al. Functionality of oilseed protein products:A review[J] Food Research International, 2006,39(9):945-963.
[3] CUMBY N, ZHONG Ying, NACZK M, et al. Antioxidant activity and water-holding capacity of canola protein hydrolysates[J]. Food Chemistry,2008, 109(1):144-148.
[4] TANG Chuanhe, WU Hui, CHEN Zhong, et al. Formation and properties of glycinin-rich andβ-conglycinin-rich soy protein isolate gels induced by microbial transglutaminase[J]. Food Research International,2006, 39(1):87-97.
[5] RENKEMA J M S, LAKEMOND C M M, JONGH H H J, et al. The effect of pH on heat denaturation and gel forming properties of soy proteins[J]. Journal of Biotechnology, 2000 ,79(3):223-230.
[6] APICHARTSRANGKOON A. Effects of high pressure on rheological properties of soy protein gels[J]. Food Chemistry, 2003, 80(1):55-60.
[7] 严梅荣, 鞠兴荣, 王丹丹, 等. 碱提酸沉淀方法制取菜籽蛋白质的研究[J]. 中国粮油学报, 2009, 24(6):72-75.
[8] TANG Chuanhe, WU Hui, CHEN Zhong, et al. Formation and properties of glycinin-rich andβ-conglycinin-rich soy protein isolate gels induced by microbial transglutaminase[J]. Food Res Int, 2006, 39(1):87-97.
[9] 李俐鑫, 迟玉杰, 于滨. 蛋清蛋白凝胶特性影响因素的研究[J]. 食品科学, 2008, 29(3):46-49.
[10] ZHENG Hengguang, YANG Xiaoquan, TANG Chuanhe, et al. Preparation of soluble soybean protein aggregates (SSPA) from insoluble soybean protein concentrates (SPC) and its functional properties[J].Food Research International, 2008, 41(2):154-164.
[11] SHAND P J, YA H, PIETRASIK Z, et al. Transglutaminase treatment of pea proteins:Effect on physicochemical and rheological properties of heat-induced protein gels[J]. Food Chem, 2008, 107(2):692-699.
[12] PIETRASIK Z, JARMOLUK A, SHAND P J. Effect of non-meat proteins on hydration and textural properties of pork meat gels enhanced with microbial transglutaminase[J]. LWT- Food Science and Technology,2007, 40(5):915-920.
[13] KRAUSE J P, SCHWENKE K D. Behaviour of a protein isolate from rapeseed (Brassica napus) and its main protein components-globulin and albumin-at air/solution and solid interfaces, and in emulsions[J].Colloids and Surfaces B, 2001, 21(1/3):29-36.
[14] NIELSEN G S, PETERSEN B R, MLLER A J. Impact of salt, phosphate and temperature on the effect of a transglutaminase (F XIIIa) on the texture of restructured meat[J]. Meat Science, 1995, 41(3):293-299.
Gel Property of Transglutaminase-modified Rapeseed Protein
YUAN Jian1,JU Xing-rong1,HE Rong2,WANG Li-feng1,2,ZHU Xiao-hu1
(1. Jiangsu Provincial Laboratory of Quality Control and Further Professing of Food and Oil, College of Food Science and Engineering,Nanjing University of Finance and Economics, Nanjing 210003, China;2. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
TQ931
A
1002-6630(2010)18-0010-04
2009-11-19
国家“863”计划项目(2007AA10Z331);国家农业成果转化资金项目(2009C10045)
袁建(1965—),男,教授,本科,研究方向为食品科学。E-mail:yuanjian@njue.edu.cn
