生姜蛋白酶的大分子结合修饰
2010-10-19刘恩岐张建萍贺菊萍刘全德高明侠
刘恩岐,张建萍,贺菊萍,刘全德,高明侠
(徐州工程学院 江苏省食品生物加工工程技术研究中心,江苏 徐州 221008)
生姜蛋白酶的大分子结合修饰
刘恩岐,张建萍,贺菊萍,刘全德,高明侠
(徐州工程学院 江苏省食品生物加工工程技术研究中心,江苏 徐州 221008)
采用单甲氧基聚乙二醇(mPEG)和右旋糖苷对生姜蛋白酶进行大分子结合修饰。在酶液质量浓度为2.0mg/mL的硼酸缓冲液中,加入三聚氯氰活化的mPEG或高碘酸钠活化的右旋糖苷,于40℃修饰反应1h,对修饰剂与酶蛋白的质量比和pH值条件进行优化:mPEG与酶的质量比为17.5:1.0、pH9.0,mPEG修饰酶的修饰率为52.6%,相对酶活力(修饰酶活力/天然酶活力)为54.0%;右旋糖苷与酶的质量比为42:1、pH6.0,右旋糖苷修饰酶的修饰率为51.6%,其相对酶活力为原天然酶的3.3倍。两种修饰酶的热稳定性均比天然酶显著增强,且右旋糖苷修饰酶的热稳定性明显高于mPEG修饰酶。结果表明:右旋糖苷对生姜蛋白酶的修饰效果优于聚乙二醇,适用于酶蛋白的化学修饰与新型酶制剂的开发利用。
生姜蛋白酶;单甲氧基聚乙二醇;右旋糖苷;化学修饰
Abstract:Zinger protease was modified separately with monomethoxypolyethylene glycol (mPEG) and dextran to promote its activity and stability. Dextran and mPEG were activated by sodium periodate and by cyanuric chloride, respectively. The activated mPEG and dextran were solely added into sodium tetraborate buffer solution with 2.0 mg/mL zinger protease and then the mixed solutions were incubated at 40 ℃ for 1 h. The optimal mass ratio between modifying agent and zinger protease, and reaction pH were measured. When the ratio between mPEG and zinger protease was 17.5:1.0 and pH was 9.0, the modification rate of zinger protease modified with mPEG was 52.6% and the relative enzyme activity (activity of modified enzyme/activity of natural enzyme) was 54.0%. The modification rate of zinger protease modified with dextran was 51.6% and the relative enzyme activity was 3.3 at the conditions of dextran/zinger protease ratio of 42:1 and pH 6. The thermal stability of both modified enzymes was higher than that of natural enzymes; meanwhile, the thermal stability of zinger protease modified with dextran was higher than that of zinger protease modified with mPEG. Therefore, dextran has a better modification effect on zinger protease than mPEG. Dextran is more suitable for the chemical modification of proteases and the development and utilization of novel enzymes.
Key words:zinger protease;monomethoxypolyethylene glycol;dextran;chemical modification
生姜中蛋白酶的含量与木瓜、菠萝等热带水果资源相近,是一种有待开发利用的新的植物蛋白酶,但是由于其稳定性差、失活快,限制了生姜蛋白酶在生产中的推广应用[1]。大分子结合修饰是目前应用最广的酶蛋白修饰方法之一,对提高酶活力、增强稳定性具有显著效果[2]。通常采用的大分子结合修饰剂有聚乙二醇和右旋糖苷等,聚乙二醇(PEG)是一种线性、无毒且不带电的水溶性大分子[3],分子末端有两个能被活化的羟基,活化的PEG修饰剂主要和酶蛋白分子表面的残留氨基相偶联;右旋糖苷属于菌多糖,是由D-葡萄糖通过α-1,6糖苷键连接而成的高分子多糖,具有良好的生物相容性和水溶性,其糖链上的醛基经活化后可以与酶分子上的残留氨基相结合[4]。本研究在生姜蛋白酶分离纯化的基础上,采用单甲氧基聚乙二醇(mPEG)和右旋糖苷作为修饰剂,用活化的mPEG和右旋糖苷对生姜蛋白酶进行大分子结合修饰,研究修饰后的生姜蛋白酶的活性变化和热稳定性,为生姜蛋白酶的进一步研究利用提供参考依据。
1 材料与方法
1.1 材料与试剂
生姜 市售;单甲氧基聚乙二醇(mPEG5000) Fluka公司;右旋糖苷(dextran40000) 和光纯业工业株式会社;三聚氯氰(C3Cl3N3) Aldrich公司;高碘酸钠 天津基准化学试剂有限公司;2,4,6-三硝基苯磺酸 (TNBS)Sigma公司;硼氢化钠 国药集团化学试剂有限公司;聚乙二醇(PEG20000) 辽宁奥克化学集团有限公司。
1.2 仪器与设备
PHS-3C精密pH计 上海世义精密仪器有限公司;THZ-82型数显式电热恒温水浴锅 上海跃进医疗器械厂;HJ-3型数显恒温磁力搅拌器 常州国华电器有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司;LGJ-18A型冷冻干燥机 北京四环科学仪器厂有限公司。
1.3 方法
1.3.1 生姜蛋白酶的制备
将新鲜生姜洗净、切丁,每1kg生姜加入4℃预冷的磷酸缓冲液2L,用高速组织捣碎机搅碎制成匀浆,离心弃渣取上清液。将离心姜液进行超滤处理,得到相对分子质量大于10000、小于50000的生姜蛋白酶浓缩液。将生姜蛋白酶浓缩液与4℃预冷的丙酮按一定的比例混合,离心弃上清液,取沉淀自然风干,制得生姜蛋白酶粗粉[5]。将生姜蛋白酶粗粉用磷酸缓冲液溶解后,经葡聚糖凝胶G-200和二乙氨基乙基纤维素DE52进行两次柱层析纯化,透析脱盐后经冷冻干燥得到生姜蛋白酶纯品[6]。
1.3.2 生姜蛋白酶酶活力测定
生姜蛋白酶水解酪蛋白产生酪氨酸,在碱性环境下,酪氨酸与福林试剂作用产生有色物质,于波长660nm处进行光密度(OD)测定,光密度与酪氨酸的浓度成正比,用产生酪氨酸的量来表示生姜蛋白酶分解蛋白质的能力。在40℃、pH6.0条件下,每分钟水解酪蛋白产生1μg酪氨酸,定义为1个蛋白酶活力单位。具体测定方法参见SB/T 10317—1999《蛋白酶活力测定法》。
1.3.3 单甲氧基聚乙二醇对生姜蛋白酶的修饰
单甲氧基聚乙二醇(mPEG)的活化:采用三聚氯氰活化法[7-8],三聚氯氰使用前用无水苯重结晶两次。将1.0g三聚氯氰、10.0g mPEG5000、2.0g无水碳酸钠溶于100mL的无水苯,加入5A的分子筛5g,常温下搅拌反应,离心去除Na2CO3、5A分子筛等悬浮物,用200mL的乙醚沉淀,再用400mL的无水苯溶解沉淀。如此沉淀、溶解反复多次,去除没有反应的三聚氯氰,直至在258nm波长处检测无光吸收。冷冻干燥,得白色粉末,即为活化的mPEG。
活化mPEG化学修饰生姜蛋白酶的制备:在酶液质量浓度为2.0mg/mL的生姜蛋白酶硼酸缓冲液中,加入一定比例的活化mPEG修饰剂,于40℃水浴中保温反应lh[9],然后在磷酸缓冲液(0.lmol/L,pH7.0)中透析24h,用截留相对分子质量为10000的超滤膜超滤,截留浓缩液,冷冻干燥即得mPEG修饰的生姜蛋白酶。通过酶修饰率和修饰酶的活力测定,探讨活化mPEG的用量和pH值对修饰效果的影响。
1.3.4 右旋糖苷对生姜蛋白酶的修饰
右旋糖苷的活化:采用高碘酸钠活化法[10-11],取10.0g右旋糖苷溶于100.0mL蒸馏水,加入10.0mL质量分数为12%的NaIO4溶液,在4℃冰箱反应18h、滴加质量分数为5%的NaHSO3的溶液还原过量的NaIO4,室温下以蒸馏水透析4h后,再以5L的Na3PO4(pH7.4、0.lmol/L)缓冲液透析16h,再用PEG20000包埋透析袋,反透析浓缩后,冷冻干燥即得活化的右旋糖苷。
活化右旋糖苷化学修饰生姜蛋白酶的制备:在酶液质量浓度为2.0mg/mL的生姜蛋白酶硼酸缓冲液中,加入一定比例的活化右旋糖苷修饰剂,于40℃水浴中保温反应lh,添加NaBH4(50mg/mL)终止反应,再调pH值至7.0,对水透析4h,再用PEG20000反透析浓缩后,冷冻干燥即得修饰的生姜蛋白酶[12]。通过酶修饰率和修饰酶的活力测定,探讨活化右旋糖苷的用量和pH值对修饰效果的影响。
1.3.5 酶修饰率的测定
采用TNBS法测定。酶蛋白表面的游离氨基与过量的2,4,6-三硝基苯磺酸(TNBS)反应,生成三硝基苯酚的衍生物,在335nm波长处有最大吸收峰,根据这一原理可以检测出蛋白质表面残留的氨基。取1mL含1mg生姜蛋白酶的溶液,加入1mL质量分数为4%、pH8.5的碳酸氢钠溶液和1mL质量分数为10%的十二烷基磺酸钠溶液,20min后加入1mL质量分数为0.1%的2,4,6-三硝基苯磺酸(TNBS)溶液,40℃保温2h,加入1mol/L的盐酸0.5mL终止反应。335nm波长处测定吸光度。同样浓度的酶液在修饰反应后与反应前吸光度之比即为残留氨基量[13-14]。

式中:A1为酶液修饰反应前吸光度;A2为酶液修饰反应后的吸光度。
2 结果与分析
2.1 活化mPEG对生姜蛋白酶修饰条件的筛选
2.1.1 活化mPEG用量对生姜蛋白酶修饰效果的影响
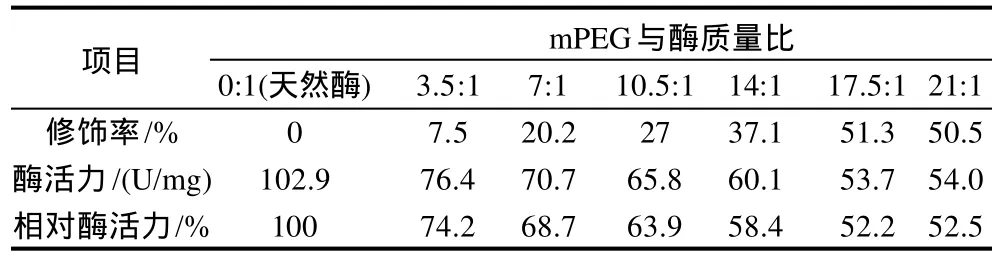
表1 mPEG用量对生姜蛋白酶修饰效果的影响Table 1 Effect of mPEG amount on modification efficiency of zinger protease
在酶液质量浓度为2.0mg/mL、pH9.0硼酸缓冲液中,于40℃条件下修饰反应lh,活化mPEG用量对生姜蛋白酶的修饰率和相对酶活力(修饰酶活力/天然酶活力)的影响见表1。mPEG和酶的比例决定了氨基修饰率的大小,随着活化mPEG加入量的增加,生姜蛋白酶的修饰率呈上升趋势,酶活力呈下降趋势。当mPEG与酶的质量比为17.5:1.0时,酶修饰率为51.3%,酶活回收率(相对酶活力)为52.2%,再增加mPEG的量,修饰率不再增加,酶的活力也几乎没有变化,因此选择mPEG与酶质量比为17.5:1.0作为生姜蛋白酶化学修饰较佳的mPEG用量。
2.1.2 pH值对mPEG修饰生姜蛋白酶效果的影响

表2 pH值对mPEG修饰生姜蛋白酶效果的影响Table 2 Effect of pH on modification efficiency of zinger protease modified with mPEG
在1.0mL酶液质量浓度为2.0mg/mL的硼酸缓冲液中加入35mg活力化的mPEG,不同pH值条件对生姜蛋白酶的修饰率和相对酶活力的影响见表2。随着pH值的增大,生姜蛋白酶的修饰率增大,相对酶活力也在增大,但是当pH值达到10.0时,酶修饰率与相对酶活力反而有所下降。说明酶分子对环境的pH值敏感,pH值能引起酶分子中可离解极性基团的离解状态和电荷改变,不仅影响修饰效果,也改变了未修饰酶的构型和构象,从而影响了酶活性。在pH9.0时,酶修饰率和相对酶活力均较高,因此选择pH9.0为最佳修饰pH值。
2.2 活化右旋糖苷对生姜蛋白酶修饰条件的筛选
2.2.1 活化右旋糖苷用量对生姜蛋白酶修饰效果的影响
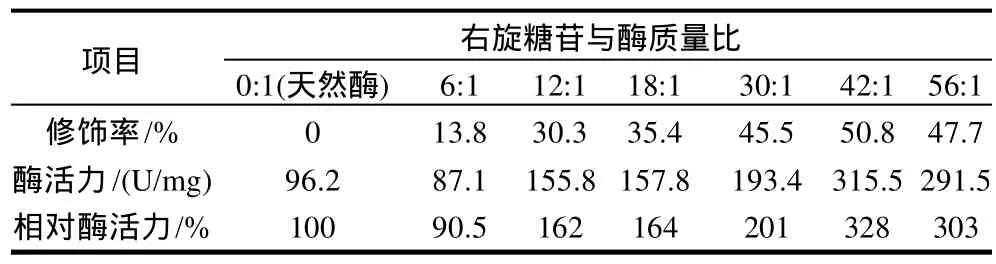
表3 右旋糖苷用量对生姜蛋白酶修饰效果的影响Table 3 Effect of dextran amount on modification efficiency of zinger protease
在酶液质量浓度为2.0mg/mL、pH6.0硼酸缓冲液中,于40℃条件下修饰反应lh,活化右旋糖苷用量对生姜蛋白酶的修饰率和相对酶活力的影响见表3。随右旋糖苷修饰剂用量的增加,修饰率和相对酶活力均呈上升趋势,当右旋糖苷与酶质量比为42:1时,生姜蛋白酶氨基修饰率为50.8%,相对酶活力为328%,再增加右旋糖苷的量,修饰率和酶的活力均有所降低,因此选择右旋糖苷与酶质量比为42:1作为生姜蛋白酶化学修饰较佳的右旋糖苷用量。
2.2.2 pH值对右旋糖苷修饰生姜蛋白酶效果的影响

表4 pH值对右旋糖苷修饰生姜蛋白酶效果的影响Table 4 Effect of pH on modification efficiency of zinger protease modified with dextran
在1.0mL酶液质量浓度为2.0mg/mL的硼酸缓冲液中加入84mg活化的右旋糖苷,不同pH值条件对生姜蛋白酶的修饰率和相对酶活力的影响见表4。在pH值中性至碱性的情况下,右旋糖苷对生姜蛋白酶的修饰率呈明显降低的趋势;在pH值偏酸性的条件下,修饰率和相对酶活力均较高;在pH6.0时,酶修饰率为52.3%,修饰酶活性是天然酶的3.3倍,因此选择pH6.0为最佳修饰pH值。这一结果与伍志权等[13]用右旋糖苷修饰酵母蔗糖酶的研究结果相近。
2.3 mPEG和右旋糖苷对生姜蛋白酶修饰效果的比较

表5 mPEG和右旋糖苷对生姜蛋白酶修饰效果的比较Table 5 Comparison of modification efficiency of zinger protease using mPEG and dextran
在实验确定的较佳修饰条件下,活化的mPEG和右旋糖苷对生姜蛋白酶修饰效果的比较见表5。两种修饰剂对生姜蛋白酶的修饰率接近,均在52%左右;mPEG修饰酶的残留相对酶活力为54.0%,右旋糖苷修饰酶的活性是天然酶的3.3倍,所以右旋糖苷对生姜蛋白酶修饰效果较好。
2.4 修饰酶与天然酶热稳定性的比较
将mPEG修饰酶、右旋糖苷修饰酶与天然酶分别在40、60℃和80℃条件下保温10、30min和60min,然后测定不同热处理时间的相对酶活力。生姜蛋白酶天然酶与两种修饰酶热稳定性的比较结果见表6。

表6 修饰酶与天然酶热稳定性的比较Table 6 Comparison of thermal stability between natural enzyme and modified enzyme
随着温度的升高和加热时间的延长,天然酶和修饰酶的酶活力都在不同幅度地下降。相同热处理条件下,修饰酶的活力相对于天然酶活力下降比较缓慢,热稳定性均比天然酶高,右旋糖苷修饰酶又比mPEG修饰酶的相对酶活力下降慢、热稳定性高。在80℃条件下热处理60min,天然酶、mPEG修饰酶和右旋糖苷修饰酶的相对酶活力分别为26.6%、43.2%和51.7%,右旋糖苷修饰酶的残留相对酶活力是天然酶的1.9倍,是mPEG修饰酶的1.2倍,右旋糖苷修饰酶的热稳定性优于mPEG修饰酶。
3 结论与讨论
采用三聚氯氰活化的单甲氧基聚乙二醇和高碘酸钠活化的右旋糖苷分别对生姜蛋白酶进行大分子结合修饰。结果表明,在修饰剂用量和修饰反应pH值较佳的条件下,mPEG和右旋糖苷对生姜蛋白酶的修饰率基本接近,右旋糖苷修饰酶的活性是原天然酶的3.3倍,而mPEG修饰酶的相对酶活力仅为原天然酶的54%;两种修饰酶的热稳定性均比天然酶显著增强,且右旋糖苷修饰酶的热稳定性明显高于mPEG修饰酶。在本实验优化得出的修饰反应条件下,右旋糖苷对生姜蛋白酶的修饰效果优于聚乙二醇,适合应用于提高酶活性和稳定性的化学修饰与新型酶制剂的开发利用等领域。
在影响酶蛋白分子的化学修饰反应的条件中,pH值是最重要的一个条件,因为它决定了具有潜在反应能力的功能基团所处的可反应和不可反应的离解状态。以三聚氯氰法活化的mPEG与酶蛋白反应的产物中,由于生成了HCl,根据化学平衡原理,要使氨基修饰反应继续进行,就需要pH值在碱性条件下,以便中和反应过程中生成的HCl[15],本实验确定的mPEG与酶蛋白修饰反应的最佳pH值为9.0可能与此有关。由高碘酸钠氧化右旋糖苷形成二醛基葡聚糖,右旋糖苷分子上的醛基与酶蛋白上的氨基共价结合得到修饰酶[13,15],而醛基在碱性条件下会发生羟醛缩合反应,因此推断本实验中酶蛋白的修饰率在pH值碱性条件下明显降低,右旋糖苷与酶蛋白修饰反应的最佳pH值为6.0,可能与右旋糖苷分子上的醛基在碱性条件下不稳定有关。
根据张平平等[16]研究报道和本结果显示,以酪蛋白为底物测定生姜蛋白酶活力,其最适作用pH值为6.0。本实验确定右旋糖苷与酶蛋白修饰反应的最佳pH值为6.0,与天然酶的最适pH值完全一致。确定的mPEG与酶蛋白修饰反应的最佳pH9.0,修饰酶相对酶活为55.8%;而pH6.0时,修饰酶相对酶活力仅为30.7%。据此推断,右旋糖苷修饰酶通过右旋糖苷分子上的醛基与酶蛋白上的氨基相结合,不影响生姜蛋白酶的最适作用pH值;mPEG修饰酶通过分子末端的两个能被活化的羟基与酶蛋白上的氨基相结合,改变了生姜蛋白酶的最适作用pH值;右旋糖苷修饰酶相对酶活显著提高,而mPEG修饰酶相对酶活明显降低,可能与酶蛋白的最适作用pH值变化有关。为揭示pH值对化学结合修饰改变酶的构型和构象变化的影响机制,应进一步研究酶蛋白和修饰剂分子表面具有修饰反应能力的可离解极性基团在不同pH值条件下的离解和电荷状态,以及修饰前后酶构象和基本酶学性质的变化,从而提高化学修饰的效果。
[1] 孙国梁, 刘涛, 王玉林, 等. 生姜蛋白酶的研究进展[J]. 中国食物与营养, 2007(5):19-21.
[2] 郑宝东. 食品酶学[M]. 南京:东南大学出版社, 2006:123-128.
[3] 田国贺, 郭佳宓, 吕团伟, 等. 聚乙二醇对菠萝蛋白酶的化学修饰[J].生物技术, 2006, 16(1):35-38.
[4] 杨锐, 沈青. 右旋糖苷的结构、特性、制备与应用[J]. 广州化学,2009, 34(3):49-58.
[5] 唐晓珍, 黄雪松, 乔聚林, 等. 生姜蛋白酶的工业提取方法比较[J].无锡轻工大学学报, 2003, 22(2):18-21.
[6] 代景泉, 黄雪松. 生姜蛋白酶的分离纯化[J]. 食品科学, 2003, 24(2):73-78.
[7] ABUCHOWSKI A, van ES T, PALCZUK N C, et al. Alteration of immunological properties of bovine serum albumin by covalent attachment of polyethylene glycol[J]. Journal of Biological Chemistry, 1977,252(11):3578-3581.
[8] 舒薇, 房师松, 崔堂兵, 等. 木瓜凝乳蛋白酶的单甲氧基聚乙二醇化学修饰及其对酶活力和抗原性的影响[J]. 卫生研究, 2006, 35(3):304-307.
[9] 应国清, 易喻, 石陆娥, 等. 单甲氧基聚乙二醇修饰蚓激酶的制备及性质研究[J]. 高校化学工程学报, 2005, 19(4):527-531.
[10] BENBOUGH J E, WIBLIN C N, RAFTER T N, et al. The effect of chemical modification ofL-asparaginase on its persistence in circulating blood of animals[J]. Biochem Pharmacol, 1979, 28(6):833-839.
[11] HAFSA K E. 吴梧桐, 刘景晶, 等. 右旋糖苷对大肠杆菌L-天门冬酰胺酶Ⅱ的化学修饰[J]. 药物生物技术, 1997, 4(4):208-211.
[12] 罗瑶, 古志平. 右旋糖苷对超氧化物歧化酶的化学修饰及性质研究[J]. 广州食品工业科技, 1998, 14(2):20-22.
[13] 伍志权, 黎春怡, 麦小珊, 等. 右旋糖苷修饰酵母蔗糖酶条件的筛选及修饰酶性质的研究[J]. 华南农业大学学报, 2009, 30(4):48-52.
[14] HABEEB A. Determination of free amino groups in proteins by trinitrobenzene sulfonic acid[J]. Analytical Biochemistry, 1966, 14(3):328-336.
[15] 易喻. 蝴激酶分子修饰的研究[D]. 杭州:浙江工业大学, 2004.
[16] 张平平, 卢绍娟, 刘宪华. 生姜蛋白酶的部分纯化及酶学性质研究[J]. 天津农学院学报, 2001, 8(3):19-23.
Chemical Modification of Zinger Protease
LIU En-qi,ZHANG Jian-ping,HE Ju-ping,LIU Quan-de,GAO Ming-xia
(Jiangsu Engineering Research Center for Food Biology Processing, Xuzhou Institute of Technology, Xuzhou 221008, China)
TS253.9
A
1002-6630(2010)21-0320-04
2010-06-29
江苏省高校自然科学研究计划项目(08KJD550001)
刘恩岐(1964—),男,教授,硕士,研究方向为食品生物技术。E-mail:ty-leq@163.com
