灰树花菌丝体β-葡聚糖的毒理学实验
2010-10-19王宝琴徐泽平杨传伦
王宝琴,徐泽平,杨传伦
(1.滨州市食品安全重点实验室,滨州学院生命科学系,山东 滨州 256600;2.山东仁和生物有限公司,山东 滨州 256500)
灰树花菌丝体β-葡聚糖的毒理学实验
王宝琴1,徐泽平2,杨传伦2
(1.滨州市食品安全重点实验室,滨州学院生命科学系,山东 滨州 256600;2.山东仁和生物有限公司,山东 滨州 256500)
目的:对灰树花菌株GF-932发酵菌丝体β-葡聚糖的食用安全性进行初步研究及评价。方法:采用最大限量法进行急性毒性实验;通过微生物回复突变实验(Ames实验)和小鼠骨髓嗜多染红细胞微核实验考察其致突变性;通过小鼠精原细胞染色体畸变实验和小鼠精子畸形实验考察其生殖毒性;通过大鼠30d喂养实验进行体质量、进食量、血液和生化等指标测定。结果:灰树花菌丝体β-葡聚糖小鼠急性毒性实验LD50大于20g/kg bw;灰树花菌丝体β-葡聚糖对鼠伤寒沙门氏菌组氨酸缺陷型菌株的回复突变实验结果为阴性;无致小鼠骨髓嗜多染红细胞微核作用,无致小鼠精原细胞染色体畸变作用,也无致小鼠精子畸形作用;大鼠30d 喂养实验期内,与对照组相比,体质量、食物利用率、血常规、血液生化、脏器系数等各项指标均无显著差异(P>0.05),各实验组大鼠生长发育良好。结论:灰树花菌株GF-932发酵菌丝体β-葡聚糖属实际无毒物质,无遗传毒性作用,对动物的生长发育无不良影响。
灰树花;β-葡聚糖;急性毒性实验;遗传毒性
Abstract:Objective:To evaluate the food safety ofβ-glucan from the fermented mycelia ofGrifola frondosastrain GF-932.Methods:Maximum limited amount method was used for the evaluation of acute toxicity. Microorganism reverse mutation test(Ames test) and mouse bone marrow cell micronucleus test were used to explore mutagenesis. Mouse spermatogonium chromosomal aberration test and sperm malformation test were used to assess reproductive toxicity. After 30-day feeding, rat body weight,food intake, blood cell and biochemical index were determined. Results:according to acute toxicity test, the LD50 ofβ-glucan from fermented the mycelia ofGrifola frondosawas more than 20 g/kg bw. Negative results were observed in Ames test and mouse bone marrow cell micronucleus test and spermatogonium chromosomal aberration test and sperm malformation test. Through 30-day feeding, the growth and development status of rats was improved. Compared with the control group, body weight, food utilization rate, organ-weight ratio, hematology and serum biochemical indices in rats fed the polysaccharide fromGrifola frondosaat different dosages did not exhibited an obvious difference (P> 0.05). Conclusion:β-glucan fromGrifola frondosais nontoxic and has no genetic toxicity. It does not have any negative effect on the growth and development status of animals.
Key words:Grifola frondosa;β-glucan;acute toxicity test;genetic toxicity
灰树花(Grifola frondosa(Dichs.ex Fr.) S.F.Gray)又名栗子蘑、莲花菌、贝叶多孔菌、干佛菌、叶奇果菌、云蕈等,在日本称为舞茸(maitake)[1]。研究证明,灰树花多糖有显著抑制肿瘤、免疫调节、抗病毒、调节血糖和血脂水平、改善脂肪代谢等多种生物活性[2-3]。灰树花的主要功效成分为多糖,其中起主要作用的是β-葡聚糖。灰树花菌丝体β-葡聚糖的化学结构为β-1,6/1,3-葡聚糖,即由葡萄糖以β-1,6-糖苷键连接形成主链,以β-1,3-糖苷键连接的葡萄糖支链生成的生物大分子[4]。灰树花多糖已被制成多种剂型的保健食品服用[5],灰树花药用口服制剂和注射剂也在研究开发中。
灰树花为我国部分地区的习用食用菌,有长期食用历史但未发现有害作用。有关灰树花菌丝体β-葡聚糖的毒理和代谢等食用安全性方面的基础研究很少,尤其是特殊毒性研究还很不系统。本研究主要针对灰树花菌丝体β-葡聚糖的食品毒理学进行探讨,以期为灰树花菌丝体β-葡聚糖的应用提供一定的参考。
1 材料与方法
1.1 材料、试剂与仪器
受试菌株是从野生环境中的天然菌株分离筛选并经过长期驯化得到的,经中科院微生物所鉴定为灰树花(Grifola frondosa(Dichs.ex Fr.) S.F.Gray),保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.1709[6]。
受试物灰树花β-葡聚糖为白色粉末,由灰树花发酵菌丝体提取纯化获得,含量为30%,由山东仁和生物有限公司提供,批号为:20060802。推荐日用量200mg。
清洁级昆明种小鼠:7~12周龄,体质量25~30g;清洁级Wistar大鼠:体质量50~70g。均由中国医学科学院医学实验动物研究所动物繁育场提供(许可证号:SCXK 11-00-0006)。实验动物使用许可证号:SYXK(鲁)20030006。
多氯联苯、疟的平、正定霉素、叠氮钠、丝裂霉素、二氨基芴(2,7-diaminofluorene,2-AF)均为国产医药级。
HY318全自动血细胞分析仪 法国Celly公司;HITACHI 7180全自动生化分析仪 日本日立公司;DMLB显微镜 徕卡公司;DYML-S50A高压灭菌器 北京勤诚盛达科学仪器有限公司;FA2104电子天平 上海上天精密仪器有限公司;载玻片、血细胞计数板、匀浆器、容量瓶、冰箱、培养皿、注射器、解剖剪、镊子。
1.2 方法
参照GB/T 15193—2003《食品安全性毒理评价程序和方法》[7]进行。
1.2.1 急性毒性实验
采用最大限量法。选择雌雄小鼠各10只,体质量18~22g。受试物剂量为20g/kg bw,分两次灌胃给予受试物,每次灌胃0.2mL/10g bw,间隔4h,记录动物的中毒表现及死亡情况,连续观察14d。
1.2.2 遗传毒性实验
微生物回复突变实验(Ames实验,平板渗入法)、小鼠骨髓嗜多染红细胞微核实验、精原细胞染色体畸变实验与小鼠精子畸形实验均按文献[7-8]进行。各实验所用阴性对照为灭菌蒸馏水,阳性对照为环磷酰胺(40mg/kg bw)。
按照《食品安全性毒理评价程序和方法》的要求,Ames实验受试样品的毒性由预实验获得,需设置5个剂量,且最高剂量为5mg/皿;骨髓嗜多染红细胞微核实验受试样品剂量一般取LD50的1/5、1/10、1/20三个剂量,LD50大于5g/kg bw时,最高剂量取5g/kg bw;结合急性毒性实验和微核实验的结果,精原细胞染色体畸变实验与小鼠精子畸形实验的最高剂量设置为2g/kg bw,按照等比级数向下设置中剂量和低剂量,分别为1g/kg bw和0.5g/kg bw。
1.2.3 大鼠30d喂养实验
选用体质量50~70g的断乳大鼠80只,随机分成4组,每组20只,雌雄各半。根据人体推荐剂量设立3个实验组,受试物剂量分别为0.1、0.2、0.4g/kg bw(分别相当于人用推荐剂量的30、60、120倍),将受试物掺入饲料中,按照动物体质量的10%计算食物摄入量(即受试物质量占食物质量的0.1%、0.2%、0.4%)饲喂实验动物。对照组大鼠饲喂基础饲料。单笼喂养,自由饮食,每周称质量,记录饲料加入量、剩余量。进食量为加入食物量和食物剩余量的差值,食物利用率=一定时间内动物体质量的增加量/一定时间内动物的进食量。连续观察30d。第30天按照参考文献[7]进行血像、生化指标、脏器系数等指标测定。
2 结果与分析
2.1 急性毒性实验结果
灌胃给予受试物后,雌、雄小鼠均未出现中毒症状,14d内实验小鼠无死亡。即该受试物对雌、雄小鼠的急性毒性LD50均大于20g/kg bw。根据急性毒性分级标准,该受试物属实际无毒物质。
2.2 遗传毒性实验结果
2.2.1 Ames实验结果
受试物各剂量组的回变菌落数均未超过自发回变菌落数的2倍,也不呈剂量-反应关系。说明在加与不加S-9时,该样品对4株鼠伤寒沙门氏菌实验株TA97、TA98、TA100、TA102均未呈现遗传毒性,即微生物回复突变实验结果为阴性(表1)。
2.2.2 小鼠骨髓嗜多染红细胞微核实验
经Poisson分布检验结果表明,受试物各剂量组与阴性对照组小鼠骨髓嗜多染红细胞微核率无显著性差异(P>0.05),而阳性对照组与阴性对照组小鼠骨髓嗜多染红细胞微核率有极显著性差异(P<0.01),说明该受试物无致小鼠骨髓嗜多染红细胞微核作用,小鼠骨髓嗜多染红细胞微核实验结果为阴性(表2)。
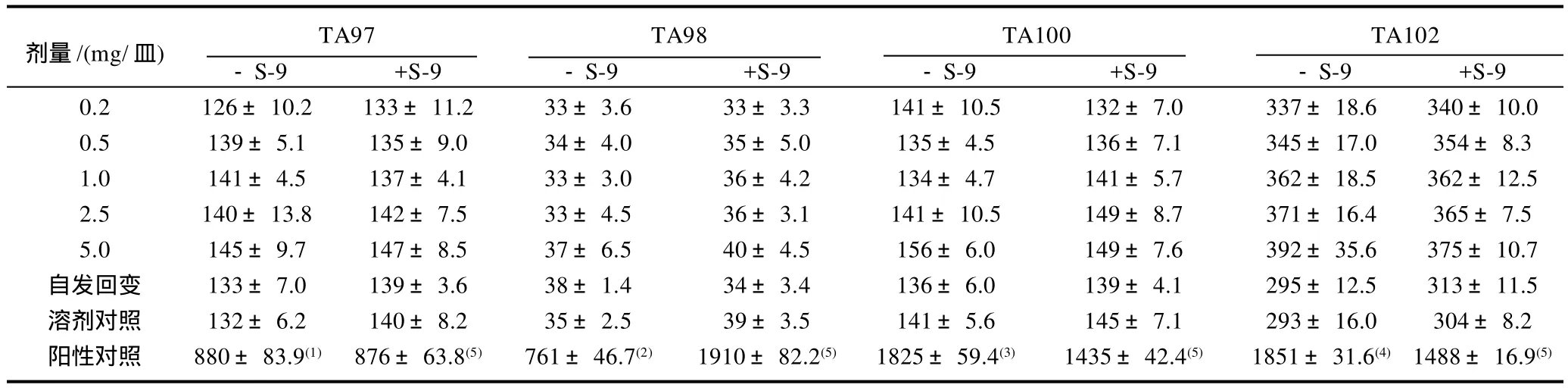
表1 灰树花β-葡聚糖对微生物回复突变的影响(Ames实验)Table 1 Results of Ames test ofβ-glucan from fermented mycelia ofGrifola frondosa CFU
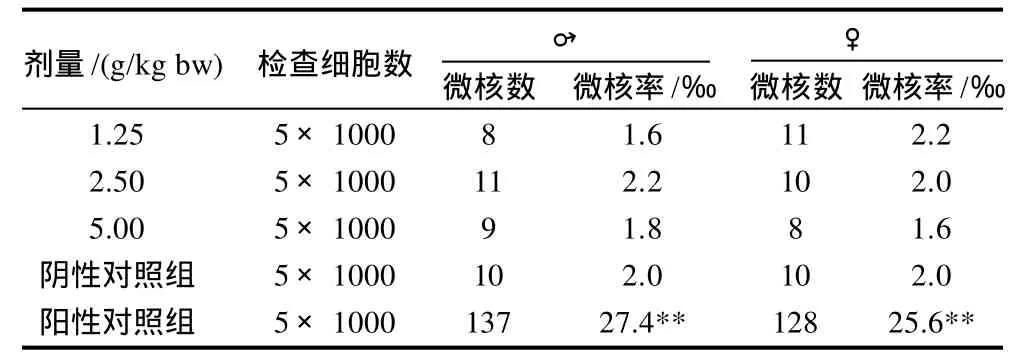
表2 灰树花β-葡聚糖对小鼠骨髓嗜多染红细胞微核率的影响(n=5)Table 2 Results of mouse bone marrow cell micronucleus test ofβ-glucan from fermented mycelia ofGrifola frondosa(n=5)
2.2.3 小鼠精原细胞染色体畸变实验与小鼠精子畸形实验
由表3可见,受试物各剂量组与阴性对照组小鼠精原细胞染色体畸变率相比无显著性差异(P>0.05),而阳性对照组与阴性对照组小鼠精原细胞染色体畸变率有极显著性差异(P<0.01),说明该受试物无致小鼠精原细胞染色体畸变作用,小鼠精原细胞染色体畸变实验结果为阴性。受试物各剂量组与阴性对照组的小鼠精子畸形率相比无显著性差异(P>0.05),而环磷酰胺阳性对照组小鼠与阴性对照组的小鼠精子畸形率有极显著性差异(P<0.01),该受试物无致小鼠精子畸形作用,小鼠精子畸形实验结果为阴性。
2.3 大鼠30d喂养实验
2.3.1 动物的体质量和食物利用率
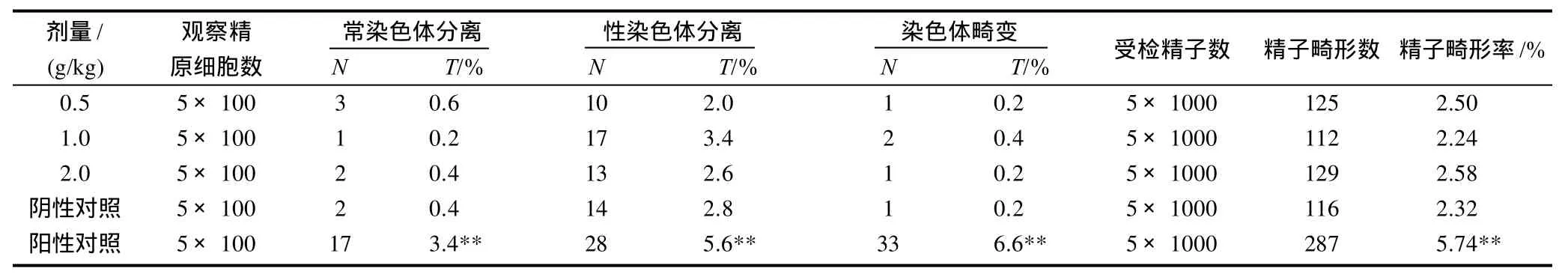
表3 灰树花β-葡聚糖对小鼠精原细胞染色体畸变和精子畸形的影响Table 3 Results of mouse spermatogonium chromosomal aberration test and sperm malformation test ofβ-glucan from fermented mycelia ofGrifola frondosa

表4 灰树花β-葡聚糖对30d喂养实验大鼠体质量的影响Table 4 Effect of 30-day feeding ofβ-glucan from fermented mycelia ofGrifola frondosaon body weight in Wistar rats

表5 灰树花β-葡聚糖对30d喂养实验大鼠食物利用率的影响Table 5 Effect of 30-day feeding ofβ-glucan from fermented mycelia ofGrifola frondosaon food utilization rate in Wistar rats
在大鼠30d喂养实验中,各试验组动物均未出现拒食现象,活动正常。由表4、5可知,各实验组大鼠与对照组大鼠的体质量、进食量、食物利用率无显著性差异(P>0.05)。
2.3.2 血常规及生化指标

表6 灰树花β-葡聚糖对30d喂养实验大鼠血细胞的影响Table 6 Effect of 30-day feeding ofβ-glucan from fermented mycelia ofGrifola frondosaon blood cells in Wistar rats
从表6、7可知,与对照组比较,各实验组大鼠血红蛋白、红细胞总数、白细胞总数及其分类、谷丙转氨酶、谷草转氨酶、尿素氮、肌苷、胆固醇、甘油三酯、血糖、总蛋白、白蛋白等指标均无显著性差异(P>0.05)。
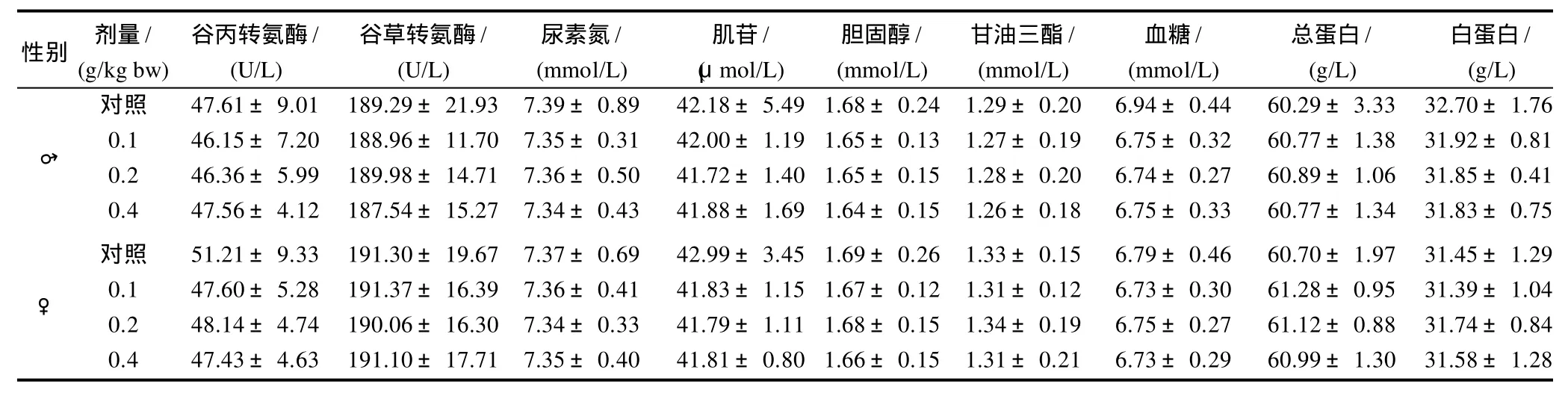
表7 灰树花β-葡聚糖对30d喂养实验末期大鼠血液生化指标的影响Table 7 Effect of 30-day feeding ofβ-glucan from fermented mycelia ofGrifola frondosaon serum biochemical indexes in Wistar rats
2.3.3 组织学检查
大体观察各实验组大鼠未发现异常,解剖时亦未发现膀胱、肝总管结石,脏器系数未见异常(表8)。其他脏器如脾、肾、肠、睾丸、卵巢等均未见明显异常。与对照组相比未出现有意义的病理改变。
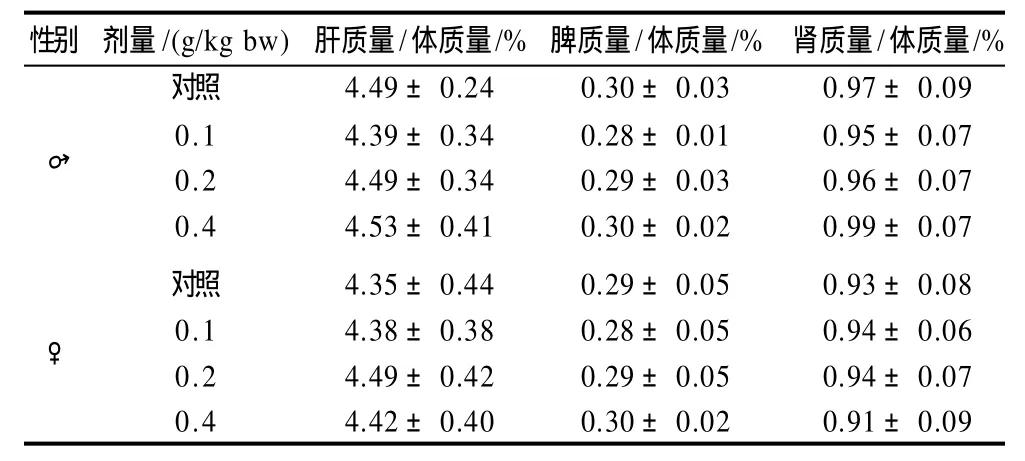
表8 灰树花β-葡聚糖对30d喂养实验大鼠脏器质量/体质量的影响(n=10)Table 8 Effect of 30-day feeding ofβ-glucan from fermented mycelia ofGrifola frondosaon organ/weight ratio in Wistar rats (n=10)
3 讨 论
本研究中,小鼠急性毒性实验结果表明,受试物灰树花菌株GF-932发酵的菌丝体β-葡聚糖LD50大于20g/kg bw。按照WHO化学物质的急性毒性分级标准[7],灰树花菌株GF-932发酵的菌丝体β-葡聚糖属于实际无毒物质。在大鼠30d喂养实验中,各实验组动物均未出现拒食现象,活动正常;各实验组大鼠与对照组大鼠的体质量、进食量、食物利用率无显著性差异(P>0.05);与对照组比较,各实验组大鼠血红蛋白、红细胞总数、白细胞总数及其分类、谷丙转氨酶、谷草转氨酶、尿素氮、肌苷、胆固醇、甘油三酯、血糖、总蛋白、白蛋白等指标均无显著性差异(P>0.05);组织学检查表明,与对照组相比未出现有意义的病理改变。实验说明灰树花菌丝体β-葡聚糖对动物的生长发育无不良影响。
ICH推荐的遗传毒性实验标准组合是:一项细菌基因突变实验;一项哺乳动物细胞染色体损伤细胞遗传学评价或小鼠淋巴瘤TK检测体外实验;一项啮齿类动物造血细胞染色体损伤实验;这3个组合符合国际有关的遗传毒性实验标准组合[9]。按照ICH推荐的遗传毒性实验标准组合,本研究分别通过微生物回复突变实验(Ames实验)、小鼠骨髓嗜多染红细胞微核实验、小鼠精原细胞染色体畸变实验、小鼠精子畸形实验以考察灰树花菌株GF-932菌丝体β-葡聚糖的致突变性和生殖毒性。结果表明:灰树花菌丝体β-葡聚糖无致小鼠骨髓嗜多染红细胞微核作用;无致小鼠精原细胞染色体畸变作用;无致小鼠精子畸形作用和对鼠伤寒沙门氏菌组氨酸缺陷型菌株的回复突变实验结果为阴性。即灰树花菌丝体β-葡聚糖无致突变作用和无遗传毒性作用。
食品安全性毒理学评价分为4个阶段,其中第一阶段实验是急性毒性实验;第二阶段实验是遗传毒性实验、30d喂养实验和传统致畸实验;第三阶段实验是90d喂养实验和繁殖实验;第四阶段是慢性毒性实验。以普通食品和药食同源物质为原料生产的保健食品必须进行第一和第二阶段的毒理学实验[7]。本研究中的灰树花是有长期食用历史的食用菌,其发酵菌丝体提取的β-葡聚糖按食品安全性毒理学评价要求,需进行第一和第二阶段的毒理学实验。因此,灰树花菌株GF-932发酵菌丝体β-葡聚糖在致突变性、生殖毒性、遗传毒性、小鼠急性毒性和大鼠30d喂养实验等方面的研究结果可以对灰树花菌株GF-932菌丝体β-葡聚糖进行食品安全性的初步评价。即灰树花菌丝体β-葡聚糖属实际无毒物质。
本研究中灰树花菌丝体β-葡聚糖与报道的香菇多糖[10]和灵芝孢子粉[11]都属于实际无毒物质。作为一种具有生物活性的真菌多糖来说,灰树花菌丝体β-葡聚糖在食品添加剂、保健食品方面具有较高开发应用价值。
[1] 孙震, 陈石良, 谷文英. 灰树花多糖体内抗肿瘤作用的实验研究[J].药物生物技术, 2001, 8(5):279-283.
[2] MAYELL M. Maitake extracts and their therapeutic potential[J]. Alternative Medicine Review, 2001, 6(1):48-60.
[3] 劳华均, 闵三弟, 藏珍娣, 等. 灰树花多糖的抗肿瘤作用及对巨噬细胞、自然杀伤细胞的影响[J]. 上海农业学报, 1997, 13(1):25-30.
[4] 李春林, 于广利, 赵峡, 等. 灰树花菌丝体中几种多糖的分离及结构表征[J]. 中国生化药物杂志, 2004, 25(1):20-22.
[5] 尹承先, 徐泽平, 马韵升, 等. 维吉尔在中晚期恶性肿瘤治疗中的应用效果观察[J]. 中华医学研究与实践, 2004, 2(7):27-28.
[6] 徐泽平, 王宝琴. 灰树花菌株、培养方法及其应用:中国, ZL 200610043944.2[P]. 2008-11-12.
[7] GB/T 15193—2003食品安全性毒理评价程序和方法[S].
[8] 王宝琴, 徐泽平, 张彬彬, 等. 灰树花多糖的生殖与遗传毒性研究毒[J]. 毒理学杂志, 2008, 22(5):407-408.
[9] 李钧. 最新药品注册技术精讲[M]. 北京:化学工业出版社, 2005:336-360.
[10] 韩晶, 芮箐. 硫酸香菇多糖致突变性实验研究[J]. 癌变·畸变·突变, 2001, 13(4):54.
[11] 邓丽霞, 胡斌, 陈小君, 等. 萌动激活赤灵芝孢子粉致畸、致突变和抗突变的实验研究[J]. 癌变·畸变·突变, 2002, 14(3):51-53.
Toxicological Evaluation ofβ-Glucan from Fermented Mycelia ofGrifola frondosa
WANG Bao-qin1,XU Ze-ping2,YANG Chuan-lun2
(1. Key Laboratory for Food Safety of Binzhou, Department of Life Science, Binzhou University, Binzhou 256600, China;2. Shandong Renhe Biological Co. Ltd., Binzhou 256500, China)
TS255.1
A
1002-6630(2010)17-0368-05
2010-02-01
国家重点新产品计划项目(2007GRC60031);滨州市应用技术研究与开发项目(200705);滨州学院校内重大招标课题
王宝琴(1970—),女,副教授,博士,研究方向为生物活性物质。E-mail:wangbaoqin1999@126.com
