酵母细胞破碎条件优化及高肽酶菌株筛选
2010-10-19李永霞曾海英秦礼康
李永霞,曾海英,秦礼康*
(贵州大学生命科学学院,贵州 贵阳 550025)
酵母细胞破碎条件优化及高肽酶菌株筛选
李永霞,曾海英,秦礼康*
(贵州大学生命科学学院,贵州 贵阳 550025)
为构建酵母细胞总肽酶活力的测定方法。采用单因素试验和L9(34)正交试验设计,以反应体系中游离氨基酸总量为肽酶活力指标,对酵母细胞破碎条件进行优化。结果表明:最佳破壁条件为:蜗牛酶添加量10mg/mL、超声破碎功率500W、超声时间8min、超声时间间隔5s。在此条件下,对主要源于贵州特色发酵豆制品的61株酵母菌进行总肽酶活力测定,获得产高肽酶酵母菌4株,即WCF-5、XWF-1、XWF-7和YZJ-4。
酵母菌;破碎;总肽酶;发酵豆制品
Abstract:To construct a method for determining total peptidase activity in yeast cells, a L9(34) orthogonal array design generated based on single-factor experiments was employed to optimize conditions for yeast cell disruption. In the optimization, the effects of 4 conditions for yeast cell disruption on total free amino acid amount in reaction system were dealt with. Snailase dose of 10 mg/mL, ultrasonic power of 500 W, ultrasonic treatment time of 8 min and ultrasonic operation interval of 5 s were found optimum. Under these optimum conditions, 61 yeast strains originated from unique Guizhou-style fermented soybean products were subjected to total peptidase activity determination, and 4 of them, namely WCF-5, XWF-1, XWF-7 and YZJ-4, were found have higher pepetidase activity.
Key words:yeast;disruption;total peptidases;fermented soybean products
大豆发酵食品,因富含丰富的营养成分和特殊的“一、二次生理活性物质”,倍受世界各国的高度重视[1]。大豆发酵食品除突出的营养健康功能外[2],独特的风味特征日益成为市场需求剧增的决定性因素[3],而产品特征风味的形成主要取决于大量挥发与非挥发化合物之间的综合平衡,在形成这些化合物的生化途径中,以蛋白质降解及其氨基酸代谢最为关键[4]。因为蛋白质网络结构破裂所引起的质构改变,有利于滋香味化合物的释放,降解产生的短肽和游离氨基酸,不仅直接赋予产品滋味[5],而且还作为挥发性化合物的前体,经氨基酸水解酶、转氨酶等催化进行次生代谢或者与还原糖进行Maillard反应,形成大量的挥发性风味物质[6-7]。目前,筛选高蛋白酶、高肽酶、高氨基酸水解酶和转氨酶的菌株,进行扩培菌剂制备和菌群强化发酵,已成为缩短高蛋白发酵食品后熟期的主要途径。
研究资料表明,酵母菌作为发酵食品中常见的益酵菌株之一,可利用自身酶系进行发酵,产生大量酯香、醇香等风味物质,在酱油、腐乳等传统发酵豆制品的后熟期,酵母菌发酵对风味成分形成也起到了不容忽视的作用[8]。肽酶是能分解蛋白短肽的酶类总称,大多存在于微生物细胞内,在发酵过程中当细胞自溶后,便释放肽酶水解肽类形成氨基酸,作为风味前体。因此,为了构建酵母细胞总肽酶活力的测定方法,本实验对酵母细胞破碎方法和条件进行优化,同时对源于贵州特色发酵豆制品的酵母菌进行高肽酶菌株筛选,为生产应用提供益酵菌株。
1 材料与方法
1.1 菌株、培养基与试剂
实验菌株:从贵州各地极具风味特色的发酵制品中分离纯化出来的酵母菌株,共61株。菌株来源及编号见表1。其中,用于酵母细胞破碎实验的菌株编号为ZF-5。
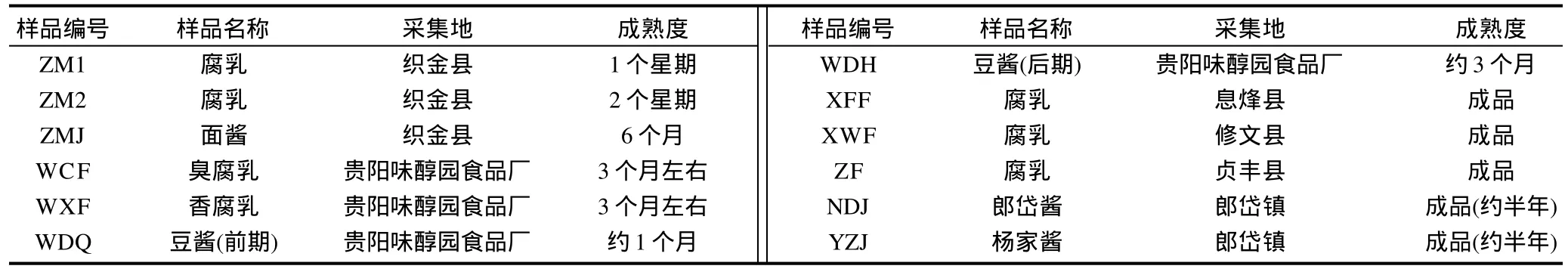
表1 供试菌株来源及编号Table 1 Sources and numbers of tested strains
培养基:虎红培养基购于上海盛思生化科技有限公司;PDA液体培养基为实验室自制[9]。
大豆肽粉购于上海西王淀粉有限公司(执行标准为QB/T 2653—2004《大豆肽粉》);三羟甲基氨基甲烷(Tris)、盐酸、氯化钠、溶菌酶、茚三酮、亮氨酸、乙酸、乙酸钠、乙醇、抗坏血酸均为分析纯。
1.2 仪器与设备
VCX750超声细胞破碎仪 美国Sonics公司;冷冻离心机 长沙迈佳森仪器设备有限公司。
1.3 方法
1.3.1 亮氨酸标准曲线的测定
准确取50mg/L的亮氨酸标准溶液[10]。取8支20mL具塞刻度试管并编号,参照文献[11]中操作步骤加入各种试剂,盖上玻璃塞,混匀。再在100℃水浴中加热15min(加热时封口),取出后立即置于冷水中迅速冷却。然后迅速向每管中加入5mL 95%乙醇,塞好塞子,猛摇试管,此时溶液呈紫色。然后用60%乙醇稀释至20mL,以0号管为参比进行调零,于570nm波长处测定溶液的吸光度,重复3次,然后绘制标准曲线,求出线性方程[11]。得出亮氨酸标准曲线线性方程为y=0.8335x- 0.0328,R2=0.9978。
1.3.2 酵母菌总肽酶活力测定
酵母菌总肽酶活力测定的流程:
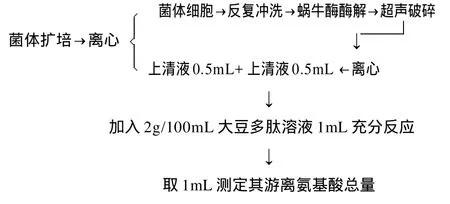
1.3.2.1 菌种复壮活化
对所获菌株进行平板划线培养后染色镜检,观察菌体形态与原菌株记录结果是否一致,纯化检查合格者,钓菌进行保种工作。将菌种接种于液体PDA培养基中,(28±1)℃条件下培养48~72h,反复转接2~3次,使其恢复良好的生长传代能力。
1.3.2.2 收集菌体
将活化好的菌株5mL接种于50mL液体PDA培养基中,于(28±1)℃条件下培养48h左右,取菌液于4℃条件下10000r/min离心5min,得到菌体细胞。上清液置4℃冰箱保存备用。
1.3.2.3 酵母菌总肽酶液的制备[12]
将所获菌体用生理盐水反复冲洗2~3次后,与标准比浊管比对菌浓度为1.5×108CFU/mL左右,菌体离心后使其悬浮在4mL含有40mg蜗牛酶、1mol/L山梨醇、0.02mol/L柠檬酸-磷酸(pH5.8)缓冲液中,置37℃水浴锅中水浴3h,使酶与菌体完全反应,然后10000r/min离心5min,将所获沉淀,即酵母菌球形体悬浮于10mL pH7.5的Tris-HCl缓冲液中冰浴超声破碎,条件为功率500W,超声时间间隔5s,总超声时间8min。超声完成后将菌液10000r/min离心5min,收集上清液。取1.3.2.2节的上清液以及超声破碎得到的上清液各0.5mL于小试管中。该液体即为待测肽酶液。
1.3.2.4 肽酶活力测定反应体系
取制备的肽酶液1mL,加入质量浓度2g/100mL的无菌大豆肽溶液1mL,置于3mL pH7.5的Tris-HCl缓冲液中反应过夜[13],最后取反应液1mL,测定其中游离氨基酸总量。
1.3.3 反应体系中游离氨基酸总量计算
吸取1mL反应液,置于20mL干燥具塞刻度试管中,加入1mL无氨蒸馏水。其他操作步骤与制作标准曲线方法相同。根据显色液的吸光度,在标准曲线上查出相应的氨基酸量,反应体系中的游离氨基酸总量以每100mL反应液中的氨基酸含量(mg)表示。
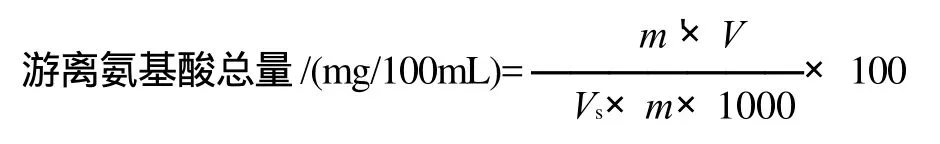
式中:m'为从标准曲线查得的氨基酸的质量/μg;V为样品提取液总体积/mL;Vs为测定时所取样品液体积/mL;m为样品质量/g。
2 结果与分析
2.1 影响总肽酶活力的酵母菌破碎单因素试验
为了筛选高肽酶活力的菌株,需要对供试菌株进行细胞破碎,使其胞内肽酶能够溶出,以便与反应底物充分结合。目前酵母细胞的破碎方法主要有酶法、机械破碎法、化学渗透法、液氮冻融法等,但是无论采用哪种单一的方法破碎效果均不理想,而且单一方法对酶活力影响较大[14]。故本实验采用酶法与机械破碎即超声破碎相结合来进行酵母菌细胞破碎。
2.1.1 蜗牛酶添加量对总肽酶活力的影响
蜗牛酶是从蜗牛的嗦囊和消化道中制备的混合酶,它含有纤维素酶、果胶酶、淀粉酶、蛋白酶等20多种酶[15]。可以用于植物及酵母细胞壁的破碎,因此广泛用于细胞生物学和基因工程学的研究。将离心获得的菌体等量悬浮于4mL含有1mol/L山梨醇、0.02mol/L柠檬酸-磷酸(pH5.8)缓冲液中,分别添加蜗牛酶10、30、50、70mg,置37℃水浴锅中水浴3h,然后再于超声功率500W,超声时间间隔5s条件下超声破碎10min。得到的酶液与多肽溶液反应,最后测定反应体系中游离氨基酸总量,结果见图1。

图1 蜗牛酶添加量对体系中游离氨基酸总量的影响Fig.1 Effect of snailase dose on total free amino acid amount in reaction system
由图1可知,随着蜗牛酶添加量的增大,样品中游离氨基酸总量不断升高。当蜗牛酶添加量增大到30mg后,样品中游离氨基酸总量升高趋势缓慢,当蜗牛酶添加量增大到50mg后趋于稳定。综合考虑到蜗牛酶添加过量会造成结果偏高以及成本等因素,选择蜗牛酶添加量控制在30~50mg之间。
2.1.2 超声破碎功率对总肽酶活力的影响
将离心获得的菌体等量悬浮于4mL含有50mg蜗牛酶、1mol/L山梨醇、0.02mol/L柠檬酸-磷酸(pH5.8)缓冲液中,置37℃水浴锅中水浴3h。然后分别在超声功率为100、300、500、700W条件下超声10min,超声时间间隔5s。得到的酶液与多肽溶液反应,最后测定反应体系中游离氨基酸总量,结果见图2。
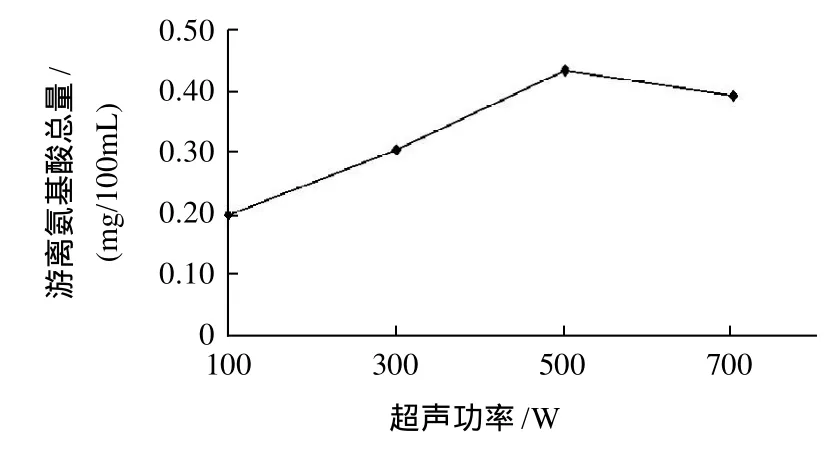
图2 超声功率对体系中游离氨基酸总量的影响Fig.2 Effect of ultrasonic power on total free amino acid amount in reaction system
由图2可知,随着超声功率的不断增大,样品中游离氨基酸总量先是升高随后降低。考虑到超声功率太大会使酶活力有所下降,故选择功率在300~500W之间。
2.1.3 超声破碎时间对总肽酶活力的影响
获得的菌体等量悬浮于4mL含有50mg蜗牛酶、1mol/L山梨醇、0.02mol/L柠檬酸-磷酸(pH5.8)缓冲液中,置37℃水浴锅中水浴3h。然后分别在超声功率为500W条件下分别超声1、5、10、15、20min,超声时间间隔5s。得到的酶液与多肽溶液反应,最后测定反应体系中游离氨基酸总量,结果见图3。
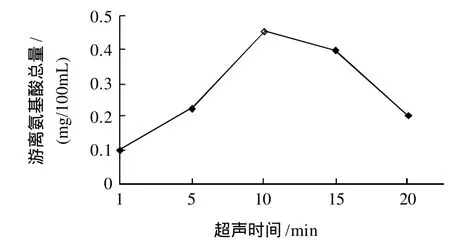
图3 超声时间对体系中游离氨基酸总量的影响Fig.3 Effect of ultrasonic treatment time on total free amino acid amount in reaction system
由图3可知,随着超声时间的延长,样品中游离氨基酸总量先是不断升高,当时间增大到10min左右时样品中游离氨基酸总量升到最大值,随后开始下降。故超声时间可控制在10min左右。
2.1.4 超声破碎时间间隔对总肽酶活力的影响
运用超声波对细胞进行破碎的过程中会产生大量的热,而温度过高则会使酶失活。所以为保证总肽酶的活力,在冰浴超声外,还要间隔一定时间,以使缓冲体系的温度保持基本恒定。获得的菌体等量悬浮于4mL含有50mg蜗牛酶、1mol/L山梨醇、0.02mol/L柠檬酸-磷酸(pH5.8)缓冲液中,置37℃水浴锅中水浴3h。然后分别在超声功率为500W条件下超声10min,超声时间间隔分别为1、3、5、7、9s。得到的酶液与多肽溶液反应,最后测定反应体系中游离氨基酸总量,结果见图4。
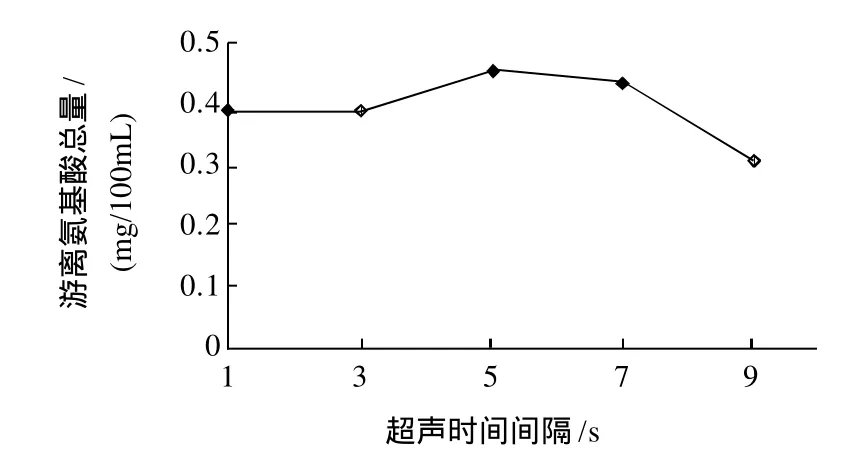
图4 超声时间间隔对体系中游离氨基酸总量的影响Fig.4 Effect of ultrasonic operation interval on total free amino acid amount in reaction system
由图4可知,超声时间间隔控制在1~7s之间,样品中游离氨基酸总量趋于平稳,大于7s时游离氨基酸总量会下降。故可选择时间间隔控制在5s左右。
2.2 酵母细胞破碎条件的优化
在单因素试验的基础上,对影响细胞总肽酶活力的蜗牛酶添加量、超声时间、超声功率和超声时间间隔进行L9(34)正交试验,因素水平见表2。正交试验中,以反应体系中总游离氨基酸含量作为优化的指标,结果见表3。
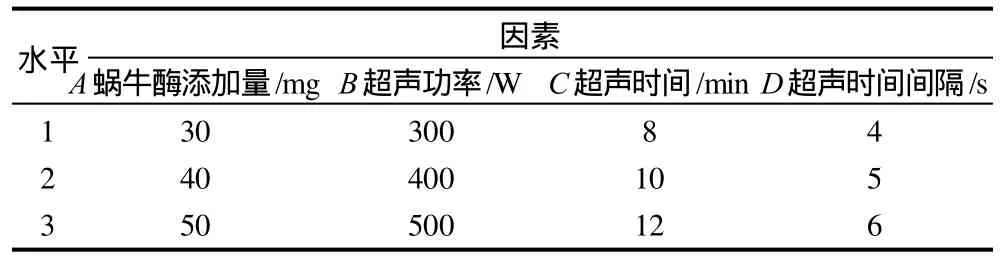
表2 正交试验因素水平表Table 2 Factors and levels in the orthogonal array design
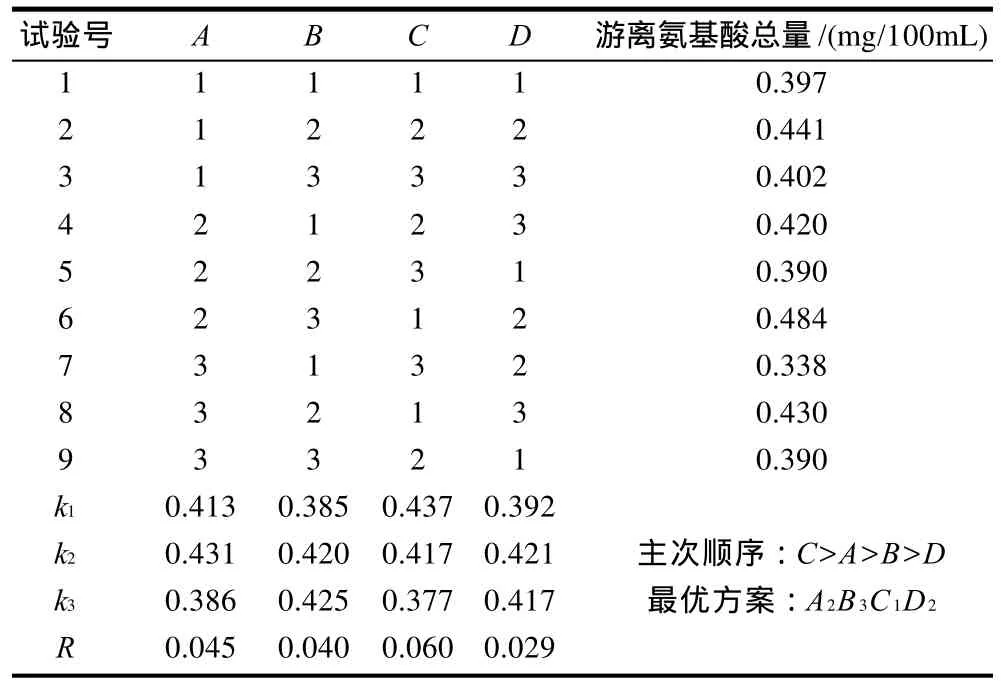
表3 酵母菌细胞破碎正交试验结果Table 3 Orthogonal array layout and experimental results
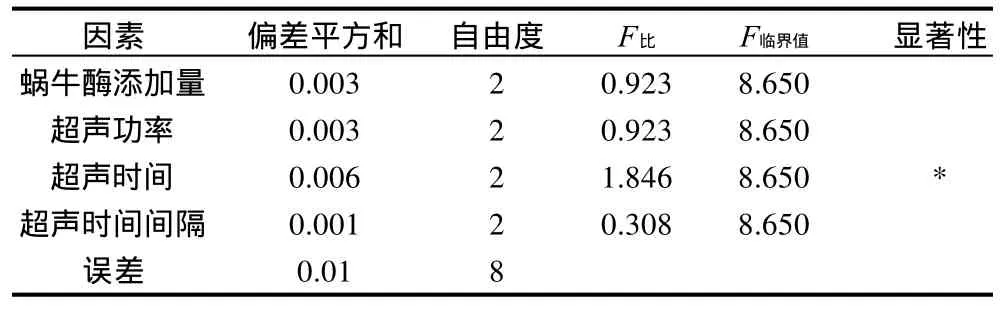
表4 酵母破碎正交试验方差分析表Table 4 Variance analysis for total free amino acid amount in reaction system with various cell disruption conditions
从表3可以看出,对酵母细胞总肽酶活力影响最大的因素是超声时间,其次是蜗牛酶添加量,再次是超声功率,最后是超声时间间隔,即影响因素主次顺序为C>A>B>D。酵母细胞破碎最佳工艺条件为A2B3C1D2,即蜗牛酶添加量为10mg/mL、超声功率500W、超声时间8min、超声时间间隔5s。由表4可知,4个因素中只有超声时间是影响总肽酶活力的显著性因素。
2.3 酵母菌肽酶活性测定
在最佳实验组合:蜗牛酶添加量为10mg/mL、超声功率500W、超声时间8min、超声时间间隔5s的条件下,对源于贵州特色发酵豆制品的61株酵母菌进行总肽酶活力测定,结果见表5。

表5 酵母菌总肽酶活性测定结果Table 5 Total peptidase activity of 61 yeast strains originated from unique Guizhou-style fermented soybean products
从表5可以看出,高产肽酶活力的酵母菌有4株,分别是WCF-5、XWF-1、XWF-7、YZJ-4。其中,肽酶活力最高的是采集样品臭豆腐乳中分离提取出的WCF-5号酵母。
3 结 论
3.1 通过单因素试验,得到各因素对酵母菌总肽酶活力影响程度从大到小依次是超声时间>蜗牛酶添加量>超声功率>超声时间间隔;超声时间是影响总肽酶活力的显著性因素。酵母菌细胞破碎的最佳组合条件为蜗牛酶添加量10mg/mL、超声时间8min、超声功率500W、超声时间间隔5s。
3.2 筛选得到产总肽酶活力较高的酵母菌株4株,分别是WCF-5、XWF-1、XWF-7、YZJ-4。其中WCF-5号酵母所产总肽酶活力最高。
3.3 运用SPSS 11.5统计软件对贵州各地所获菌株的总肽酶活性进行差异性分析发现,来源于贞丰县的菌株总肽酶活力最高,而来源于郎岱镇的为最低。除这两地的菌株总肽酶活力存在显著差异而外,其他地方的菌株之间的差异均不明显。
3.4 酵母菌细胞总肽酶活力整体比文献报道的革兰氏阳性杆菌总肽酶活力稍低,表明在发酵过程中分解肽类的菌群主体还是革兰氏阳性杆菌,所以筛选高肽酶杆菌用于发酵对于缩短发酵后熟期也显得尤为重要。
[1] 秦礼康. 陈窖豆豉粑益酵菌风味物及黑色物质研究[D]. 无锡:江南大学, 2006.
[2] GIBBS B F, ZOUGMAN A, MASSE R, et al. Production and characterization of bioactive peptides from soy hydrolysate and soy-fermented food[J]. Food Research International, 2004, 37(2):123-131.
[3] BEAUMONT M. Flavouring composition prepared by fermentation withBacillusspp.[J]. International Journal of Food Microbiology,2002, 75(3):189-196.
[4] SOUSA M J, ARDO Y, MCSWEENEY P L H. Advances in the study of proteolysis during cheese ripening[J]. International Dairy Journal,2001, 11(6):327-345.
[5] KIRIMURA J, SHIMIZU A, KIMIZUKA A, et al. The contribution of peptides and amino acids to the taste of foodstuffs[J]. Journal of Agricultural and Food Chemistry, 1969, 17:689-695.
[6] YVON M, RIJNEN L. Cheese flavour formation by amino acid catabolism[J]. International Dairy Journal, 2001, 11(4/7):185-201.
[7] SMIT G, VERHEUL A, van KRANENBURG R, et al. Cheese flavour development by enzymatic conversions of peptides and amino acids[J].Food Research International, 2000, 33(3/4):153-160.
[8] 梁恒宇, 程建军, 马莺. 中国传统大豆发酵食品中微生物的分布[J].食品科学, 2004, 25(11):401-404.
[9] 王叔淳. 食品卫生检验技术手册[M]. 北京:化学工业出版社, 2002.
[10] GB/T 8314—2002茶游离氨基酸总量测定[S].
[11] 曹建康, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007.
[12] 赵建, 郭本恒, 陈卫, 等. 肽酶高产菌株的筛选及其生物学特性研究[J]. 乳业科学与技术, 2007, 30(2):69-72.
[13] BOUTROU R, SEPULCHRE A, GRIPON J C, et al. Simple tests for predicting the lytic behavior and proteolytic activity of lactococcal strains in cheese[J]. Dairy Sci, 1998, 81(9):2321-2328.
[14] 岳海燕, 袁其朋. 黏红酵母胞内L-苯丙氨酸解氨酶释放的研究[J]. 中国酿造, 2006(4):23-27.
[15] 邬晓勇, 何钢, 孙雁霞, 等. 蜗牛酶中纤维素酶的分级分离[J]. 安徽农业科学, 2009, 37(4):1394-1396.
Optimization of Yeast Cell Disruption and Screening of Strains with High Peptidase Activity
LI Yong-xia,ZENG Hai-ying,QIN Li-kang*
(College of Life Science, Guizhou University, Guiyang 550025, China)
TS214.2
A
1002-6630(2010)17-0302-05
2010-06-29
贵州省科学技术基金项目(黔科合J字[2007]2033号)
李永霞(1986—),女,硕士研究生,主要从事食品科学及营养与安全研究。E-mail:liyongxiaapo@sina.com
*通信作者:秦礼康(1965—),男,教授,博士,主要从事食品科学及营养与安全研究。E-mail:likangqin@126.com
