蛋白质谷氨酰胺酶对米谷蛋白功能性质的影响
2010-10-19李向红周小玲刘永乐张冬生
李向红,周小玲,刘永乐*,俞 健,张冬生
(长沙理工大学化学与生物工程学院,湖南 长沙 410114)
蛋白质谷氨酰胺酶对米谷蛋白功能性质的影响
李向红,周小玲,刘永乐*,俞 健,张冬生
(长沙理工大学化学与生物工程学院,湖南 长沙 410114)
研究蛋白质谷氨酰胺酶对米谷蛋白功能性质的影响,测定米谷蛋白及其脱酰胺样品的溶解度、乳化、起泡、黏度、持水持油力等功能性质。结果表明,谷氨酰胺酶法脱酰胺的米谷蛋白其功能性质均有提高,在中性溶液中溶解度显著增加(达到96.99%);酶解时间1~12h的范围内,改性蛋白在中性条件下的乳化性能最好,酶解时间1~5h的范围内,强酸性条件下的乳化稳定性得到显著改善,并呈现出最佳的起泡性能,而起泡稳定性和黏度则随着反应时间的增加均逐渐降低;此外,改性蛋白与未改性蛋白比较,持水性提高1.75~2.03倍,持油性提高1.58~1.94倍。
米谷蛋白;蛋白质谷氨酰胺酶;脱酰胺;功能性质
Abstract:To probe into the effect of glutaminase modification on the functional properties of rice glutelin, rice glutelin was prepared in our laboratory and enzymatically modified with glutaminase, and rice glutelin and its modification products at different treatment time points were analyzed for their solubility, emulsifying properties, foaming properties, viscosity, waterbinding capacity, oil-binding capacity and so on. The results showed that glutaminase modification could improve various functional properties of rice glutelin. After glutaminase modification, the solubility of rice glutelin was obviously increased (up to 96.99%). The modification products of rice glutelin in the hydrolysis time range of 1 to 12 h had the best emulsifying properties, and after hydrolysis for 1 to 5 h, the strong acid resistance of rice glutelin was remarkably improved and an optimal foaming capacity was observed. However, its foam stability and viscosity both gradually decreased with increasing reaction time. Furthermore, glutaminase modification resulted in a 1.75 to 2.03-fold increase in water-binding capacity and a 1.58 to 1.94-fold increase in oil-binding capacity.
Key words:rice glutelin;glutaminase;deamidation;functional property
大米中的蛋白质含量为8%~13%,其蛋白质具有无色、味道温和、必需氨基酸含量丰富、低过敏性及低胆固醇等特点[1]。但是,蛋白质中高含量的谷氨酰胺及天冬酰胺之间通过氢键等结合使蛋白质聚集沉淀,导致其溶解度较低;同时低溶解度也会影响到蛋白的其他功能性质例如起泡性、乳化性及凝胶性等,从而限制了其在食品中的应用[2]。
研究表明,酸法对大米蛋白的脱酰胺可显著改善其溶解度[3],但是高温下的酸处理过程中,蛋白质肽链的水解和其他氨基酸残基的降解是不可避免的[4];蛋白酶等也已应用于大米蛋白的脱酰胺,并有助于改善其溶解性及其他功能性质[5],但是蛋白酶可能引起肽链的水解,产生不良的风味,以及氨基酸的消旋等[6]。
近年来,发现一种新酶——蛋白质谷氨酰胺酶(glutaminase)应用于小麦蛋白及玉米醇溶蛋白的脱酰胺中可显著提高其溶解度和乳化性[7-8],蛋白质谷氨酰胺酶仅作用于蛋白质或肽的谷氨酰胺基团,而对天冬酰胺残基或游离谷氨酰胺没有影响,同时不会导致蛋白质肽链的交联和水解[7]。本研究以谷氨酰胺酶应用于大米蛋白的主要成分——米谷蛋白(占大米蛋白的80%以上)的脱酰胺改性,观察谷氨酰胺酶脱酰胺对蛋白质功能性质的影响,对进一步提高大米蛋白产品质量,开发性能更优良、应用范围更广的新型食品有着重要意义。
1 材料与方法
1.1 材料与试剂
籼米碎米 由湖南省霞凝粮库提供。
谷氨酰胺酶 美国Sigma公司;所有其他化学试剂均为分析纯。
1.2 仪器与设备
UV2600紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;DS-1高速组织捣碎机 上海标本模型厂;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;DELTA 320pH计 梅特勒-托利多仪器(上海)有限公司;SK-1型快速混匀器 金坛市医疗仪器厂;乌氏黏度计 中国医药集团上海化学试剂公司。
1.3 方法
1.3.1 米谷蛋白的提取
米谷蛋白提取工艺如下,实验中提取温度为室温,提取2h,3000r/min离心15min。
大米粉→正己烷脱脂→室温下自然干燥24h→ 蒸馏水提取清蛋白(料液比1:10(m/V))→离心→质量浓度5g/100mL的氯化钠溶液提取球蛋白(料液比1:10)→离心→ 70%的乙醇溶液提取醇溶蛋白(料液比1:5)→离心→沉淀水洗→0.05mol/L氢氧化钠溶液(料液比1:10)→离心→上清液用质量浓度12g/100mL的三氯乙酸溶液调节pH值至等电点4.8→离心→透析→冷冻干燥→产品
1.3.2 改性米谷蛋白的制备
称取1g米谷蛋白,边搅拌边加入盛有磷酸盐缓冲溶液(200mmol/L,pH7.0)的恒温酶反应器内,形成底物质量浓度(1±0.002)g/100mL的分散悬浮液,搅拌30min后加入一定量的谷氨酰胺酶(酶与底物比为1:5)进行酶解反应,酶解反应温度37℃,反应时间0~48h。反应结束后用0.1mol/L的醋酸溶液透析,然后样品冻干备用。
1.3.3 溶解度测定
采用福林-酚法测定不同pH值条件下米谷蛋白及其脱酰胺样品的溶解度。准确称取冻干样品(10mg)分散于10mL不同pH值的缓冲溶液(pH3、10mmol/L的醋酸缓冲溶液;pH5、10mmol/L的醋酸-醋酸钠缓冲溶液;pH7、10mmol/L的磷酸盐缓冲溶液)中,20℃搅拌过夜,3000r/min离心30min收集可溶性组分,取1mL溶液用福林-酚法测定蛋白质含量,用牛血清白蛋白做标准曲线。
1.3.4 乳化性及乳化稳定性测定
采用浊度法测定。取质量浓度为(0.1±0.0005)g/100mL的蛋白溶液75mL,调pH值至所需值(pH3、pH5、pH7)后转入高速组织捣碎机,再加入25mL茶籽油,20000r/min均质2min,记录油层体积V0。用微量注射器从乳液底部取100μL乳液迅速与10mL质量浓度0.1g/100mL的SDS溶液混合,在500nm波长处比色,记录吸光度(A0),30min后同样稀释比色,记录吸光度(At)。大米蛋白的乳化能力用乳化性和乳化稳定性表示。

1.3.5 起泡性及起泡稳定性测定
取质量浓度为(0.1±0.0005)g/100mL的蛋白溶液100mL,用0.05mol/L的氢氧化钠溶液或盐酸调pH值至所需值(pH3、pH 5、pH7)后转入高速组织捣碎机,20000r/min搅拌2min,迅速转入250mL的量筒中,尽快记录泡沫的体积(V0),静置30min后测量下层析出溶液的体积(Vt)。分别按式(3)、(4)计算大米蛋白的起泡性及起泡稳定性。
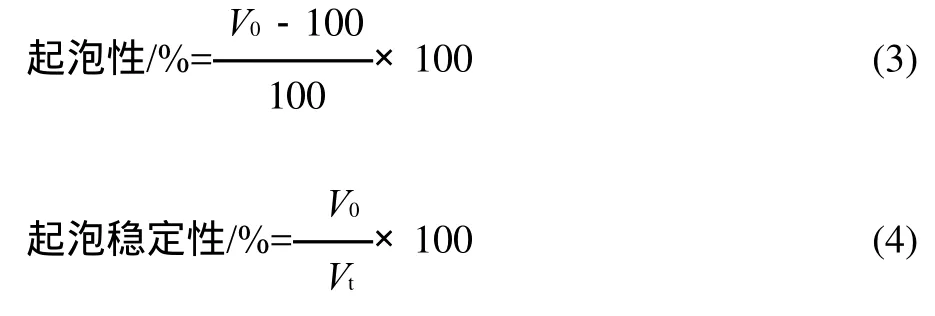
1.3.6 特性黏度测定
采用乌氏黏度计法,按式(5)计算特性黏度。

式中:t为蛋白溶液流出时间;t0为纯溶剂流出时间;C为蛋白溶液质量浓度/(g/mL)。
1.3.7 持水持油能力测定
持水能力测定:准确称取100mg蛋白质样品置于50mL质量为m1的离心管中,加蒸馏水5mL,用磁力搅拌器使蛋白质溶液分散均匀。测量样液的pH值,并调至pH7.0,在40℃恒温水浴中保温30min,9000r/min离心10min倾去上清液,称取离心管的质量记为m2,计算每克蛋白质样品的持水能力。
持油能力测定:准确称取100mg蛋白质样品置于50mL质量为m1的离心管中,加茶籽油5mL,用磁力搅拌器使蛋白质溶液分散均匀。在40℃恒温水浴中保温30min后,9000r/min离心10min倾去上清液,称取离心管的质量记为m2,计算每克蛋白质样品的持油能力。
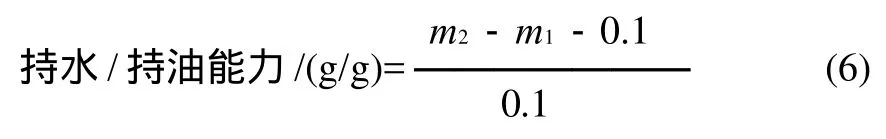
2 结果与分析
2.1 米谷蛋白的改性

图1 不同酶处理时间下米谷蛋白溶液样品Fig.1 Appearance of rice glutelin dispersions at different hydrolysis time points
从图1可以看出,当酶处理时间低于3h时,只有少量蛋白质在溶液中分散,大部分沉淀于试管底部;酶处理时间在5~20h之间,溶液呈浑浊状,有少量沉淀沉于试管底部;酶解20h以上时,蛋白质基本分散于溶液中,得到比较均匀的溶液,由此可知随着酶处理时间的延长,米谷蛋白由于脱酰胺逐渐分散于中性水溶液中。
2.2 溶解度的变化
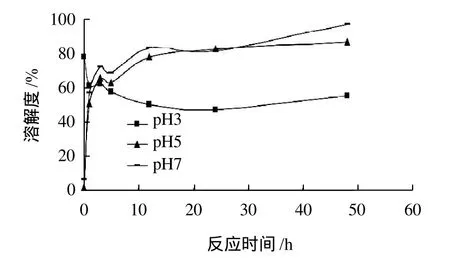
图2 不同pH值下脱酰胺米谷蛋白的溶解度Fig.2 Time-dependent solubility change of rice glutelin induced by glutaminase reaction at different pH values
研究米谷蛋白及其脱酰胺样品在酸性pH值(pH3和pH5)以及中性pH值(pH7)条件下溶解度的变化情况(图2)。未经酶修饰的米谷蛋白在强酸性溶液中(pH3.0)溶解性良好,达到78.15%,在等电点pI4.8左右(pH5)的溶液及中性溶液(pH7)中的溶解度相当低,仅1.71%和6.18%。经谷氨酰胺酶脱酰胺作用的米谷蛋白在pH5和中性条件下的溶解度显著上升,酶解48h时溶解度分别达到86.88%和96.99%,而在强酸性溶液中的溶解度有所降低。从图2还可以看出,即使谷氨酰胺酶脱酰胺反应的时间非常短(1h),pH7时其溶解度也达到了56.83%,结果表明,谷氨酰胺酶导致的米谷蛋白的脱酰胺使得蛋白质聚合体解聚以及蛋白质粒子间的静电排斥作用增强,显著增加了其在中性条件下的溶解度。弱酸性(pH5)条件下溶解度的增加是由于脱酰胺导致的羧化作用使得蛋白质等电点降低[9],强酸性条件下(pH3)溶解度的降低有可能是由于修饰后蛋白质表面带负电荷,在强酸溶液中正负电荷抵消,脱酰胺后的蛋白质分子打开,暴露出更多的疏水基团,疏水相互作用大于静电排斥作用,导致溶解度降低。
2.3 乳化性及乳化稳定性
乳化体系在热力学上为不稳定的分散体系[10],蛋白质是两性高聚物,具有亲水、亲油的基团和区域,可以起到稳定乳化体系的作用[11]。图3为米谷蛋白及其脱酰胺样品分别在pH3、pH5及pH7时的乳化性及乳化稳定性。

图3 不同pH值条件下脱酰胺米谷蛋白的乳化性(A)及(B)乳化稳定性Fig.3 Emulsifying capacity and emulsifying stability index of rice glutelin and its modification products at different pH values
由图3可知,酶处理后的米谷蛋白在强酸性溶液中的乳化性略有改善,但在弱酸性溶液(pH5)中则大大降低,中性溶液中呈现先上升后下降的趋势。米谷蛋白在酸性条件下乳化稳定性较好,改性后在强酸性及中性溶液中反应时间小于5h时稳定性较好,随着反应时间的延长稳定性变差,而在弱酸性溶液中稳定性最不理想。
改性后米谷蛋白在中性溶液中乳化性及稳定性较好是因为乳状液液珠表面带负电,液滴相互接近时产生排斥力[12],防止液滴聚结,同时吸附带相反电荷的离子,形成类似于Stern层[13]的混合层,使溶液中的离子分布发生重排,使水与油相的电位差增大,足以使乳状液稳定。在强酸性溶液中乳化性提高幅度不大的原因可能是乳状液液滴表面的部分电荷被中合,导致两相界面电位差减小,但稳定性比较好可能是蛋白质在强酸性溶液中的界面膜强度大,有利于乳状液的稳定;酶解5h后的米谷蛋白乳化稳定性下降,可能是蛋白结构进一步展开,更多的疏水基团暴露,导致亲水性变差,从而影响乳化性及其稳定性。在弱酸性条件下,酶处理样品的溶解度有所增加,而乳化性及其稳定性却较差,Hamada[4]认为溶解度不是关联乳化性和乳化稳定性的唯一因素,还有更多的关键因素会影响到油相表面的蛋白质吸附层,从而影响到乳状液滴的静电排斥和立体位阻。
2.4 起泡性及起泡稳定性

图4 不同pH值条件下脱酰胺米谷蛋白的起泡性(A)及(B)起泡稳定性Fig.4 Foaming capacity and foam stability of rice glutelin and its modification products at different pH values
谷蛋白有较好的发泡性质,可以形成具有一定机械强度的薄膜,但泡沫易受溶液pH值的影响,并有老化现象[14]。图4为米谷蛋白在pH3、pH5及pH7时的起泡性及起泡稳定性。从图4A可知,原蛋白的起泡性在强酸性pH值下最好,改性后随着酶解时间的增加起泡性变得更好。在弱酸性及中性pH值下原蛋白的起泡性很低,改性后得到改善。由于pH3时原始米谷蛋白溶解度高,有利于界面上的蛋白质相互作用形成黏稠的膜,同时吸附在界面的蛋白质数量增多,有利于形成刚性膜,故此时的起泡性较好[15],改性后3种条件下蛋白质三、四级结构展开,暴露出更多的疏水基团[16],结构变得疏松,提高了湿润性,有利于蛋白质快速地分散至气-水界面,降低界面张力,从而使起泡性随着酶解时间的增加而增强。
从图4B可知,在弱酸条件下起泡稳定性最好,原蛋白起泡稳定性优于改性后的蛋白质,且改性后随着酶解时间的增加稳定性呈下降趋势。原因是在弱酸性条件下,虽然起泡力不佳,但不溶解部分的蛋白质有利于增加膜的黏合力,从而稳定泡沫[17];原蛋白的起泡稳定性好主要源于它的相对分子质量较大,能在气泡周围形成具有一定刚性和厚度的蛋白膜[18];改性后起泡稳定性呈下降趋势的原因是酶处理使蛋白质分子内的氢键打开,静电排斥作用增强,部分肽链打开,相对分子质量减小,不利于分子间相互结合形成具有黏弹性的蛋白膜。
2.5 特性黏度
溶液的黏度与高聚物的分子质量、分子结构形态和在溶剂中的扩张程度有关,流体在流动时,由于分子间的相互作用,产生了阻碍运动的内摩擦力,黏度就是这种摩擦力的表现[19]。图5为大米蛋白的黏度随酶解时间的变化图。
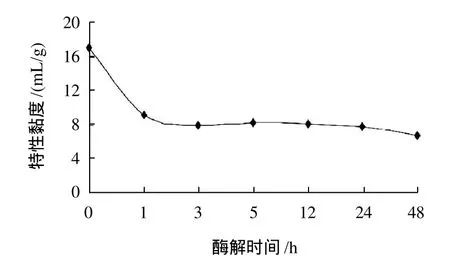
图5 不同酶解时间下米谷蛋白的特性黏度Fig.5 Time-dependent viscosity change of rice glutelin induced by glutaminase reaction
由图5可知,米谷蛋白的特性黏度较高,改性后蛋白质的特性黏度明显降低。原因是米谷蛋白的分子链长且有柔顺性,在溶液中成无规线团流动,分子链内与分子链间都不同程度地相互缠结和内摩擦[20],同时分子链中包含一定量的溶剂分子,使体系浓度相对增大,从而特性黏度较大。改性后米谷蛋白聚合体缓慢解离,蛋白质相对分子质量减小,分子链间的缠结与内摩擦力减弱,从而导致蛋白质溶液的特性黏度降低。
2.6 持水持油能力
蛋白质的持水能力(water binding capacity,WBC)是指蛋白质将水截留或保留在其组织中的能力。对于食品体系,一种蛋白质制剂的持水能力与其结合水能力有关,可影响食品的嫩度、多汁性、柔软性、所以持水力对食品品质具有重要的实际意义[2]。同时蛋白质的持油性能在肉制品、奶制品以及饼干夹心等食品配方及加工中起着非常重要的作用,对于扩大改性大米蛋白的应用范围,其持水和持油性也是非常重要的指标。

图6 不同酶解时间下米谷蛋白的持水、持油能力Fig.6 Time-dependent water-binding capacity and oil-binding capacity changes of rice glutelin induced by glutaminase reaction
从图6可知,随着酶解时间的增加,蛋白质持水力增加,当酶解12h时持水力开始下降。原因是谷氨酰胺酶使蛋白质分子结构展开,形成松散的三维网状结构而截留更多的水分子,持水性提高1.75~2.03倍,但随着酶解时间的增加,蛋白质分子进一步展开,暴露出更多的疏水区域,导致亲和水的能力减弱。对不同酶解时间的大米蛋白持油性分析结果表明,脱酰胺处理后的蛋白样品持油性提高1.58~1.94倍,而酶解时间的长短对持油性并无显著影响。
3 结 论
随着谷氨酰胺酶作用于米谷蛋白的时间延长,蛋白在中性溶液中溶解度显著增加(达到96.99%);酶解时间1~12h的范围内,改性蛋白在中性条件下的乳化性能最好,而在酶解时间1~5h的范围内,强酸性条件的乳化稳定性得到显著改善;起泡性随着酶解时间的增加而提高;脱酰胺后米谷蛋白的黏度降低,改性蛋白与未改性蛋白比较,持水性提高1.75~2.03倍,持油性提高1.58~1.94倍。说明酶法脱酰胺使蛋白质-蛋白质间作用力减弱,分子间静电排斥作用增加,蛋白质聚合体解聚,溶解度上升,功能性质提高,谷氨酰胺酶适合于米谷蛋白的改性。
[1] CHRASTIL J. Correlations between the physicochemical and functional properties of rice[J]. Journal of Agricultural and Food Chemistry, 1992,40(9):1683-1686.
[2] FENNEMA O R. 食品化学[M]. 王璋, 译. 北京:中国轻工业出版社,2003:316-317.
[3] 易翠平. 大米高纯度蛋白和淀粉联产工艺与蛋白改性研究[D]. 无锡:江南大学, 2005.
[4] HAMADA J S. Modification of food proteins by enzymatic methods[M]//HUDSON B J F. Biochemistry of food proteins. London, U K:Elsevier Applied Science, 1992:249-270.
[5] 蒋甜燕, 王立, 易翠平, 等. 大米蛋白改性及对功能性质的影响[J].粮食与饲料工业, 2007(1):3-5.
[6] TOMOTAKE H, SHIMAOKA I, KAYASHITA J, et al. Physicochemical and functional properties of buckwheat protein product[J]. Journal of Agricultural and Food Chemistry, 2002, 50(7):2125-2129.
[7] MARCO C, ROSELL C M. Effect of different protein isolates and transglutaminase on rice flour properties[J]. Journal of Food Engineering,2008, 84(1):132-139.
[8] MOORE M M, SCHOBBER T J, DOCKERY P, et al. Textural comparisons of gluten-free and wheat-based doughs, batters and breads[J].Cereal Chemistry, 2004, 81(5):567- 575.
[9] WU C H, NAKAI S, POWRIE W D. Preparation and properties of acidsolubilized gluten[J]. Journal of Agricultural and Food Chemistry, 1976,24(3):504-510.
[10] 陈宗淇, 王光信, 徐桂英. 胶体与界面化学[M]. 北京:高等教育出版社, 2001:279-304.
[11] 赵新淮, 徐红华, 姜毓君. 食品蛋白质:结构性质与功能[M]. 北京:科学出版社, 2009:325-327.
[12] MAKRI E A, DOXASTAKIS G I. Emulsifying and foaming properties ofPhaseolus vulgarisandcoccineusproteins[J]. Food Chemistry, 2006,98(3):558-568.
[13] MATSUDOMI N, KATO A, KOBAYASHI K. Conformation and surface properties of deamidated gluten[J]. Agric Biol Chem, 1982, 46(6):1583-1586.
[14] THAKUR R K, VIAL C, DJELVEH G. Effect of pH of food emulsions on their continuous foaming using a mechanically agitated column[J]. Innovative Food Science and Emerging Technologies , 2006, 7(3):203-210.
[15] 阚建全. 食品化学[M]. 北京:中国农业大学出版社, 2002:180-181.
[16] BELITZ H D, GROSCH W, SCHIEBERLE P. Food chemitry[M]. 3rd ed. New York:Springer, Verlag, Berlin Heidlberg, 1999.
[17] CHAN W M, MA C Y. Acid modification of proteins from soymilk residue[J]. Food Research International, 1999, 32(2):119-127.
[18] MIRMOGHTADAIE L, KADIVAR M, SHAHEDI M. Effects of succinylation and deamidation on functional properties of oat protein isolate[J]. Food Chemistry, 2009, 114(1):127-131.
[19] 符若文, 李谷, 冯开才. 高分子物理[M]. 北京:化学工业出版社, 2005:102-103.
[20] 张雪梅, 蒋雨. 食品中蛋白质的功能(二)蛋白质结构与食品功能性质的关系研究[J]. 肉类研究, 2009(5):71-75.
Effects of Glutaminase on the Functional Properties of Rice Glutelin
LI Xiang-hong,ZHOU Xiao-ling,LIU Yong-le*,YU Jian,ZHANG Dong-sheng
(School of Chemistry and Biology Engineering, Changsha University of Science and Technology, Changsha 410114, China)
TS213.3
A
1002-6630(2010)17-0192-05
2010-07-07
国家“863”计划重点项目(2008AA100801)
李向红(1979—),女,讲师,博士,研究方向为植物蛋白工程。E-mail:xianghongli@hotmail.com
*通信作者:刘永乐(1962—),男,教授,博士,研究方向为食品生物技术与农产品深加工。E-mail:lyle19@163.com
