近临界水中杂多酸锌盐催化氧化降解4,4′-二溴联苯
2010-10-16陈晋阳阮如意刘桂洋
陈晋阳, 李 志, 阮如意, 刘桂洋
(上海大学环境与化学工程学院,上海 200444)
近临界水中杂多酸锌盐催化氧化降解4,4′-二溴联苯
陈晋阳, 李 志, 阮如意, 刘桂洋
(上海大学环境与化学工程学院,上海 200444)
使用模板浸渍法制备两种杂多酸锌盐 Zn1.2H1.8PW12O40和 Zn1.1H1.9PMo12O40.利用它们作为催化剂,进行了近临界水中 4,4′-二溴联苯 (4,4′-DBB)氧化降解的实验研究,其中 Zn1.2H1.8PW12O40具有很好的氧化降解效果,并且稳定性很好.因此,采用 Zn1.2H1.8PW12O40为催化剂,研究了近临界水中 4,4′-DBB氧化降解的工艺条件与动力学.优化工艺条件为物料质量比 m(H2O2)∶m(4,4′-DBB)=200∶1,反应温度 320℃,反应压力 11.9 MPa,反应时间 15 min,在此工艺条件下反应后水样的化学需氧量 (chemical oxygen demand,COD)为 55.9 mg/L,达到了 GB 8978—1996的排放要求.反应动力学的研究结果显示,4,4′-DBB在近临界水中催化氧化降解的反应级数为 1.70,表观活化能为 44.04 kJ/mol.
杂多酸锌盐;4,4′-二溴联苯;近临界水氧化;催化;化学需氧量
Abstract:Two heteropoly zinc saltsof Zn1.2H1.8PW12O40and Zn1.1H1.9PMo12O40areprepared by template impregnation.They are used ascatalyst to oxidative degradation of 4,4′-dibromobiphenyl(4,4′-DBB)in subcritical water.Zn1.2H1.8PW12O40pays better role on accelerating degradation rate and shows enough stability.Thus oxidative degradation and the kinetics of 4,4′-DBB in subcritical water are investigated using Zn1.2H1.8PW12O40as catalyst.The op timal experiment conditions are obtained as follow s:m(H2O2)∶m(4,4′-DBB)=200∶1,temperature of 320 ℃,pressure of 11.9 MPa,and reaction time of 15 min.Under the op timal condition,chemical oxygen demand(COD)of water samp le after reaction can be down to 55.9 mg/L,which meets the Chinese National Standard GB 8978—1996.The order of catalytic oxidation degradation kinetic of 4,4′-DBB in subcriticalwater is1.70,and the apparent activation energy is44.04 kJ/mol.
Key words:heteropoly zinc salt;4,4′-dibromobiphenyl;subcriticalwater oxidation;catalysis;chemical oxygen demand(COD)
多溴联苯是一系列含溴原子的芳香族化合物,具有化学性质稳定、沸点高、毒性强等特点[1],其作为阻燃剂被大量用于电子电器设备中.研究表明,多溴联苯具有类似的神经毒性,可能致癌并引起免疫系统异常,其中的六溴联苯已被列入持久性有机污染物 (persistent organic pollutants,POPs)行列,因此,多溴联苯的处理方法受到了广泛的关注[2-3].
传统的多溴联苯处理方法 (如高温热解或焚烧等)均存在不同程度的二次污染.近年来,由于催化超临界水氧化具有反应速率快、无二次污染等优点,在降解有机污染物和固体废弃物等方面得到了广泛的应用,例如丙烯腈废水[4]、二乙烯苯树脂颗粒[5]、含油污泥[6]、制浆黑液[7]的无害化处理.但是,在超临界水氧化过程中,由于水到超临界的极端条件时氢键大大减弱且几乎变成非极性溶剂,从而使得盐类在其中不溶解,而水中微量的成盐元素就能导致大多数材料的强烈腐蚀.除了反应器腐蚀和盐析导致的技术问题外,水的临界温度和压力都较高,这些不利因素阻碍了超临界水的实际应用.相对于超临界水来说,近临界水既具有超临界水的某些特点,又有自身的优势:①作为溶剂,近临界水介电常数介于常态水和超临界水之间,对非极性的有机物 (如芳香化合物)也具有较好的溶解性[8],并且近临界水对无机盐仍然具有较大的溶解度[9-10],从而可避免超临界水氧化 (super critical water oxidation,SCWO)微量成盐元素造成的强腐蚀和盐析问题;②近临界水本身对材料的腐蚀性比超临界水要小得多[11-12],而且近临界水条件相对温和,可有效地缓解超临界水的安全隐患.因此,近临界水氧化降解将是一种真正可实现工业化应用的方法.
由于多溴联苯化学性质非常稳定,难以降解,因此,近临界水氧化存在的主要问题无疑将是反应速率慢、时间长和氧化不彻底,对此可加入催化剂来改善[13-16].杂多酸或盐作为催化剂在有机污染物氧化降解中已表现出了较好的催化效果[17-19],因此,本研究选取 4,4′-二溴联苯 (4,4′-DBB)作为多溴联苯的代表,制备了杂多酸锌盐,以此为催化剂进行 4,4′-DBB的近临界水氧化降解实验研究.
1 实验部分
1.1 实验仪器与材料
反应釜 (80 mL,不锈钢),海安华达石油仪器有限公司;盐浴炉 (10 kW),开封市泰达电炉科技有限公司;全谱直读等离子体发射光谱仪 (6300型),美国 THEROM公司;傅里叶红外光谱仪 (AVATAR 370型),美国尼高力仪器公司;X射线衍射仪 (Dmax-2200型),日本理学公司.
4,4′-DBB样品,上海邦成化工有限公司;磷钨酸 (分析纯)、磷钼酸 (分析纯)、双氧水 (质量分数为30%),上海国药集团化学试剂有限公司.
1.2 杂多酸锌盐催化剂的制备
本研究以杂多酸为前驱体,将天然纤维素作为模板,采用浸渍法,制得了 Zn1.2H1.8PW12O40和 Zn1.1H1.9PMo12O40两种催化剂.具体方法如下:将一定量的 Zn(AC)2的乙醇溶液与一定浓度的 H3PW12O40(HPW)或 H3PMo12O40(HPMo)水溶液搅拌混合,之后将一些滤纸片在该混合溶液中浸渍一段时间,取出滤纸片,烘干后在 380℃焙烧 5 h,得到 Zn1.2H1.8PW12O40(Zn1.2PW)或Zn1.1H1.9PMo12O40(Zn1.1PMo)固体粉末.
1.3 催化剂的表征
催化剂的元素组成通过电感耦合等离子体(ICP)测定,并使用傅里叶红外光谱仪与 X射线衍射仪对其进行表征.
X射线衍射 (X-ray diffraction,XRD)测试条件如下:金属靶为 Cu靶 Ni滤网,管电压为 40 kV,管电流为 40 mA,扫描范围为 2θ=10°~80°.
1.4 降解实验
降解实验是在80 mL间歇式无搅拌高压不锈钢反应釜内进行.首先,将 4,4′-DBB样品和双氧水以一定比例加入到高压釜中,再向釜中加入 0.1 g催化剂.密闭后放置于盐浴炉中加热,升温至所需反应温度,恒温一定时间后,取出反应釜急冷至室温.之后,过滤分离出固体催化剂.液相产物按 GB 11914—89重铬酸钾法进行化学需氧量 (chemical oxygen demand,COD)的测定.固体催化剂利用 XRD表征.
2 结果与讨论
2.1 催化剂的表征
2.1.1 元素分析
利用电感耦合等离子体发射光谱仪 (ICP-AES)对两种催化剂进行元素分析,磷钨酸锌中 Zn,W,P质量分数为 2.55%,75.59%,1.07%,磷钼酸锌中Zn,Mo,P质量分数为 4.13%,60.90%,1.71%.转化为摩尔比后,可以确定磷钨酸锌和磷钼酸锌的分子式分别为 Zn1.2H1.8PW12O40和 Zn1.1H1.9PMo12O40.
2.1.2 红外光谱 (FT-IR)
HPW和 Zn1.2PW的红外光谱图如图1所示.由图可见,Zn1.2PW的特征峰与 HPW相一致,表明Zn1.1PW依然保持 Keggin结构.Zn1.1PMo表现出与此类似的结果.
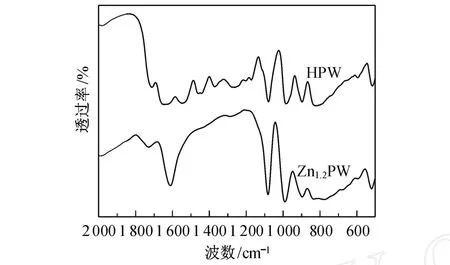
图1 磷钨酸(锌)试样的红外光谱Fig.1 Infrared spectras of HPW and Zn1.2PW
2.1.3 XRD
磷钨酸 (锌)与磷钼酸 (锌)的 XRD测试结果如图2所示.
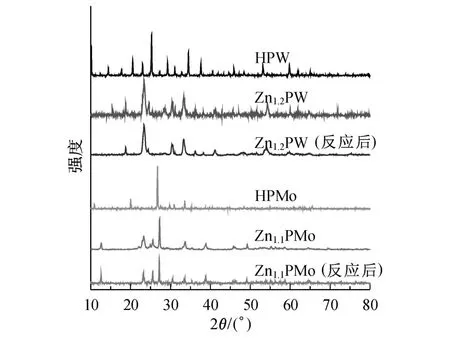
图2 杂多酸(锌)各试样的 XRD图谱Fig.2 XRD patterns of the HPW,Zn1.2PW,HPM o and Zn1.2PM o
从图2中可以看出,Zn1.2PW和 Zn1.1PMo的衍射峰位置与各自母体酸的衍射峰位置基本一致,说明 Zn1.2PW和 Zn1.1PMo依然保持 Keggin结构.
2.2 催化剂的活性与稳定性
为了考察杂多酸 (盐)的催化活性,本实验在物料质量比为 m(H2O2)∶m(4,4′-DBB)=200∶1时 ,于不同的温度 (320,340,360℃)和压力 (11.9,15.1,20.3 MPa)下反应 15 min,对比不加催化剂和分别加入磷钨 (钼)酸锌催化剂三种不同条件下 4,4′-DBB氧化降解的效果,结果如图3所示.
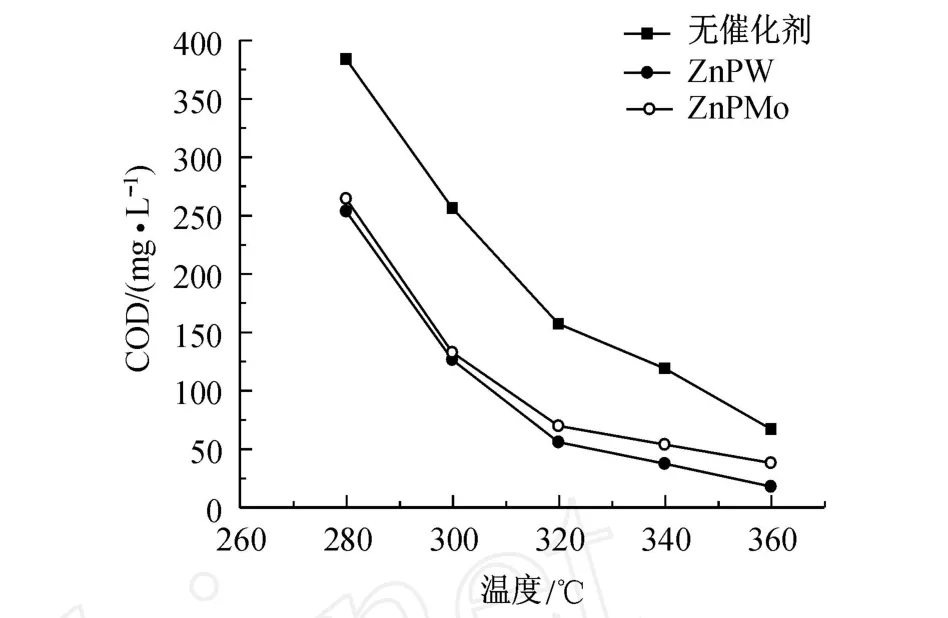
图3 不同催化剂对反应后水样 COD的影响及与空白实验的对比Fig.3 Effects of d ifferen t catalysts on COD of water sam p le after reaction
由图3可以看出,采用催化剂可明显降低反应后水样的 COD.不加催化剂情况下,即使在 360℃时,反应后水样的 COD依然很高.而加入磷钨 (钼)酸锌后,在 340℃的条件下,反应后水样的 COD已经小于60 mg/L,达到了国家一级排放标准.
为了确定催化剂的稳定性,本研究对于反应完成后过滤所得催化剂又进行了 XRD表征,结果列于图2.将两种催化剂在反应前后的 XRD峰进行比较可见,它们的主要衍射峰位置基本一致,表明反应后二者均保持稳定结构.
在两种催化剂中,由于 Zn1.2PW表现出更好的催化效果,故以下工艺条件与动力学的研究都是以此为催化剂.
2.3 降解因素分析
2.3.1 物料比的影响
在一定温度 (320,340,360℃)和压力 (11.9,15.1,20.3 MPa)条件下,以 Zn1.2PW为催化剂,考察物料质量比 (m(H2O2)∶m(4,4′-DBB))的变化对反应后水样 COD的影响,结果如图4所示.
由图4可知 ,当 m(H2O2)∶m(4,4′-DBB)<200∶1时,随着物料比的增大,反应后水样 COD呈现出较为明显的递减趋势;当 m(H2O2)∶m(4,4′-DBB)>200∶1时,反应后水样的 COD则不再随物料比增大而增大.由此可以选择 m(H2O2)∶m(4,4′-DBB)=200∶1,即 (2 g H2O2/0.01 g 4,4′-DBB)作为较佳物料比,以下的研究都是在此物料比的条件下进行.
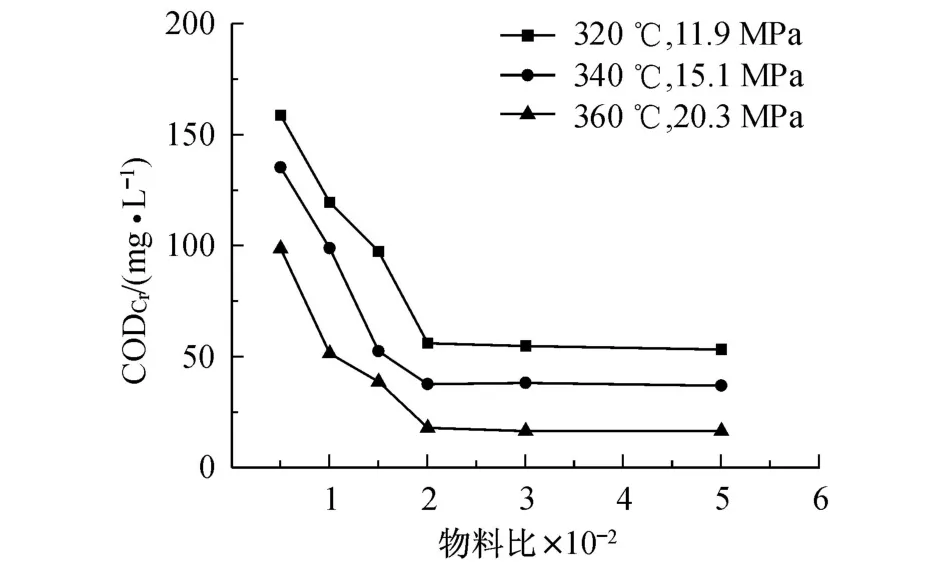
图4 物料比对反应后水样 COD的影响Fig.4 Effects of mass ratio on COD of water sam p le after reaction
2.3.2 反应温度的影响
以 Zn1.2PW为催化剂,在停留时间为 5,15以及30 min的条件下,反应温度对反应后水样 COD的影响如图5所示.
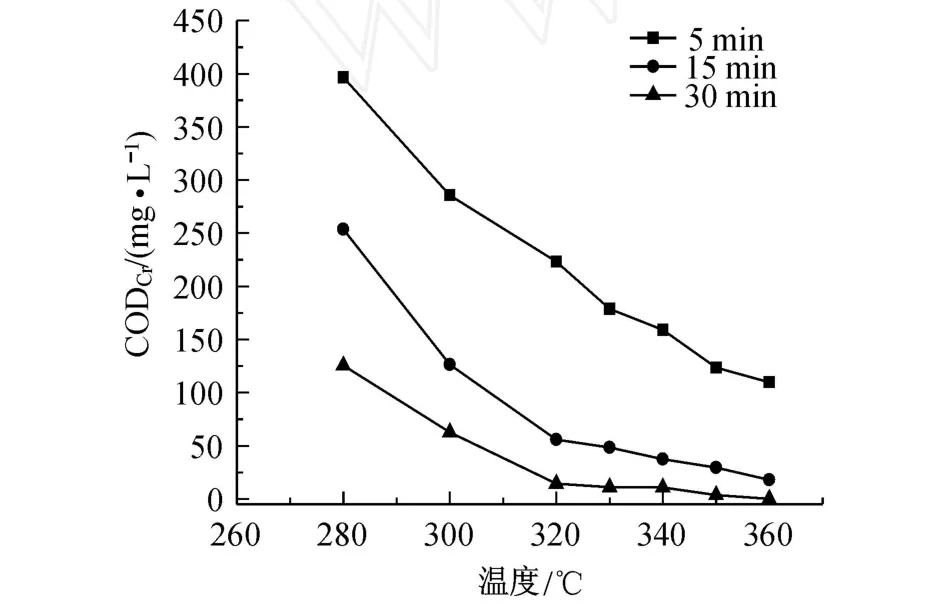
图5 反应温度对反应后水样 COD的影响Fig.5 Effects of tem perature on COD of water sam p le after reaction
由图5可知,在 280~360℃的范围内,随着温度的升高,反应后水样的 COD逐渐下降.这主要是由于随着温度的升高,反应速率常数增大,使得 4,4′-DBB的降解速率加快,从而使反应后水样的 COD逐渐下降.在停留时间为 15 min,反应温度为 320℃的条件下,COD已经小于 60 mg/L.
2.3.3 反应时间的影响
以 Zn1.2PW为催化剂,反应后水样 COD随反应时间的变化如图6所示.由图6可知,随着反应时间的增加,反应后水样的 COD呈现出下降的趋势.当反应时间小于 15 min时,下降幅度比较明显;当反应时间大于 15 min时,由于 COD已经接近于零,从而使得下降曲线趋于平缓;当反应时间为 15 min,反应温度为 320℃时,反应后水样的 COD小于 60 mg/L.

图6 反应时间对反应后水样 COD的影响Fig.6 Effects of reaction time on COD of water sample after reaction
2.4 降解反应动力学
由于催化近临界水氧化有机污染物的反应非常复杂,中间产物很多,采用基元反应模型困难较大,因此,本研究采用幂指数方程法建立催化近临界水氧化降解宏观动力学方程.幂指数宏观动力学方程式中不涉及中间产物,只与反应温度和各反应物浓度有关.在近临界水催化氧化反应中,COD值的大小代表着水中有机物浓度的高低,因此,可用反应后COD的变化描述反应的进程,即可用 COD代替宏观动力学方程中的有机污染物浓度,从而得到如下的动力学表达式:
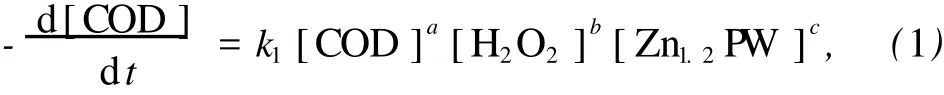
式中,a,b,c分别表示 COD,H2O2,Zn1.2PW的反应级数.
由于近临界水氧化反应中氧化剂 (H2O2)是过量的,所以可以认为反应过程中氧化剂浓度[H2O2]为常数.同时每次加入 Zn1.2PW的质量相同,[Zn1.2PW]为常数,所以 [H2O2]b和 [Zn1.2PW]c可以并入到 k1中,则式 (1)转化为
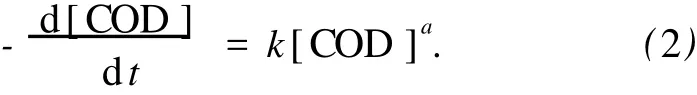
经测定初始化学需氧量[COD]0=3 628 mg/L,则应用初始条件:当 t=0时,[COD]0=3 628 mg/L,并且当 a≠1时,对式 (2)积分可得
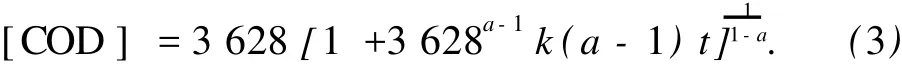
用图6的实验数据对式 (3)进行回归分析,可以得到 a=1.70,并求得不同温度下反应速率常数k,结果如表 1所示.

表 1 温度与反应速率常数 k的关系Table 1 Relationship between temperature and k
根据 Arrhenius关系式

取对数得

式中,A为指前因子,Ea为反应活化能.以 ln k与-T-1×103作图,结果如图7所示.依据该直线的斜率,获得反应的活化能 Ea为 44.04 kJ/mol.
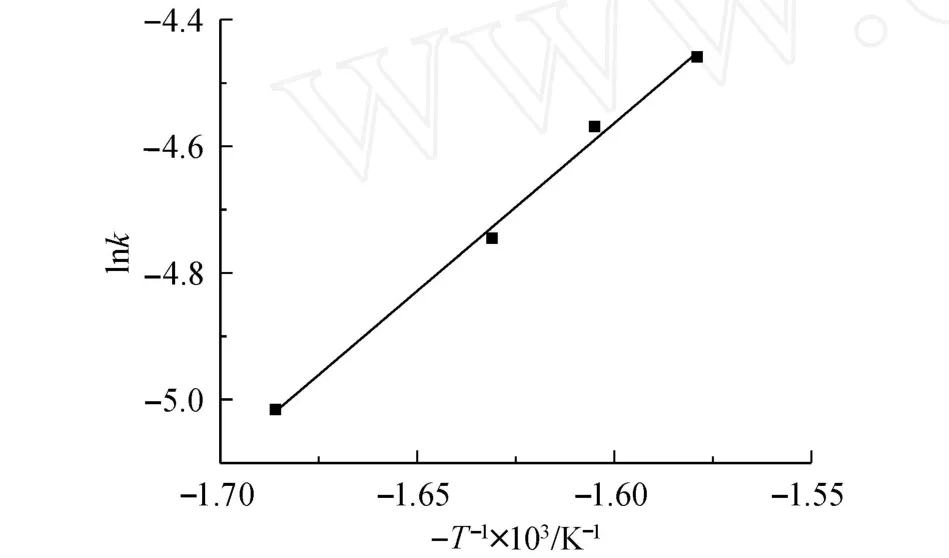
图7 ln k与 -T-1×103的关系Fig.7 Relationsh ip between ln k and-T-1×103
3 结 论
本工作在温度为 280~360℃,压力为 6.9~20.3MPa,反应时间为 5~30 min条件下,以杂多锌盐为催化剂、双氧水为氧源,研究了近临界水催化氧化 4,4′-DBB的反应,得到如下结论.
(1)通过模板浸渍法,成功制备了在近临界水中氧化降解 4,4′-DBB具有较好催化活性和稳定性的磷钨 (钼)酸锌催化剂.
(2)以 Zn1.2PW12O40为催化剂,获得了 4,4′-DBB在近临界水催化氧化降解的优化反应条件如下:投料质量比 m(H2O2)∶m(4,4′-DBB)=200∶1,反应温度为 320℃,反应压力为 11.9 MPa,反应时间为 15 min.在以上条件下反应后水样的 COD为55.9 mg/L,达到了国家一级排放标准.
(3)在实验温压范围内,近临界水中 Zn1.2PW12O40催化氧化 4,4′-DBB的反应级数为 1.70,表观活化能为 44.04 kJ/mol.
[1] KIM D,CHEN J R,YEN T F.Mechanism and kinetics of reductive dehalogenation of PBB (polybrominated biphenyl)in the sonolytic and ketyl radical system[J].Journal of Hazardous Materials,2009,163(1):231-238.
[2] 王磊 ,陈锦烽 ,吕效平 ,等.O3/H2O2处理水中 4,4′-二溴联苯及其动力学研究[J].环境科学,2007,28(9):1998-2003.
[3] 季彩宏 ,张萍 ,韩萍芳 ,等.TiO2膜光催化降解 4,4′-二溴联苯的研究[J].环境工程学报,2009,3(1):72-76.
[4] SHIN Y H,LEE H S,LEE Y H,et al.Synergetic effect of copper-p lating wastewater as a catalyst for the destruction of acrylonitrile wastewater in supercritical water oxidation[J].Journal of Hazardous Materials,2009,167:824-829.
[5] KODA S,YONEMURA H,MAEDA K,et al.Kinetic aspects of SCWO progress of solid organic substances[J].Chemical Engineering Science,2007,62:5070-5073.
[6] CUIB,CUIF,JING G,et al.Oxidation of oily sludge in supercritical water[J].Journal of HazardousMaterials,2009,165:511-517.
[7] 李瑞虎,史诺,乔丽洁.超临界水氧化法处理制浆黑液[J].环境工程,2009,27(5):41-43.
[8] CHEN J,ZHANG H,ZHENG H,et al. In situ visualization of transformation of organic matter in water at high pressuresand temperatures[J].JAnalytical and App lied Pyrolysis,2006,76:260-264.
[9] LEUSBROCK I,METZ S J,REXW INKEL G,et al.Quantitative approaches for the description of solubilities of inorganic compounds in near-critical and supercritical water[J].The Journal of Supercritical Fluids,2008,47(2):117-127.
[10] MATSUMOTO Y,HARADA H,YUI K,et al.Raman spectroscop ic study of aqueous alkali sulfate solutions at high temperature and pressure to yield precipitation[J].The Journal of Supercritical Fluids,2009,49(3):303-309.
[11] SON SH,LEE J H,LEE C H.Corrosion phenomena of alloys by subcritical and supercritical water oxidation of 2-chlorophenol[J].The Journal of Supercritical Fluids,2008,44(3):370-378.
[12] SON S H,LEE J H,BYEON S H,et al.Surface chemical analysis of corroded alloys in subcritical and supercritical water oxidation of 2-chlorophenol in continuous anticorrosive reactor system [J]. Ind Eng Chem Res,2008,47(7):2265-2272.
[13] RODRÍGUEZ A,GARCÍA J,OVEJERO G,et al.Wet air and catalytic wet air oxidation of several azodyes from wastewaters:the beneficial role of catalysis[J].Water Science&Technology,2009,60(8):1989-1999.
[14] KRUSE A,VOGEL H. Heterogeneous catalysis in supercritical media:(2)near-critical and supercritical water[J].Chemical Engineering&Technology,2008,31(9):1241-1245.
[15] SAVAGE P E.A perspective on catalysis in sub-and supercritical water[J]. The Journal of Supercritical Fluids,2009,47(3):407-414.
[16] LEVEC J, PINTAR A. Catalytic wet-air oxidation p rocesses:a review[J].Catalysis Today,2007,124:172-184.
[17] CHA I F,WANGL,XU L,et al.Degradation of dye on polyoxotungstate nanotube under molecular oxygen[J].Dyes and Pigments,2008,76(1):113-117.
[18] ZHANG Y,L I D,CHEN Y,et al.Catalytic wet air oxidation of dye pollutants by polyoxomolybdate nanotubes under room condition[J].Applied Catalysis B:Environmental,2009,86(3/4):182-189.
[19] MARCÌ G,GARCÍA-LÓPEZ E,PALM ISANO L,et al.Preparation,characterization and photocatalytic activity of TiO2impregnated with the heteropolyacid H3PW12O40:photo-assisted degradation of 2-propanol in gas-solid regime[J].App lied CatalysisB:Environmental,2009,90(3/4):497-506.
(编辑:刘志强)
Subcr itical Water Oxidative Degradation of 4,4′-d ibrom obiphenyl w ith Heteropoly Zinc Salts
CHEN Jin-yang, L IZhi, RUAN Ru-yi, L IU Gui-yang
(School of Environmental and Chemical Engineering,ShanghaiUniversity,Shanghai200444,China)
X 703
A
1007-2861(2010)05-0482-06
10.3969/j.issn.1007-2861.2010.05.007
2010-04-12
上海市教委科研创新基金资助项目(09YZ30)
陈晋阳 (1971~),男,教授,研究方向为超临界流体技术与固体废弃物处理.E-mail:chenjy@shu.edu.cn
