辅助病毒依赖型腺病毒载体转基因的体外表达效率
2010-10-16郑娴娴何金生付远辉徐少华谢灿石长信张梅王小波洪涛
郑娴娴,何金生,付远辉,徐少华,谢灿,石长信,张梅,王小波,洪涛,4
1 安徽医科大学免疫学教研室,合肥 230032 2 北京交通大学生命科学与生物工程研究院,北京 100044 3 Division of Hematology-Oncology, Mayo Clinic, Scottsdale AZ 85259, USA 4 中国疾病预防控制中心病毒病预防控制所,北京 100052
辅助病毒依赖型腺病毒载体转基因的体外表达效率
郑娴娴1,2,何金生1,2,付远辉2,徐少华2,谢灿1,石长信3,张梅1,王小波1,2,洪涛2,4
1 安徽医科大学免疫学教研室,合肥 230032 2 北京交通大学生命科学与生物工程研究院,北京 100044 3 Division of Hematology-Oncology, Mayo Clinic, Scottsdale AZ 85259, USA 4 中国疾病预防控制中心病毒病预防控制所,北京 100052
构建可表达增强型绿色荧光蛋白(Enhanced green fluorescent protein,EGFP)的辅助病毒依赖型腺病毒载体(Helper-dependent adenoviral vector,HDAd),并完成大量制备、纯化和体外表达鉴定。荧光显微镜证实HDAd/EGFP可表达,电镜下观察到经 CsCl纯化后的腺病毒的典型形态。分光光度计法测定病毒的浓度为 4.0×1012颗粒数(Virus particle,vp)/mL。与可表达EGFP的第一代腺病毒载体(First generation adenoviral vector,FGAd)FGAd/EGFP进行了体外感染和转基因表达效率的比较研究,分别用约2 000 vp/细胞的HDAd/EGFP和FGAd/EGFP感染A549细胞,流式细胞仪检测EGFP的表达情况。通过相同时间点流式细胞仪分析EGFP的表达情况,可见HDAd/EGFP感染早期的A549细胞较 FGAd/EGFP有更高的荧光表达率及更高的表达强度,显示 HDAd载体具有转基因瞬时高表达的特性,是一种更有价值的疫苗载体。
辅助病毒依赖型腺病毒载体,第一代腺病毒载体,增强型绿色荧光蛋白,转基因表达
Abstract:To investigate the transgenic expressing efficacy of helper-dependent adenoviral vector(HDAd)in vitro, we constructed a HDAd encoding enhanced green fluorescent protein(EGFP), denominated as HDAd/EGFP, performed large scale preparation and purification, and then identified the purified HDAd/EGFP under fluorescent microscope and electron microscope.After the concentration of HDAd/EGFP was determined by spectrophotometer, the transgenic expression efficiency of HDAd/EGFP was compared with first generation adenoviral vector encoding EGFP(FGAd/EGFP)in vitro.Therefore, we infected A549 cells with 2 000 virus particles(vp)per cell by HDAd/EGFP and FGAd/EGFP respectively and analyzed EGFP expressing level by flow cytometry.Consequently, the fluorescent expression rate and fluorescent intensity ofEGFP were higher in early infected A549 cells by HDAd/EGFP than by FGAd/EGFP.HDAd, capable of expressing transgene instantly and efficiently in vitro, is a potential vaccine vector.
Keywords:helper-dependent adenoviral vector(HDAd), first generation adenoviral vector(FGAd), enhanced green fluorescent protein(EGFP), transgenic expression
辅助病毒依赖型腺病毒载体(Helper-dependent adenoviral vector,HDAd)是在第一代腺病毒载体(First generation adenoviral vector,FGAd)基础上研制的一种全缺失的腺病毒载体[1],仅含有腺病毒复制信号(ITRs)和包装信号(Ψ),需要辅助病毒为其提供包装所需的所有蛋白。与 FGAd相比,HDAd具有转基因容量大、转基因表达时间长、安全性高等优点,十多年来,HDAd主要用于基因治疗,作为疫苗载体的研究起步较晚,通过肌肉或静脉注射发现 HDAd具有更强的诱导机体产生针对转基因的免疫反应[2-4],我们通过滴鼻途径免疫动物也获得了类似的结果[5]。这种增强的免疫应答主要与HDAd可在体内高表达转基因及减弱的载体反应有关,关于这 2种载体体外转基因表达情况的研究较少。
绿色荧光蛋白(Green fluorescent protein,GFP)为Shimomura等[6]于1962年从多管水母属Aequorea victoria中首次分离获得,1992年由Prasher等完成其 cDNA的克隆,其开放读码框(Open reading frame,ORF)编码 238个氨基酸[7]。GFP无种属特异性、可在不同种属细胞或组织中稳定发出荧光,荧光检测不需要外加底物和辅助因子[8-9]。利用荧光显微镜和流式细胞术(Flow cytometry,FCM)可直接观察[10],无细胞毒性作用[8,11],因此被广泛应用于基因表达与调控、基因转导、细胞分化及蛋白质的胞内定位和功能研究等方面,成为继LacZ、CAT后国内外分子生物学和细胞生物学领域广泛应用的报告基因。增强型绿色荧光蛋白(Enhanced green fluorescent protein,EGFP)是经过密码子优化及氨基酸突变等一些列基因改造后获得的 GFP突变体[12],这种突变体不仅保留了GFP的所有优点,且更易于在真核细胞中表达,蛋白表达量增加,使EGFP表达的荧光强度比GFP高100倍以上,大大提高了检测灵敏度[13],而且因其具有 B细胞、Th细胞和CTL细胞表位[14-15],成为一种应用非常广泛的示踪蛋白和模式蛋白。
因此,本文以 EGFP作为报告基因,构建可表达EGFP的 HDAd/EGFP载体,大量扩增纯化及表达鉴定,并与FGAd/EGFP一起开展转基因体外表达效率的比较研究,以期为HDAd作为疫苗载体的研究提供更全面的基础信息。
1 材料与方法
1.1 材料
1.1.1 细胞株和毒株
HDAd Cre/loxP系统及 293Cre4细胞和辅助病毒H14购自加拿大Microbix公司,A549细胞由中国科学技术大学生命科学院魏海明教授馈赠,293细胞、CsCl超速离心纯化的可表达EGFP的复制缺陷型重组腺病毒FGAd/EGFP由本室保存。
1.1.2 菌株和质粒
E.coliDH10B菌株由本实验室保存,pSC11、pSC15B由美国梅奥医院血液肿瘤科石长信博士构建[16]。
1.1.3 主要试剂
限制性内切酶PmeⅠ、I-SceⅠ、I-CeuⅠ购自美国New England Biolabs公司,SAP酶、DL 1 kb marker购自Fermentas公司,T4 DNA聚合酶、T4 DNA连接酶、pfu酶购自上海 Promega公司,DL2000 marker、ExTaqDNA聚合酶、其他限制性内切酶是TaKaRa公司的产品,质粒提取及纯化试剂盒、PCR产物回收及纯化试剂盒购自美国Omega公司,引物由上海生工生物工程技术有限公司合成。
1.2 方法
1.2.1 PCR获得CMV-EGFP-SV40片段
用 FGAd/EGFP按 500 vp/细胞感染丰度约为90℅的293细胞,待72 h后,收集细胞采用Hirt法快速提取腺病毒 DNA,以此为模板,用 PCR法扩增获得目的片段 CMV-EGFP-SV40。上、下游引物分别为:5′-GTCGACTAGTAATCAATTACGGGG-3′和 5′-ACGCGTTAAGATACATTGATGAG-3′,并在引物5′端分别引入SalⅠ和MluⅠ的酶切位点。PCR条件:95℃预变性 5 min;94℃变性1 min,58℃退火30 s,72℃延伸90 s,30个循环;72℃最终延伸10 min。1%琼脂糖凝胶电泳鉴定PCR产物。
将 CMV-EGFP-SV40的 PCR回收产物与pGEM-T连接、转化、挑菌、摇菌和小提质粒,获得质粒命名为pGEM-T/EGFP,进行测序。测序鉴定正确后用SalⅠ和MluⅠ酶切pGEM-T/EGFP,切胶回收纯化CMV-EGFP-SV40片段,置于−20℃保存备用。
1.2.2 重组腺病毒质粒pSC15B/EGFP的构建
用SalⅠ和MluⅠ双酶切pSC11,将CMV-EGFPSV40与pSC11连接、转化、挑菌、摇菌,然后小提质粒,用SalⅠ和MluⅠ酶切鉴定。获得的重组质粒命名为pSC11/EGFP。
用NheⅠ和PmeⅠ酶切pSC11/EGFP,T4 DNA聚合酶、T4 DNA连接酶进行末端补平及连接,去除PmeⅠ酶切位点,获得重组质粒命名为 pSC11/EGFPNheⅠ-PmeⅠ。
用 I-SceⅠ和 I-CeuⅠ双 酶 切 pSC11/EGFPNheⅠ-PmeⅠ和pSC15B,进行连接、转化、挑菌和摇菌。提取质粒用Hind Ⅲ酶切鉴定,同时以Hind Ⅲ酶切 pSC15B作对照。得到连接成功的质粒进一步用BamHⅠ、EcoRⅠ、EcoRⅤ、Hind Ⅲ、PstⅠ酶切鉴定,获得的重组质粒命名为pSC15B/EGFP[17]。
1.2.3 重组腺病毒HDAd/EGFP的获得
用60 mm×15 mm培养皿培养293Cre4细胞待丰度达到90%左右时,取PmeⅠ酶切消化的pSC15B/EGFP线性化片段经磷酸钙共沉淀法转染。转染后第2天,弃掉培养液,加入含2% FBS的DMEM维持液。取辅助病毒H14,按500 vp/细胞感染293Cre4细胞,置 37℃、5% CO2培养箱中继续培养。约48~72 h后,细胞完全病变、脱落,收集脱落后的细胞及上清,转移至15 mL离心管中,2 000 r/min离心5 min。弃部分上清,保留约4 mL,用吸管重悬沉淀,−80℃冰箱冻存30 min,37℃水浴融化,反复3次,获得P0代HDAd/EGFP粗体液,取1 mL接种至形成单层、含2% FBS的DMEM维持液的293Cre4细胞中,同时按 100 vp/细胞加入辅助病毒,37℃、5%CO2培养箱继续培养至细胞病变。约48 h后,细胞完全病变、脱落,按上法处理293Cre4细胞,重复6轮获得P6代HDAd/EGFP粗提液[17]。
1.2.4 重组腺病毒HDAd/EGFP的大量制备及纯化
用30个150 mm×25 mm培养皿培养293Cre4细胞,待细胞丰度约为90%时,取HDAd/EGFP和辅助病毒H14共感染293Cre4细胞,约48~72 h后,收集细胞及培养液。采用 CsCl密度梯度和连续密度梯度法 2次超速离心纯化HDAd/EGFP,样品在4℃、10 mmol/L Tris-HCl 8.0中透析24 h,期间换液 3次[17]。电镜下观察纯化后病毒形态并保存于−80℃备用。
1.2.5 转基因EGFP的表达鉴定
用100 mm×20 mm培养皿培养293Cre4细胞,待细胞丰度约为90%时,用纯化的HDAd/EGFP感染293Cre4细胞,荧光显微镜下观察。
1.2.6 分光光度计测定纯化重组腺病毒HDAd/EGFP的病毒颗粒浓度
用含0.1℅ SDS的TE溶液稀释纯化的HDAd/EGFP,同时设置阴性对照。56℃温育 10 min,涡旋振荡样品后使用分光光度计测OD260的值。根据公式计算纯化重组腺病毒HDAd/EGFP的病毒颗粒浓度[18]:
病毒颗粒浓度(vp/mL)=(OD260值×稀释倍数×1.1×1012×36)/HDAd/EGFP 碱基数(kb)
1.2.7 重组腺病毒HDAd/EGFP和FGAd/EGFP转基因EGFP表达的比较
用 2块 24孔板培养A549细胞,待丰度达到90%左右时,分别用2 000 vp/细胞的HDAd/EGFP和FGAd/EGFP感染A549细胞,同时以培养的正常A549细胞作为阴性对照。
在感染后1、3、8 d时分别随机取HDAd/EGFP或FGAd/EGFP感染的A549细胞各3孔,弃培养液,用PBS液洗涤2遍后用0.25%胰酶消化,镜下观察待呈单个贴壁细胞时,弃胰酶,用PBS液吹打成单细胞悬液,流式细胞仪检测每10 000个A549细胞的EGFP表达率和EGFP平均荧光强度。
1.2.8 统计学分析方法
采用 SPSS11.5统计学软件对重组腺病毒HDAd/EGFP和FGAd/EGFP转基因EGFP表达率和表达强度进行统计学分析,两组比较使用单因素多组方差分析,当方差不齐时使用t检验,P<0.05为差异显著。
2 结果
2.1 PCR获得EGFP表达盒
以 FGAd/EGFP为模板,用 PCR法扩增获得EGFP表达盒CMV-EGFP-SV40片段,1℅琼脂糖凝胶电泳,观察到介于1 000~2 000 bp的DNA片段,与预期值 1 627 bp相符(图1)。回收的 CMVEGFP-SV40片段与pGEM-T连接,测序正确。
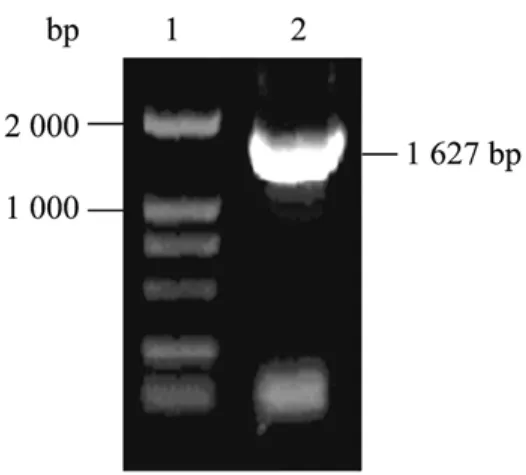
图1 PCR产物琼脂糖电泳结果Fig.1 PCR product of CMV-EGFP-SV40.1: DL2 000 marker;2: PCR product of CMV-EGFP-SV40.
2.2 构建 HDAd/EGFP重组质粒 pSC15B/EGFP及酶切鉴定
将CMV-EGFP-SV40克隆至载体pSC11,SalⅠ和MluⅠ酶切鉴定,琼脂糖凝胶电泳结果显示得到2条带,约为3 000 bp和1 600 bp,与pSC11、CMVEGFP-SV40大小一致(图2)。为进一步将EGFP表达盒克隆至pSC15B,需去除pSC11/EGFP中的PmeⅠ酶切位点,用NheⅠ和PmeⅠ酶切pSC11/EGFP,末端补平、连接后用PmeⅠ和XbaⅠ进行酶切鉴定,可观察到5 000 bp左右的线性化条带,证实已去除了PmeⅠ酶切位点。
进一步克隆EGFP基因至pSC15B,大提质粒并用BamHⅠ、EcoRⅠ、EcoRⅤ、Hind Ⅲ、PstⅠ酶切鉴定,与预计结果一致(图3)。
2.3 超速离心纯化后病毒带的观察
HDAd/EGFP与辅助病毒 H14共感染 293Cre4细胞进行扩增,经CsCl密度梯度和连续密度梯度超速离心纯化后,在管的中下部可见到上下2条乳白色病毒带,上面的带即为纯化后的HDAd/EGFP(图4)。
2.4 电镜鉴定重组腺病毒HDAd/EGFP形态
纯化后的 HDAd/EGFP经磷酸钨负染,在透射电镜下可见腺病毒典型的二十面体结构,直径约为70 nm,病毒结构完整(图5)。

图2 酶切鉴定pSC11/EGFPFig.2 pSC11/EGFP identified by restriction endonuclease assay.1: DL2 000 marker; 2: pSC11/EGFP digested withSalⅠandMluⅠ.

图3 酶切鉴定pSC15B/EGFPFig.3 pSC15B/EGFP identified by restriction endonuclease assay.1:PstⅠ; 2:EcoRⅤ; 3:EcoRⅠ; 4:BamHⅠ; 5:HindⅢ;M: DL1kb marker.

图4 经CsCl超速离心后HDAd/EGFP病毒条带Fig.4 HDAd/EGFP purified by CsCl ultracentrifugation.

图5 纯化的 HDAd/EGFP电镜下形态(1%磷钨酸pH 6.8负染,TECNAI-12)Fig.5 Purified HDAd/EGFP under electron microscope(TECNAI-12).
2.5 荧光显微镜观察转基因EGFP的表达
将纯化后的 HDAd/EGFP感染 293Cre4细胞,荧光显微镜下观察可见明显的绿色荧光(图6)。
2.6 重组腺病毒HDAd/EGFP浓度计算

图6 HDAd/EGFP感染 293Cre4细胞后表达的 EGFP(Nikon TE2000-S,100×)Fig.6 EGFP expressed by HDAd/EGFP infected 293Cre4 cells(Nikon TE2000-S, 100×).
纯化后的HDAd/EGFP稀释10倍后测得OD260值为0.33,HDAd/EGFP碱基数为33.089 kb,可得HDAd/EGFP 的病毒颗粒浓度为:(0.33×10×1.1×1012×36)/33.089≈4.0×1012vp/mL。
2.7 流式细胞仪检测HDAd/EGFP和FGAd/EGFP感染A549细胞后EGFP的表达
以2 000 vp/细胞的HDAd/EGFP和FGAd/EGFP感染A549细胞后用流式细胞仪检测A549细胞的荧光表达率和表达强度。

图7 A549细胞感染后1天时的流式直方图Fig.7 Flowcytometric histograms of infected A549 cells on day 1 after HDAd/EGFP or FGAd/EGFP infection(BECKMAN COULTER XL).(A)A549 cells.(B)FGAd/EGFP infected A549 cells.(C)HDAd/EGFP infected A549 cells.

图8 A549细胞感染后3天时的直方细胞图Fig.8 Flowcytometric histograms of infected A549 cells on day 3 after HDAd/EGFP or FGAd/EGFP infection(BECKMAN COULTER XL).(A)A549 cells.(B)FGAd/EGFP infected A549 cells.(C)HDAd/EGFP infected A549.

图9 A549细胞感染后8天时的直方细胞图Fig.9 Flowcytometric histograms of infected A549 cells on day 8 after HDAd/EGFP or FGAd/EGFP infection(BECKMAN COULTER XL).(A)A549 cells.(B)FGAd/EGFP infected A549 cells.(C)HDAd/EGFP infected A549.

图10 HDAd/EGFP、FGAd/EGFP感染 A549细胞后EGFP的表达率分析Fig.10 Percentage of EGFP expressed A549 cells after HDAd/EGFP or FGAd/EGFP infection(BECKMAN COULTER XL).

图11 HDAd/EGFP、FGAd/EGFP感染 A549细胞后EGFP的荧光强度Fig.11 Fluorescence intensity of EGFP expressed by A549 cells after HDAd/EGFP or FGAd/EGFP infection(BECKMAN COULTER XL).
图7、图8、图9分别显示A549细胞感染重组腺病毒后 1、3、8 d时流式细胞仪所检测得到的流式直方图。图7A、图8A、图9A为A549细胞作为阴性对照,设置M1区域,图7B/C、图8B/C、图9B/C中M2区代表有EGFP表达的A549细胞。图10显示感染 HDAd/EGFP的 A549细胞在感染后的第 1天和第3天较FGAd/EGFP有更高的EGFP表达率(P<0.05),在第8天两者没有明显差异(P>0.05);图11显示感染HDAd/EGFP的A549细胞在感染后第 1天和第 3天,EGFP的平均荧光强度均比FGAd/EGFP强(P<0.05),在第 8天两者的平均荧光强度没有明显差异(P>0.05)。
3 讨论
腺病毒为长约36 kb的线性双链DNA病毒,无包膜,具有宿主范围广、可感染分裂和非分裂细胞、外源基因容纳量大、转导效率高、病毒滴度高、易繁殖和纯化等优点[19],被广泛应用于基因治疗和疫苗研究中。FGAd由于保留了腺病毒的大部分基因,低水平表达的腺病毒蛋白不仅对转导的细胞产生毒性作用,在体内也可引起针对腺病毒载体的免疫反应,当再次使用腺病毒载体时,容易被机体免疫系统快速清除而无法长期表达转基因[20]。HDAd又被称为空壳载体(Gutless or gutted vector),缺失除了腺病毒复制信号(ITRs)和包装信号(Ψ)以外的其他所有腺病毒基因,感染后无病毒自身蛋白表达[1],大大降低了细胞毒性和机体的免疫反应[20],可以持续表达转基因达1年以上[21],安全性更好;大量病毒自身基因的缺失使得HDAd的外源基因容纳量高达37 kb,可同时表达多个基因用于多基因疾病的研究[22];另外,HDAd在包装过程中需要借助辅助病毒为其提供所有的结构和功能蛋白,来源于不同血清型的辅助病毒,可形成不同血清型的腺病毒,避免反复使用同一血清型腺病毒载体所产生的中和抗体的影响[23]。
本实验对HDAd和FGAd体外感染转基因表达率和表达强度进行了比较,我们分别用约2 000 vp/细胞的HDAd/EGFP和FGAd/EGFP感染A549细胞,结果显示感染HDAd/EGFP的细胞3 d内EGFP的表达率高于FGAd/EGFP感染的细胞,随着时间的推移2组 EGFP的表达率无统计学差异,提示在体外感染肺泡来源的上皮细胞后,感染的早期HDAd较FGAd有更高的转基因表达率;同时我们监测了 HDAd/EGFP和FGAd/EGFP感染A549细胞后EGFP的表达强度,结果同样显示在感染后3天内HDAd/EGFP较FGAd/EGFP有更高的EGFP表达,随着时间的推移 2组的表达率也无统计学差异,说明感染早期HDAd在体外感染的肺泡上皮来源的细胞中转基因的表达较 FGAd具有一定优势。我们的结果与文献报道的体内结果基本一致[2-3]。由于HDAd/EGFP和FGAd/EGFP均为5型腺病毒来源,具有相同的衣壳蛋白,HDAd/EGFP较FGAd/EGFP有更高的体外转基因表达效率的原因,目前仍不是十分清晰,我们推测:1)FGAd/EGFP除了含有EGFP表达盒外,还含有17个腺病毒蛋白的ORF[3],虽然缺失了E1和E3区,仍存在的低水平表达会影响或干扰EGFP的表达,而 HDAd/EGFP仅有一个 EGFP表达盒,不存在任何腺病毒蛋白的干扰,因此转基因的表达更加迅速、高效;2)两种载体转基因表达效率趋向一致的时间长短,与细胞生长状况有关,细胞活性的下降直接影响了HDAd转基因的高效表达。我们认为HDAd载体这种转基因瞬时高表达的特性是其作为疫苗载体,获得比 FGAd载体更好的免疫原性的重要原因之一。需要指出的是转基因的表达水平由多种因素决定,不仅与载体有关,也与转基因本身的生物学性质如细胞毒性作用等有关,这些因素会对HDAd的转基因表达效率产生一定影响。
由于大多数病毒通过黏膜途径,尤其是呼吸道入侵机体,因此我们认为应及时开展HDAd作为黏膜免疫载体的可行性及效率研究,以期为开发RSV等经黏膜途径感染的病毒疫苗探索一条新的途径。鉴于这种认识,我们选择了具有较好的免疫原性、不抑制机体的免疫应答[3,15-16]、也没有细胞毒性的EGFP作为模式蛋白,用于探讨 HDAd作为黏膜疫苗载体的可行性,避免转基因对HDAd免疫效果不利的影响,以期真实反映HDAd作为黏膜疫苗载体的可行性。进一步的实验证实了我们的想法,经滴鼻途径免疫 BALB/c小鼠的比较研究表明:HDAd/EGFP能诱导产生更好的体液、细胞及黏膜免疫应答,具有Th1和Th2平衡的特点,HDAd/EGFP加强(Boost)免疫具有明显的免疫增强效果。证实了HDAd作为黏膜疫苗载体用于预防经呼吸道黏膜途径感染的RSV等病毒病原的疫苗研究是合理、可行的,将有助于克服目前RSV等疫苗研究中存在的安全性不足、免疫效果不理想等问题,作为安全有效的黏膜疫苗载体,HDAd具有较好的应用前景[5]。
总之,我们已成功构建了 HDAd/EGFP载体,获得可高效表达EGFP的HDAd/EGFP,并在体外开展了转基因表达效率的初步研究,与 FGAd载体相比,HDAd载体具有转基因瞬时高表达的特性,证实HDAd是很有潜力的疫苗载体。
REFERENCES
[1]Mitani K, Graham FL, Caskey CT,et al.Rescue,propagation and partial purification of a helper virus-dependent adenovirus vector.Proc Natl Acad Sci USA, 1995, 92(9): 3854−3858.
[2]Harui A, Roth MD, Kiertscher SM,et al.Vaccination with helper-dependent adenovirus enhances the generation of transgene-specific CTL.Gene Ther, 2004, 11(22):1617−1626.
[3]Eric AW, Pramod NN, Stephanie SB,et al.Comparison of replication-competent, first generation, and helper-dependent adenoviral vaccine.PloS ONE, 2009, 4(3): 5059.
[4]Weaver EA, Nehete PN, Nehete BP,et al.Protectin against mucosal sHIV challenge by peptide and helper-dependent adenovirus vaccine.Viruses, 2009, 1(2):920−938.
[5]Fu YH, He JS, Zheng XX,et al.Intranasal vaccination with a helper-dependent adenoviral vector enhances transgene-specific immune responses in BALB/c mice.Biochem Biophys Res Commun, 2010, 391(1): 857−861.
[6]Shimomura O, Johnson FH, Saiga Y.Extraction,puirification and properties of Aequoria, a bioluminescent protein from the luminous hydromedusan Aequorea.J Cell Comp Physiol, 1962, 59(2): 223−229.
[7]Prasher DC, Eckenrode VK, Ward WW,et al.Primary structure of the Aequorea victoria green-fluorescent protein.Gene, 1992, 111(2): 229−233.
[8]Chalfie M, Tu Y, Euskirchen G,et al.Green fluorescent protein as a marker for gene expression.Science, 1994,263(5148): 802−805.
[9]Heim R, Prasher DC, Tsien RY.Wavelength mutations and posttranslational autoxidation of green fluorescent protein.Proc Natl Acad Sci USA, 1994, 91(26):12501−12504.
[10]Cormack BP, Valdivia RH, Falkow S.FACS-optimized mutants of the green fluorescent protein(GFP).Gene,1996, 173(1 Spec No): 33−38.
[11]Simon PD, Vorwerk CK, Mansukani SS,et al.bcl-2 Gene therapy exacerbates excitotoxicity.Hum Gene Ther, 1999,10(10): 1715−1720.
[12]Zhang G, Gurtu V, Kain SR.An enhanced green fluorescent protein allows sensitive detection of gene transfer in mammalian cells.Biochem Biophys Res Commun, 1996, 227(3): 707−711.
[13]Chiu WL, Niwa Y, Zeng W,et al.Engineered GFP as a vital reporter in plants.Curr Biol, 1996, 6(3): 325−330.
[14]Stripecke R, Carmen Villacres M, Skelton D,et al.Immune response to green fluorescent protein:implications for gene therapy.Gene Ther, 1999, 6(7):1305−1312.
[15]Rosenzweiq M, Connole M, Glickman R,et al.Induction of cytotoxic T lymphocyte and antibody responses to enhanced green fluorescent protein following transplantation of transduced CD34(+)hematopoietic cells.Blood, 2001, 97(7): 1951−1959.
[16]Shi CX, Graham FL, Hitt MM.A convenient plasmid system for construction of helper-dependent adenoviral vectors and its application for analysis of the breast-cancer-specific mammaglobin promoter.J Gene Med, 2006, 8(4): 442−451.
[17]Yang B, He JS, Shi CX,et al.Construction and preparation of helper-dependent adenoviral vector expressing human respiratory syncytial virus F gene.Acta Mcrobiol Sin, 2007, 47(4): 682-685.杨兵, 何金生, 石长信, 等.可表达人呼吸道合胞病毒融合蛋白辅助病毒依赖型腺病毒载体的构建与制备.微生物学报, 2007, 47(4): 682−685.
[18]Ng P, Parks RJ, Graham FL.Methods in Molecular Medicine.Gene Therapy Protocols.2nd ed.Totowa:Humana Press Inc., 2002, 69: 384.
[19]Patterson S, Papaqatsias T, Benlahrech A.Use of adenovirus in vaccines for HIV.Handb Exp Pharmaacol,2009,(188): 275−293.
[20]Fu YH, He SJ, Shi CX,et al.Advances in helper-dependent adenoviral vector.Acta Mcrobiol Sin,2009, 49(2): 147−152.付远辉, 何金生, 石长信, 等.辅助病毒依赖型腺病毒载体的研究进展.微生物学报, 2009, 49(2):147−152.
[21]Morral N, O’Neal W, Rice K,et al.Administration of helper-dependent adenoviral vectors and sequential delivery of different vector serotype for long-term liver-directed gene transfer in baboons.Proc Natl Acad Sci USA, 1999, 96(22): 12816−12821.
[22]Jozkowicz A, Dulak J.Helper-dependent adenoviral vector in experimental gene therapy.ActaBiochim Pol,2005, 52(3): 589−599.
[23]Parks R, Evelegh C, Graham F,et al.Use of helper-dependent adenoviral vectors of alternative serotypes permits repeat vector administration.Gene Ther,1999, 6(9): 1565−1573.
Journals.im.ac.cn
In vitro transgenic expression efficacy of a helper-dependent adenoviral vector encoding enhanced green fluorescent protein
Xianxian Zheng1,2, Jinsheng He1,2, Yuanhui Fu2, Shaohua Xu2, Can Xie1, Changxin Shi3,Mei Zhang1, Xiaobo Wang1,2, and Tao Hong2,4
1 Department of Immunology, Anhui Medical University, Hefei 230032, China 2 College of Life Sciences & Bioengineering, Beijing Jiaotong University, Beijing 100044, China 3 Division of Hematology-Oncology, Mayo Clinic, Scottsdale AZ 85259, USA 4 Institute of Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 100052, China
Received:February 21, 2010;Accepted:April 28, 2010
Supported by:National Natural Science Foundation of China(No.30671965).
Corresponding author:Jinsheng He.Tel: +86-10-51684080; Fax: +86-10-51683887; E-mail: jshhe@bjtu.edu.cn国家自然科学基金(No.30671965)资助。
