黄曲酶尿酸氧化酶突变体的构建、表达、纯化及生物学活性分析
2010-10-16张金龙任军李冰刘树玲侯利华付玲李建民陈薇
张金龙,任军,李冰,刘树玲,侯利华,付玲,李建民,陈薇
军事医学科学院微生物流行病研究所 病原微生物生物安全国家重点实验室,北京 100071
黄曲酶尿酸氧化酶突变体的构建、表达、纯化及生物学活性分析
张金龙,任军,李冰,刘树玲,侯利华,付玲,李建民,陈薇
军事医学科学院微生物流行病研究所 病原微生物生物安全国家重点实验室,北京 100071
采用融合PCR的方法将黄曲霉尿酸氧化酶(UOX)基因的307~309 bp的TGC(Cys)突变为GCC(Ala),将所获得的突变体基因克隆到原核表达质粒pET-42a(+)后转化大肠杆菌BL21(DE3)。经IPTG诱导,突变体蛋白(UOX-Ala103)得到高水平的可溶性表达,目的蛋白占总蛋白含量的45%。疏水柱及阴离子柱纯化后,UOX-Ala103蛋白纯度>98%。Western blotting分析证实UOX-Ala103能与抗UOX单抗特异结合。与天然型相比较,其体外生物学活性增加约60%,在高尿酸血症小鼠模型体内也有良好的降解尿酸的活性。
黄曲霉尿酸氧化酶,突变体,半胱氨酸,表达,纯化,生物活性
Abstract:We converted the TGC codon(307–309 bp)ofAspergillus flavusurate oxidase(UOX)gene to a GCC codon by using fusion PCR techniques to produce a C103A mutant.This gene was cloned into expression vector pET-42a(+)and then transformed intoEscherichia coliBL21(DE3).The mutant protein(UOX-Ala103)was expressed in soluble form at high levels after induction with IPTG.The expressed rUOX-Ala103accounted for about 45% of total bacterial proteins.rUOX-Ala103of up to 98% purity was obtained after purified using hydrophobic interaction and anion exchange.Western blotting showed that the anti-UOX antibody specifically recognized rUOX-Ala103.The mutant protein showed a 60% increasedinvitrobiological activities compared with native protein, and performed a good activity of degrading the uric acidinvivo.
Keywords:urate oxidase(UOX), mutant, cysteine, expression, purification, biological properties
尿酸氧化酶(Uricase,EC1.7.3.4)是生物体内嘌呤代谢的关键酶,它能够催化尿酸氧化形成尿囊酸。许多物种体内均发现有尿酸氧化酶,但是鸟类和一些高级灵长类动物体内却缺乏此酶,而以尿酸作为嘌呤代谢的终产物。尿酸及其盐类在血液中溶解度很低,而尿酸在体内的累积导致了痛风症[1-6]。直接从黄曲霉提取的尿酸氧化酶(Uricozyme®)和用酵母表达的重组黄曲霉尿酸氧化酶 Rasburicase(Fasturtec®/Elitek®)均已经成功应用于控制接受化疗的病人的尿酸水平。但UOX的活性会在纯化过程中降低。质谱分析表明活性降低的 UOX的 Cys103有一个通过二硫键连接的半胱氨酸加合物。这一现象可能导致了黄曲霉尿酸氧化酶的活性下降[7]。黄曲霉尿酸氧化酶共有Cys35、Cys103、Cys290三个半胱氨酸,且在正常情况下均不形成分子内或分子间的二硫键。本实验对黄曲霉尿酸氧化酶的 Cys103基因进行了定点突变,将其突变为结构上只比Cys少一个硫原子的Ala,随后成功地表达纯化了该突变体蛋白(UOX-Ala103)。并且在免疫原性、体外活性、及体内活性等方面与天然型(UOX-Cys103)进行了对比。研究了半胱氨酸残基对UOX催化活性的影响,从而为 UOX的结构和功能的研究提供相关有用的信息。
1 材料和方法
1.1 材料
菌株E.coliBL21(DE3)、菌株E.coliDH5α、原核表达载体pET-42a(+)均由本实验室保存。限制性内切酶、T4 DNA连接酶购自NEB公司;Pyrobest Taq、ExTaq、pMD-18T载体购自TaKaRa公司;胶回收试剂盒及质粒小提试剂盒购自OMEGA公司;DEAE-Sepharose FF、Phenyl Sepharose FF和 Phenyl Sepharose HP 填料购自GE公司;抗UOX的单克隆抗体为本实验室自行制备;酵母提取物和蛋白胨购自Gibco-BRL公司;其他化学试剂为国产分析纯试剂。
1.2 方法
1.2.1 UOX-Ala103的定点突变
根据 GenBank公布的序列(Accession No.X61776)利用Primer Premier 5.0设计4条引物(表1),其中AU-UP及AU-LOWER中的下划线部分为引入的NdeI及Hind III酶切位点,AU103-LOWER中的下划线部分为所突变的位点,由原序列的GCA突变为 GGC,相应的半胱氨酸被突变为丙氨酸。AU-103UP及AU103-LOWER中的阴影部分是为了方便拼接而设计的互补序列。采用两轮扩增:第 1轮为突变,分上下游2个片段进行。模板为本室保存的含有UOX的cDNA的pMD-UOX质粒[8],所采用聚合酶为Pyrobest Taq,引物对分别为:上游片段(C103A-UP):AU-UP/AU-103-LOWER;下游片段(C103A-LOWER):AU-103-LOWER/AU-LOWER。PCR反应条件为:94 ℃ 5 min ;94℃ 30 s,56℃ 30 s,72 ℃ 1 min,25 个循环;72℃ 7 min。回收PCR产物后进行第2轮PCR融合上下游片段:所采用模板为 C103A-UP+C103A-LOWER;引物对为 AU-UP/AU-LOWER;聚合酶为Ex Taq;PCR反应条件同上轮。PCR结束后琼脂糖凝胶电泳并回收目的片段。

表1 定点突变PCR引物Table 1 PCR primers of site-directed mutagenesis
1.2.2 构建测序载体
凝胶回收后连接pMD-18T载体:16℃连接2 h,然后转化 DH5α感受态细胞,氨苄青霉素筛选,挑取克隆做菌落PCR鉴定,并用质粒小提试剂盒提取质粒后用NdeI/Hind III作双酶切鉴定,将符合预期结果的阳性克隆送英骏北京公司测序。
1.2.3 构建表达载体
测序正确的菌株提取的质粒及 pET-42a(+)载体进行双酶切,琼脂糖凝胶回收并纯化目的基因片段,再和载体片段后按一定比例混合后加入T4 DNA连接酶,16℃连接2 h后转化DH5α感受态细胞,卡那霉素筛选,挑取克隆做菌落PCR鉴定,并用质粒小提试剂盒提取质粒后用NdeI/Hind III作双酶切鉴定,结果符合预期的质粒编号为pET42a-UOX-Ala103。并将之转化入表达菌株BL21(DE3)。
1.2.4 诱导表达
挑单克隆接种到2 mL含有卡那霉素(30 μg/mL)的新鲜LB培养基中,37℃、200 r/min过夜培养。次日,取0.2 mL接种到装有5 mL新鲜LB培养基的玻璃试管内,37℃、200 r/min培养至OD600≈1.0时,加入浓度为0.6 mmol/L的IPTG,37℃、200 r/min培养,诱导表达5 h后8 000 r/min离心10 min收集菌体,用1 mL PBS(pH 7.2)重悬后超声破碎,12 000× g离心15 min后分全菌、上清、沉淀进行12% SDS-PAGE电泳分析表达情况及可溶性。
1.2.5 破菌及纯化
挑单克隆接种到50 mL含有卡那霉素(30 μg/mL)的新鲜LB培养基中,37℃、200 r/min过夜培养。次日,取20 mL接种到装有1 L新鲜LB培养基的容量为 5 L的玻璃摇瓶中,诱导表达、收集菌体条件同1.2.3。收集到的菌体用 80 mL溶液 A(20 mmol/L PB,pH 7.2)重悬后超声破碎、12 000× g离心15 min后取上清,加入1/2体积的溶液C(20 mmol/L PB,3 mol/L(NH4)2SO4,pH 7.2)之后上用溶液B(20 mmol/L PB,1 mol/L(NH4)2SO4,pH 7.2)预平衡的疏水层析柱(Phenyl Sepharose FF),目的蛋白结合在层析柱上,溶液 B再平衡后,2个柱体积、0%A→100% A梯度洗脱;疏水层析洗脱蛋白用 G-25脱盐柱(Hiprep 26/10 Desalting)脱盐至溶液 D(20 mmol/L PB,0.075 mol/L NaCl,pH 8.0)后过阴离子层析柱(DEAE-Sepharose FF),收集流穿液,加入 1/2体积的溶液 C,用疏水层析柱(Phenyl Sepharose HP)进一步精纯。精纯后的蛋白进行SDS-PAGE电泳分析。
1.2.6 Western blotting分析
UOX-Ala103蛋白 SDS-PAGE电泳后电转到PVDF膜上(用UOX-Cys103作参照),用5%的脱脂奶粉封闭,室温2 h;TBST洗3次,每次10 min,然后加一抗(1∶10 000 Anti-UOX);37℃孵育 2 h后TBST洗3次,每次10 min,然后加二抗(1∶5 000 anti-rabbit IgG-HRP);室温孵育1 h后TBST洗3次,每次15 min,洗完后用化学发光法显影。
1.2.7 体外和体内活性分析
加 1 μg纯化后的 UOX-Ala103到含有 0.3 μmol尿酸的4.5 mL的TEA缓冲液(7.5 g/L 三乙醇胺,0.38 g/L EDTA,pH 8.9)中,30℃条件下反应5 min后加 0.5 mL的20% KOH终止反应。通过检测292 nm处吸光度值的下降所反映的尿酸浓度的降低,从而得出酶的活性。酶活性定义:在pH 8.9、30℃条件下,每分钟催化1 μmol尿酸氧化所需的酶量为一个单位[8]。
40只雄性BLAB/C小鼠,体重22~24 g。10只腹腔注射0.5 mL生理盐水(含0.5%羧甲基纤维素钠),不给尿酸氧化酶作为空白对照。30只腹腔注射含尿酸(按1 000 mg/kg体重计)及羧甲基纤维素钠的生理盐水 0.5 mL。其中 10只尾静脉注射UOX-Ala103(按0.2 mg/kg体重计);10只尾静脉注射等量的同等条件下纯化的(UOX-Cys103),剩余 10只不给药作为模型组。给药后分1 h、2 h、4 h尾静脉采血,7 500 r/min、10 min离心取血清检测尿酸含量。应用SPSS11.0统计软件包进行数据处理,实验数据以均数±标准差(±s)表示,采用One-Way ANOVA分析,P<0.05为差异有统计学意义。
2 结果
2.1 UOX-Ala103的基因突变、融合及重组质粒的鉴定
以pMD-UOX质粒为模板的第1轮扩增产物经琼脂糖凝胶电泳后,可见上游片段和下游片段分别在约300 bp和600 bp附近有扩增产物,与预期相符(图1)。第2轮PCR融合得到长约903 bp的片段,与预期目标一致(图1)。测序结果与GenBank公布的黄曲霉尿酸氧化酶序列进行比对,其序列的307~309 bp的TGC(Cys)突变为GCC(Ala),突变成功。所构建的 pET42a-UOX-Ala103质粒经NdeI/Hind III双酶切后琼脂糖凝胶电泳鉴定,结果得到长约903 bp的片段(图2),与预期结果一致,证明重组质粒构建成功。

图1 UOX-Ala103定点突变Fig.1 The site-directed mutagenesis of UOX-Ala103gene by fusion PCR.1: AU103-UP; 2: AU103-LOWE; 3: UOX-Ala103;M1 and M2: DNA marker.
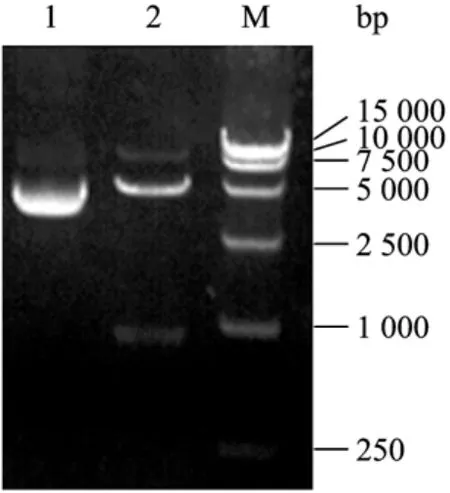
图2 质粒pET42a-UOX-Ala103Nde I/Hind III双酶切鉴定Fig.2 Identification of plasmid pET42a-UOX-Ala103by the double enzyme digestion ofNdeI/Hind III.1: plasmid pET42a-UOX -Ala103; 2: pET42a-UOX-Ala103digested withNdeI/Hind III; M: DNA marker.
2.2 诱导表达及可溶性鉴定
所构建的表达菌株诱导表达后,超声破菌,离心后将全菌、上清、沉淀进行SDS-PAGE分析,与诱导前相比,诱导后在约34 kDa处出现一条明显的条带,约占全部菌体蛋白的45%,且绝大多数在上清中。说明重组UOX-Ala103诱导表达成功。并主要以可溶性形式存在。与未经突变的重组UOX-Cys103一致(图3)。

图3 SDS-PAGE分析UOX-Ala103表达Fig.3 SDS-PAGE analysis of UOX-Cys103expression.1–4:UOX-Cys103; 5–8: UOX-Ala103; 1 and 5: total bacterial protein without induction; 2 and 6: total of the bacterial lysate after induction; 3 and 7: supernatant of the bacterial lysate after induction; 4 and 8: pellet of the bacterial lysate after induction;M:protein marker.
2.3 纯化结果SDS-PAGE及Western blotting分析结果
诱导表达后的菌体超声破碎离心后的上清经三步纯化,得到纯度大于98%的UOX-Ala103重组蛋白(图4A)。Western blotting分析结果证明其能够与抗UOX的单克隆抗体特异结合(图4B)。

图4 三步纯化后的UOX-Ala103蛋白的SDS-PAGE分析(A)及Western blotting分析(B)Fig.4 SDS-PAGE analysis and of UOX-Ala103 Western blotting analysis after three-step purification.(A)SDS-PAGE analysis.1–8: UOX-Ala103after three-step purification; M:protein marker.(B)Western blotting analysis.1: UOX-Cys103;2: UOX-Ala103.
2.4 体外和体内活性分析结果
按照1.2.6所述方法测定,纯化后的UOX-Ala103比活力为 20.14 IU/mg,同等条件下表达纯化的UOX-Cys103比活力为12.62 IU/mg,103位的Cys突变为 Ala之后比活增加了 59.57%。体内活性实验结果如表2所示,相对于空白组,模型组的小鼠血清中的尿酸的含量在各时间点均有很大提高(1 h,2 h:P<0.01;4 h:P<0.05),造模成功。与模型组相比较,UOX-Cys103及UOX-Ala103组的小鼠血清中的尿酸含量下降明显(各时间点P<0.001),证明二者均有降低高尿酸血症模型小鼠体内尿酸的作用,UOX-Cys103与 UOX-Ala103相比无统计学意义差异,在本次实验内未能观测到 UOX的Cys103→Ala103突变后对体内活性的影响。

表2 注射UOX后小鼠体内的尿酸浓度(x ±s,μmol/L)Table 2 Concentration of uric acid in mouse after UOX was injected(x ±s, μmol/L)
3 讨论
黄曲霉尿酸氧化酶的活性形式是由 4个分子量约为34 kDa的单体组成的同四聚体,4个亚基围在一起形成了一个隧道式结构。整个结构好像一个高70 Å、外径约为60 Å、内径约为12 Å的桶。四聚体的稳定主要靠接触面上的反向平行的β折叠主链原子之间的氢键维系。每个四聚体含有4个活性中心,由 Phe159、Arg176、Gln228、Asn254、His256及相邻的亚基的 Lys10、Thr57组成[9-13],用Launch Discovery Studio软件对UOX的晶体结构(1R56.pdb)进行分析发现四聚体内的活性位点位于2个相邻亚基之间的交界处(图5),故推测其活性对四聚体的结构变动较为敏感。UOX含有3个半胱氨酸Cys35、Cys103、Cys290,晶体结构表明,其中Cys35、Cys290的硫原子朝向四聚体孔道的内部,与溶液中的游离半胱氨酸接触几率很小,纯化后的成品中此2个位置不含Cys加合物。而Cys103的硫原子朝向四聚体的外表面(图6),与溶液中的游离半胱氨酸接触机率很大。所以UOX-Cys103在制备过程中,Cys103会与游离的 Cys通过二硫键结合,使之多出一个Cys加合物,从而引起等电点降低、极性增加、活性下降等现象[7]。本研究中将Cys103突变为侧链不含硫原子的Ala,所以纯化后的蛋白质中不含Cys加合物,从而使其在体外活性增加。体内活性实验中,二者在体内降解尿酸的能力相当,原因可能是因为体内环境下没有维系二硫键的有利氧化势,这种非正常的二硫键会在二硫化物异构酶的作用下解开,消除了Cys加合物对其结构的影响,也有可能是因为所采用的标准剂量(0.2 mg/kg体重)对于本实验来说过高,所以掩盖了二者的差异,有待进一步的实验验证。

图5 UOX活性位点与四聚体中各亚基的位置关系Fig.5 Relative position of active site with subunits in the tetramer.Amino acids constituted active site is shown in yellow.The A subunit is shown in blue.The B subunit is shown in brown.

图6 UOX一个亚基中的半胱氨酸在四聚体中的位置Fig.6 Representation of one monomer’s cysteine in the tetramer.The cysteine is shown in yellow.
黄曲霉尿酸氧化酶是罕见的隧道式蛋白(Tunneling-fold protein)家族4个成员中最新发现的一个,其中心孔道的作用至今尚不明确[12]。而黄曲霉尿酸氧化酶的催化相对于其他的氧化还原酶类是十分独特的,因为它没有金属离子或其他的辅基参与到电子传递之中[9]。其催化机理还存在很多的争议。本研究通过突变的方法获得了体外活性比野生型更高的UOX-Ala103突变体,可以使其在尿酸的各种体外检测中更加有效。另外,本研究为从结构上进一步研究隧道式蛋白结构与功能之间的关系及黄曲霉尿酸氧化酶的催化原理打下基础。
REFERENCES
[1]Wu X, Lee CC, Muzmy DM,et al. Urate oxidase: primary structure and evolutionary implications.Proc Natl Acad SciUSA, 1989, 86(23): 9412–9416.
[2]Oestreicher N, Scazzocchio C.Sequence, regulation, and mutational analysis of the gene encoding urate oxidase inAspergillus nidulans.J Biol Chem, 1993, 268(31):23382–23389.
[3]Coiffier B, Mounier N, Bologna S,et al.Efficacy and safety of rasburicase(recombinant urate oxidase)for theprevention and treatment of hyperuricemia during induction chemotherapy of aggressive non-hodgkin’s lymphoma: results of the GRAAL1(Groupe d’Etude des Lymphomes de l’Adulte Trial on Rasburicase Activity in Adult Lymphoma)study.J Clin Oncol, 2003, 21(23):4402–4406.
[4]Legoux R, Delpech B, Dumont X,et al.Cloning and expression inEscherichia coliof the gene encodingAspergillus flavusurate oxidase.J Biol Chem, 1992,267(12): 8565–8570.
[5]Oda M, Satta Y, Takenaka O,et al.Loss of urate oxidase activity in hominoids and its evolutionary implications.Mol Biol Evol, 2002, 19(5): 640–653.
[6]Wu SL, Chen B, Liu CQ,et al.Expression inEscherichia coli, purification and enzymatic properties of porcine urate oxidase.Chin J Biotech, 2009, 25(11): 1664–1670.吴双林, 陈斌, 刘成倩, 等.猪尿酸氧化酶在大肠杆菌中的表达、纯化与部分酶学性质分析.生物工程学报,2009, 25(11): 1664–1670.
[7]Bayol A, Capdevielle J, Malazzi P,et al.Modification of a reactive cysteine explains differences between rasburicase and uricozyme, a naturalAspergillus flavusuricase.Biotechnol Appl Biochem, 2002, 36: 21–31.
[8]Li J, Chen Z, Hou L,et al.High-level expression,purification, and characterization of non-taggedAspergillus flavusurate oxidase inEscherichia coli.Protein Expr Purif, 2006, 49(1): 55–59.
[9]Colloc'h N, Girard E, Dhaussy AC,et al.High pressure macromolecular crystallography: the 140-MPa crystal structure at 2.3 Ǻ resolution of urate oxidase, a 135-kDa tetrameric assembly.Biochim Biophys Acta, 2006 1764(3):391–397.
[10]Retailleau P, Colloc'h N, Vivares D,et al.Complexed and ligand-free high-resolution structures of urate oxidase(Uox)fromAspergillus flavus: a reassignment of the active-site binding mode.Acta Crystallogr D Biol Crystallogr, 2004, 60: 453–462.
[11]Gabison L, Prange T, Colloc'h N,et al.Structural analysis of urate oxidase in complex with its natural substrate inhibited by cyanide: mechanistic implications.BMC Struct Biol, 2008, 8: 32.
[12]Retailleau P, Colloc'h N, Vivarès D,et al.Urate oxidase fromAspergillus flavus: new crystal-packing contacts in relation to the content of the active site.Acta Crystallogr D Biol Crystallogr, 2005, 61: 218–229.
[13]Colloc'h N, el Hajji M, Bachet B,et al.Crystal structure of the protein drug urate oxidase-inhibitor complex at 2.05 Ǻ resolution.Nat Struct Biol, 1997, 4: 947–952.
Construction, expression, purification and characterization of mutant of Aspergillus flavus urate oxidase
Jinlong Zhang, Jun Ren, Bing Li, Shuling Liu, Lihua Hou, Ling Fu, Jianmin Li, and Wei Chen
State Key Laboratory of Pathogens and Biosecurity, Laboratory of Applied Molecular Biology, Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences, Beijing 100071, China
Received:February 26, 2010;Accepted:April 19, 2010
Corresponding author:Jianmin Li.Tel: +86-10-66948692; Fax: +86-10-63815273; E-mail: ljmqz@yahoo.com.cn Wei Chen.Tel: +86-10-66948565; Fax: +86-10-63815273; E-mail: cw789661@yahoo.com
