拟南芥FRUITFULL(FUL) 基因的表达调控模式
2010-10-11褚婷婷谢华徐勇马荣才
褚婷婷,谢华,徐勇,马荣才
1 首都师范大学生命科学学院,北京 100048
2 北京市农林科学院 农业生物技术研究中心,北京 100097
农业生物技术
拟南芥FRUITFULL(FUL) 基因的表达调控模式
褚婷婷1,2,谢华1,2,徐勇2,马荣才1,2
1 首都师范大学生命科学学院,北京 100048
2 北京市农林科学院 农业生物技术研究中心,北京 100097
FRUITFULL(FUL) 基因是一类MADSbox基因,在控制开花时间、花分生组织分化、茎生叶形态以及心皮和果实的发育中发挥重要作用。为了阐明FUL的表达调控模式,克隆了拟南芥Arabidopsis thalianaFUL启动子区(−2 148 bp~+96 bp) 及其第一内含子,并构建一系列启动子分段缺失表达载体及含FUL第一内含子的融合载体。并进一步构建了各顺式作用元件融合拟南芥TUBULIN和ACTIN启动子的表达载体。转基因拟南芥分析结果表明,FUL启动子的上游存在2个抑制其表达的顺式作用元件,其中一个很可能与转录因子AP1的结合有关;2个存在于上游调控区的CArG-box对FUL基因表达起到重要的调控作用;FUL基因第一内含子参与拟南芥心皮和雄蕊的发育调控,而且有增强基因表达的作用。
拟南芥,FUL基因,启动子,第一内含子,缺失分析,GUS活性
Abstract:FRUITFULL(FUL) is anMADSbox gene that functions early in controlling flowering time, meristem identity and cauline leaf morphology and later in carpel and fruit development inArabidopsis thaliana. In order to clarify the regulation ofFULexpression the upstream regulatory region, −2 148 bp−+96 bp and the first intron of theFULgene were cloned, and vectors with a series of deletion ofFULpromoter, and the ones fused with the first intron were constructed. Vectors harboring the fusion ofcis-acting elements with the constitutive promoters ofTUBULINandACTINwere also constructed.β-Glucuronidase activity assays of the transgenic Arabidopsis plants showed that twocis-elements were involved in the repression ofFULexpression, with one of the two being probably the binding site of the transcriptional factor AP1. And the two CArG boxes played a important role inFULinitiation particularly. Furthermore, the first intronofFULwas shown toparticipate in the development of carpel and stamen as an enhancer.
Keywords:Arabidopsis thaliana,FULgene, upstream regulatory region, the first intron, deletion analysis, GUS activity
拟南芥Arabidopsis thaliana中FRUITFULL(FUL)基因,也称为AGL8(AGAMOUS-LIKE 8)[1],属于一类MADSbox基因,编码一种特异性转录因子。FUL和APETALA1(AP1)、CAULIFLOWER(CAL) 都属于AP1/SQUA-like基因亚家族[2],在花同源异型器官发育的ABCDE模型中,同属A类基因[3]。其中AP1是花序分生组织特征基因,也是花器官特征基因,促进花瓣和萼片的发育[4]。而AP1的旁系同源基因CAL,只在花发育过程中促进花分生组织的形成[5]。与AP1和CAL相比,FUL基因则具有更广泛的功能:它既能在花发育早期促进花序分生组织的形成,又能在花发育晚期心皮及幼嫩角果中表达,同时还能调控叶片的发育[6]。
在控制拟南芥开花时间方面,FUL和TERMINAL FLOWER(TFL)[7]、SUPPRESSOR OF OVEREXPRESSION OFCONSTANS 1(SOC1)[8]等起到促进花起始发育的作用。拟南芥是兼性长日照植物,在长日照 (16 h/d) 条件下比短日照 (8 h/d) 提前开花。在光周期依赖性开花途径中,各种光周期调节基因由整合子CONSTANS(CO) 整合后,激活FLOWER LOCUS T(FT) 基因在叶片维管束中表达,FT被运送到顶端分生组织后,引发FUL和SOC1在顶端分生组织中表达,FUL参与调控芽分生组织向花序分生组织的转变,随后FUL和SOC1在发育的花序原形成层中表达诱导其向花分生组织的转变,从而控制开花时间[9]。
在拟南芥发育早期,FUL受AP1负调控。早期的营养器官内FUL几乎不表达,直至拟南芥转变为生殖生长后,FUL基因才在花序分生组织中强烈表达[1]。FUL由于受到AP1抑制,最初只限定在花序分生组织中间的肋状区 (Rib zone) 中表达。植株抽薹后,主茎花序延伸明显,茎生叶发育成披针形,叶腋处产生无限花序分生组织,后来,产生侧生有限花序分生组织,后者只分化为不含托叶的花。在花发育过程中,FUL在花分生组织的中央区域表达,此区域后期发育成心皮。在心皮发育初期,FUL在整个心皮原基中表达,而随着心皮的继续发育,FUL则主要集中在心皮的外壁上表达,并从其他类型的心皮组织细胞如胚珠、花柱、柱头以及子房隔膜上消失[10]。此外,当拟南芥转为生殖生长后可检测到FUL在芽分生组织、莲座叶、茎生叶中也有表达。Bamnolker等发现,在叶片中,FT的产物促进FUL和SEPALLATA3(SEP3) 在莲座叶、茎生叶的维管束中表达,从而控制叶片的形态[11]。
FUL基因控制拟南芥果实发育的功能也备受关注。一方面,FUL控制角果的伸长,突变体ful植株的心皮在受精后不久就停止伸长,导致生成短小的果荚。同时,FUL也控制角果果皮细胞的发育,ful突变体的果皮细胞发育受阻,形成拉链状扭曲的果皮[12]。另外,FUL基因也与拟南芥角果果荚开裂的性状有关。研究表明果荚离层特异基因SHATTERPROOF1(SHP1)/SHATTERPROOF2(SHP2)[13]促进下游基因ALCATRAZ(ALC) 和INDEHISCENT(IND) 的表达,其中基因IND控制果荚离层的7层细胞的不均等分裂[14],而ALC控制果荚离层细胞的木质化[15]。在果荚中FUL基因抑制SHP1/2基因的表达,进而抑制ALC和IND在果荚中的表达,阻止果荚的木质化[16]。假隔膜中有REPLUMLESS(RPL) 基因[17]抑制SHP1/2、ALC和IND在假隔膜中的表达。因此,在FUL和RPL共同抑制作用下,SHP1/2、ALC和IND基因只在果荚离层里表达,从而调控了果荚的开裂。研究表明,过表达FUL的转基因拟南芥果荚离层细胞中SHP1/2、ALC和IND表达量下降,离层细胞形成受阻,且木质化程度降低,导致成熟角果的果荚不开裂[18]。芸苔属农作物,如油菜,由于果荚开裂造成产量降低,是导致农业生产损失的重要方面,而易位表达FUL在控制果荚开裂的特性中起到重要作用,因此具有一定的研究价值[19]。
对于FUL基因功能的研究已经比较深入,然而对于FUL基因上游调控元件、内含子作用及表达调控模式的研究还很不深入。因此本实验旨在进一步阐明FUL基因表达的时空特异性及调控模式,试图找到起作用的顺式作用元件,及其调控的分子基础,以期进一步揭示调控FUL基因表达的上游基因产物的作用位点,为后期深入研究FUL基因的新功能及其参与的调控网络奠定基础。
1 材料与方法
1.1 材料
野生型拟南芥Arabidopsis thalianaCol-0植株;菌种为大肠杆菌Escherichia coli菌株DH5α,根癌农杆菌菌株Agrobacterium tumefaciensC58 (GV 3101::pMP90RK);质粒为pBI121。所用菌种、质粒均由本实验室保藏。限制性内切酶、Taq酶、Ex Taq酶和T4 DNA连接酶购自大连TaKaRa试剂公司。其他化学试剂均为国产分析纯。
1.2 各种植物表达载体的构建
根据 http://www.arabidopsis.org/搜索到基因FRUITFULL(At5G60910)、ACTIN(At3G46520)[20]和TUBULIN(At5G62690)[21]的序列,设计各种引物,见表1。通过PCR扩增得到FUL的启动子序列 (简称为 PFUL) 及第一内含子序列 (简称为 Intron1),ACTIN启动子序列 (简称为PACT),TUBULIN启动子序列(简称为PTUB)。并通过 PLACE Web Signal Scan找到FUL启动子上游 DNA元件 CArG box(CC(A/T)6GG)[22]。CaMV 35S启动子中46 bp的基本启动子区mini35S序列[23]。
构建一系列表达框:FUL启动子序列的分段缺失表达框 PFUL2244(−2 148 bp~+96 bp);PFUL2083(−1 987 bp~+96 bp);PFUL1580(−1 484 bp~+96 bp);PFUL1124 (−1 028 bp~+96 bp);PFUL474(−378 bp~+96 bp);FUL第一内含子融合CaMV35S基本启动子 mini35S的表达框 Intron1+mini35S;PFUL2244融合Intron1的表达框PFUL2244+Intron1;PFUL2244删除含2个CArG-box的−1 916 bp~−1 737 bp区的表达框PFUL△CArG;TUBULIN、ACTIN启动子的表达框PTUB、PACT;FUL的上游调控序列PFUL161(−2 148 bp~−1 987 bp) 分别融合 PTUB、PACT的表达框PFUL161+TUB、PFUL161+ACT;PTUB、PACT分别融合 Intron1的表达框 PTUB+Intron1、PACT+Intron1。将上述所有表达框代替pBI121载体中的CaMV35S启动子,启动GUS表达,各表达框示意图见图1。
1.3 拟南芥转化和阳性苗筛选
参考 Clough和 Bent的方法[24]。电击法将植物表达载体转化至农杆菌 C58中,将含表达载体的农杆菌接入YEP培养基中 (含Kan 100 mg/L;Ter 10 mg/L;Rif 50 mg/L),200 r/min、28℃小摇过夜,再在400~500 mL YEP培养基中 (含Kan 100 mg/L;Ter 10 mg/L;Rif 50 mg/L) 接种 3 mL菌液,200 r/min、28℃大摇过夜至OD600大于 2.0。在4 900 ×g、4℃离心15 min收集菌体,并悬浮于大约3倍体积的渗透培养液,此时的OD600约为0.8。采用花序浸渍法完成对拟南芥的侵染,将植株移入正常条件下培养3~4周,收集种子。将收获的拟南芥T0代种子经消毒处理后,播种于含50 mg/L Kan的1/2 MS培养基平板上,4℃低温处理2~3 d转入20℃光照培养室。将初步得到的阳性苗移到营养土中,继续培养。

表1 本实验所用的引物Table 1 Primers used in the experiment
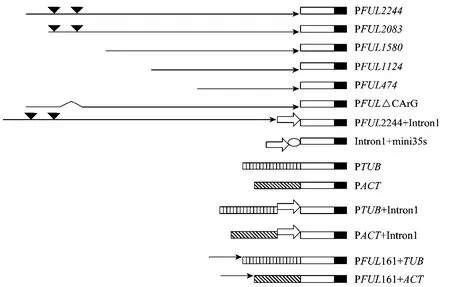
图1 构建的表达框Fig.1 Construction of expression cassettes.represents the upstream regulatory sequences of FUL;represents GUS coding region;representsNos;represents CArG box;represents Intronl;represents 1PTUB;representsPACT;represents MINI35S Promoter;represents deletion of two GArG box.
1.4 GUS活性检测
T0代植株收获种子后,经连续4代的卡那霉素抗性筛选、PCR检测选择,在T3代得到各转基因植株的纯合株系。GUS组织化学染色参考Jefferson的方法[25]。取每种转基因材料 T3代经 PCR鉴定为阳性的15~20个独立株系,将植物组织浸入适量的染色缓冲液中,后加入适量的浓度为1 mg/mL X-Gluc溶液,抽真空 5 min,密封 37℃避光过夜,70%酒精漂洗多次脱除叶绿素,观察组织是否有蓝色出现。将各种转基因植株染色后在Leica MZ16F荧光体式显微镜下观察并拍照。
GUS定量分析参考 Gallagher的方法[26]。GUS活性用每毫克蛋白每分钟形成的 4-MU的 pmol表示,取每种转基因材料T3代15~20个独立株系进行测量求各自平均值。
2 结果与分析
2.1FUL启动子分段缺失转基因植株的 GUS活性
各种转基因T3代植株经PCR鉴定后,取PCR结果为阳性的15~20个独立株系进行GUS组织化学染色。其中每种转基因植株都有一定比例 (约65%~82%) 的独立株系染色结果相同,具体比例数据见表2。
转基因植株PFUL2244播种后7 d (图2a)、14 d(图2b)、21 d (图2c) 的植株GUS染色均为阴性。抽苔开花后,PFUL2244 (图2d,2e) 在莲座叶、茎生叶和花的萼片中有GUS表达,而野生型Col-0没有GUS活性 (图2f)。
转基因植株PFUL2083播种后7 d (图3a)、14 d(图3b)、21 d (图3c) 的植株幼苗期子叶和幼小莲座叶均有GUS表达。抽苔开花后,PFUL2083 (图3d,3e) 在莲座叶、茎、茎生叶及花的萼片均有GUS活性。并且PFUL2083的GUS活性比PFUL2244增加0.4 倍 (图 6)。

表2 各转基因植株相同表达模式株系所占比例Table 2 Proportion of same expression patterns in different transgenic plants

图2 最长启动子PFUL2244的GUS染色模式Fig.2 GUS staining of transgenic plant PFUL2244. (a, b, c)GUS staining of seedlings at 7, 14 and 21 days of the transgenic plant PFUL2244, respectively. (d) GUS staining of PFUL2244 after the transition from vegetative growth to reproductive growth. (e) GUS staining of floral organ of PFUL2244. (f) GUS staining of Col.
抽苔开花后的转基因植株 PFUL1580 (图 3f)、PFUL1124 (图3g) GUS染色均为阳性,而PFUL474(图 3h)、PFUL△CArG (图 3i) 和野生型 Col (图 2f)无GUS活性。并且PFUL1124 的GUS活性较强,PFUL1580较弱。
2.2FUL第一内含子 (Intron1) 转基因植株的GUS活性
在营养器官中,PFUL2244+Intron1和PFUL2244的GUS表达模式基本相同,而在生殖器官中,两者产生明显差别 (图 4a,左 PFUL2244+Intron1,右PFUL2244)。PFUL2244+Intron1 (图 4b) 从花蕾期到角果伸长期在萼片和心皮中GUS都有表达,并且通过组织解剖染色可看到,随着心皮的发育GUS活性从整个心皮向其两端集中 (图4c)。而且PFUL2244+Intron1在成熟雄蕊的花粉丝中也有明显的GUS染色 (图 4d,4e)。而 PFUL2244 只在萼片中表达 GUS,心皮和雄蕊都没有活性(图 4f、4g、4h、4i)。这说明FUL的第一内含子在调控其表达模式中起着重要的作用。

图3 各FUL启动子缺失片段转基因植株GUS染色模式Fig.3 GUS staining of transgenic plants harboring different deletion ofFULpromoter. (a, b, c) GUS staining of seedlings at 7, 14 and 21 days of the transgenic plant PFUL2083,respectively. (d) GUS staining of PFUL2083 after the transition from vegetative growth to reproductive growth. (e) GUS staining of floral organ of PFUL2083. GUS staining of transgenic plants PFUL1580 (f), PFUL1124 (g), PFUL474 (h)and PFULCArG (i), respectively.
2.3 Intron1和PFUL161功能的进一步研究
进一步研究FUL第一内含子 Intron1和上游−2 148 bp~−1 987 bp (PFUL161) 区的功能。转基因植株 Intron1+mini35S (图 5e) 在茎、叶片、萼片和柱头中GUS表达均很强,比CaMV35S启动GUS(图5a,为转 pBI121植株) 活性还强。ACTIN和TUBULIN启动GUS表达活性都比较弱,只在PTUB(图5b) 叶脉、花芽中和PACT(图5f) 叶片的叶脉、花托基部有少量表达。而 PTUB+Intron1 (图 5c) 的GUS活性明显提高,在叶片、花芽和茎中表达较强,PACT+Intron1 (图5g) GUS活性也有提高,在花柄、萼片及茎中有较强表达。但 PFUL161+TUB(图 5d)和 PFUL161+ACT(图 5h) 的 GUS活性分别与PTUB、PACT没有太大的差别。
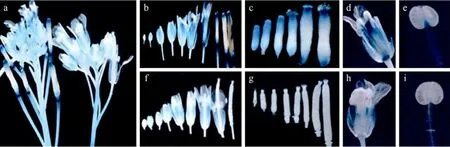
图4 转基因植株PFUL2244+Intron1和PFUL2244的GUS染色Fig.4 GUS staining of transgenic plants PFUL2244+ Intron1and PFUL2244. (a) GUS staining of PFUL2244+Intron1 (left) and PFUL2244 (right). (b, f) GUS staining of floral organs of PFUL2244+Intron1and PFUL2244 from bud to silique, respectively. (c, g)GUS staining of the carpels of PFUL2244+ Intron1 and PFUL2244 in different stages, respectively. (d, h) GUS staining of anatomical floral organ of PFUL2244+ Intron1and PFUL2244, respectively. (e, i) GUS staining of stamens of PFUL2244+Intron1and PFUL2244,respectively.
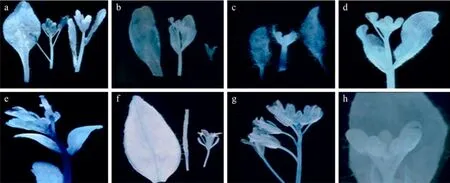
图5 其他转基因植株的GUS染色Fig.5 GUS staining of other transgenic plants. GUS staining of transgenic plants pBI121 (a), PTUB(b), PTUB+Intron1 (c),PFUL161+TUB(d), Intron1+mini35S (e), PACT(f), PACT+Intron1 (g), PFUL161+ACT(h), respectively.
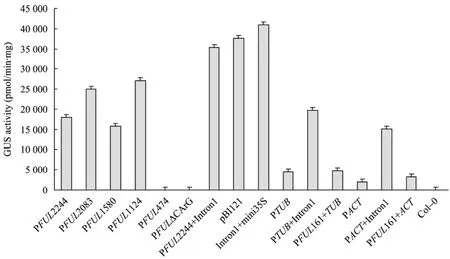
图6 各转基因植株GUS定量分析Fig.6 GUS activity analyses of different transgenic plants.
2.4 各种转基因植株GUS活性定量分析
从每种转基因株系T3代植株选取15~20株GUS组织化学检测为阳性的进行GUS定量分析,各自取平均值代表各转基因植株GUS表达的活性,见图6。定量结果表明,转基因植株 Intron1+mini35S GUS染色活性最高,约是转基因植株pBI121的1.1倍。PFUL2244+Intron1、PFUL2083、PFUL1124 GUS 活性较强;PFUL2244、PFUL1580活性较弱;PFUL474和 PFUL△CArG几乎无 GUS活性;Intron1使TUBULIN和ACTIN驱动GUS表达的能力增强;PFUL161抑制TUBULIN和ACTIN启动子的能力并不明显,与GUS组织化学染色结果基本相符。
3 讨论
基因的表达受到由 DNA上的顺式作用元件与特异的反式作用因子构成的调控复合物的调控,从而表现出时空特异性。转录因子与顺式元件的相互作用可能诱导或抑制基因的表达,这些作用是通过复杂的调控机制来实现的[27]。启动子分段缺失是研究相关的顺式作用元件的有效方法。本实验通过构建FUL一系列启动子分段缺失片段及内含子载体,通过转基因、GUS活性分析等技术,分析实验结果,可得到以下结论:
拟南芥FUL启动子上游调控序列−2 148 bp~−1 987 bp区能够抑制其自身启动子的活性,而将−2 148 bp~−1 987 bp区连接到启动子TUBULIN和ACTIN中则不能抑制它们的活性。这说明FUL启动子上游调控序列−2 148 bp~−1 987 bp区的抑制作用不具有普遍性,很可能是拟南芥中某个抑制FUL基因表达的转录因子的特异结合区域。PFUL2244(−2 148 bp~+96 bp) 在营养生长阶段无GUS活性,表明在营养生长阶段FUL启动子及上游调控区(−2 148 bp~+96 bp) 无法启动GUS表达,直至转变为生殖生长阶段,茎生叶和花器官中才有GUS活性,这与Jefferson等[25]的研究一致,他们将2.3 kbFUL启动子融合GUS基因,转基因拟南芥在营养生长阶段没有GUS活性,而一旦转入生殖生长,在花分生组织和新生的茎生叶中表现出GUS活性。本实验中转基因植株PFUL2083 (−1 987 bp~+96 bp) 营养生长阶段的子叶、幼小莲座叶、茎以及生殖生长阶段的茎生叶、萼片均有 GUS活性。根据 Mandel和Yanofsky[1]研究表明AP1抑制FUL在营养生长阶段的表达,直到转为生殖生长阶段在花分生组织发育到第 3阶段时FUL才开始大量上调表达,并且在新生的茎生叶中FUL也开始表达。综上,我们认为−2 148 bp~−1 987 bp及其附近区域很可能就是转录因子AP1的结合位点。但是对于AP1是否真正作用于此区域,直接作用,还是与其他转录因子结合后再作用于此位点等问题还有待下一步深入研究。
FUL上游调控序列−1 484 bp~−1 028 bp区也能够抑制自身启动子的活性,其作用机制还需进一步研究。−378 bp~+96 bp区不能单独启动FUL表达,表明这是启动子最基本的核心区域。序列分析表明FUL启动子在−1 916 bp~−1 737 bp区含有2个CArG-box。CArG-box是具有MADS结构域的转录因子结合位点,具有序列保守性,一般为 CC(A/T)6GG[28]。将−1 916 bp~−1 737 bp删除,则PFUL△CArG失去启动活力,说明对于FUL启动子来说,这 2个CArG-box起到很重要的作用。但是很难解释的是,更短的FUL启动子缺失表达载体虽然不含这 2个CArG-box却能启动GUS的表达。这暗示了在靠近基本启动子的区域有与这 2个 CArG-box共同起作用的顺式作用元件,它们与转录因子相互作用形成复杂的复合体,共同调控基因表达。
本实验研究还表明FUL的第一内含子参与FUL的表达调控。Deyholos和Sieburth的研究表明拟南芥AG基因的第二内含子具有调控功能,其 3′端序列对于激活AG的早期表达和调控AG在心皮中的表达有重要作用,而 5′端的序列对AG在雄蕊中的表达更为重要[29]。AG-Like基因与AG基因有一定的序列相似性,调控元件也有一定保守性,AG-Like基因的内含子中大多至少包含一个CArG-box[30]。根据PLACE Web Signal Scan序列分析表明FUL(AGL8)的第一内含子内部存在2个CArG-box (图7)。本实验的结果证明FUL的第一内含子对拟南芥从幼蕾期到角果伸长期的心皮发育起调控作用,并且随着发育的进行,调控的区域逐渐向心皮两端集中。而且FUL的第一内含子也参与雄蕊花粉丝的发育。这与AG的第二内含子的调控模式比较相似。另外,FUL的第一内含子具有类似增强子的作用,其增强作用通过转基因植株PTUB+Intron1和PACT+Intron1的GUS活性得到验证。表明Intron1有普遍的增强表达的作用。而且 Intron1+mini35S单独启动GUS表达的能力比CaMV35S 还要强,如图5e所示,转基因植株的叶片、茎、花器官中的萼片、心皮都有比较深的染色。并且GUS定量分析的结果也验证了其启动GUS的能力比CaMV35S 还要强。所以有可能将FUL的Intron1+mini35S开发成像CaMV35S一样的通用启动子,但这有待于进一步的验证。
总之,我们验证了在FUL启动子的上游存在2个抑制FUL表达的顺式作用元件,并且其中一个很可能与转录因子AP1的结合有关。在FUL上游调控序列的2个CArG-box,对FUL的启动活性起到重要作用。FUL基因的第一内含子参与拟南芥心皮和雄蕊的发育调控,而且有增强基因表达的作用。对于FUL基因表达模式的研究有利于将其更好地应用于作物新品种的培育,如通过在油菜上过表达FUL或其同源基因可防止油菜角果开裂,其他木本植物如桃、苹果和桦树的FUL同源基因的异源表达,能促进早花,改变植株形态,减少二级分枝。相信随着FUL基因的深入研究,必将在农作物增产、品种改良方面作出重大贡献。
REFERENCES
[1] Mandel MA, Yanofsky MF. TheArabidopsis AGL8 MADSbox gene is expressed in inflorescence meristems and is negatively regulated byAPETALA1.Plant Cell, 1995, 7:1763−1771.
[2] Litt A, Irish VF. Duplication and diversification in theAPETALA1/FRUITFULLfloral homeotic gene lineage:implications for the evolution of floral development.Genetics, 2003, 165: 821−833.
[3] Theißen G. Development of floral organ identity: stories from the MADS house.Curr Opin Plant Biol, 2001,4:75−85.
[4] Coen ES, Meyerowitz EM. The war of the whorls: Genetic interactions controlling flower development.Nature, 1991,353: 31−37.
[5] Kempin SA, Savidge B, Yanofsky MF. Molecular basis of the cauliflower phenotype inArabidopsis.Science, 1995,267: 522−525.
[6] Ferrándiz C, Gu Q, Martienssen R,et al.Redundant regulation of meristem identity and plant architecture byFRUITFULL,APETALA1andCAULIFLOWER.Development, 2000, 127: 725−734.
[7] Alvarez J, Guli CL, Yu XH,et al.Terminal flower: a gene affecting inflorescence development inArabidopsis thaliana.Plant J, 1992, 2(1): 103−116.
[8] Borner R, Kampmann G, Chandler J,et al.A MADSdomain gene involved in the transition to flowering inArabidopsis.Plant J, 2000,24(5): 591−599.
[9] Melzer S, Lens F, Gennen J,et al. Flowering-time genes modulate meristem determinacy and growth form inArabidopsis thaliana.Nature Genetics, 2008, 40:1489−1492.
[10] Ferrándiz C, Pelaz S, Yanofsky MF. Control of carpel and fruit development inArabidopsis.Annu Rev Biochem,1999, 68: 321–354.
[11] Bamnolker PT, Samach A. The flowering integrator FT regulatesSEPALLATA3andFRUITFULLaccumulation inArabidopsisleaves.Plant Cell, 2005, 17: 2661−2675.
[12] Gu Q, Ferrándiz C, Yanofsky MF,et al. TheFRUITFULLMADS-box gene mediates cell differentiation duringArabidopsisfruit development.Development, 1998, 125:1509−1511.
[13] Liljegren SJ, Ditta GS, Eshed Y,et al.SHATTERPROOFMADS-box genes control seed dispersal inArabidopsis.Nature, 2000, 404: 766−770.
[14] Liljegren, SJ, Roeder A, Kempin S,et al. Control of fruit patterning inArabidopsisbyINDEHISCENT.Cell, 2004,116(6): 843−853.
[15] Rajani S, Sundaresan V. TheArabidopsismyc/bHLH geneALCATRAZenables cell separation in fruit dehiscence.Curr Biol, 2001, 11(24): 1914−1922.
[16] Ferrándiz C, Liljegren SJ, Yanofsky MF. Negative regulation of theSHATTERPROOFgenes byFRUITFULLduringArabidopsisfruit development.Science, 2000,289:436−438.
[17] Roeder A., Ferrándiz C, Yanofsky MF. The role of the REPLUMLESS homeodomain protein in patterning theArabidopsisfruit.Curr Biol, 2003, 13(18): 1630−1635.
[18] Jack T. Plant development going MADS.Plant Mol Biol,2001,46: 515–520.
[19] Chandler J, Corbesier L, Spielmann P,et al.Modulating flowering time and prevention of pod shatter in oilseed rape.Mol Breed, 2005, 15: 87–94.
[20] Kabsch W, Vandekerckhove J. Structure and function of actin.Annu Rev Biophys Biomol Struct, 1992, 21: 49−76.
[21] Kopczak SD, Haas NA, Hussey PJ,et al.The small genome ofArabidopsiscontains at least six expressed[alpha]-Tubulingenes.Plant Cell, 1992, 4(5): 539−547.
[22] Riechmann JL, Meyerowitz EM. MADS domain proteins in plant development.Biol Chem, 1997, 378: 1079–1101.
[23] Zhang JD, Lu LT, Ji LS,et al. Functional characterization of a tobacco matrix attachment region-mediated enhancement of transgene expression.Transgenic Res,2009, 18: 377−385.
[24] Clough SJ, Bent AF. Floral dip: a simplified method forAgrobacterium-mediated transformation ofArabidopsis thaliana.Plant J, 1998, 16: 735−743.
[25] Jefferson RA, Kavanagh TA, Bevan MW. GUS fusions:beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants.EMBO J, 1987, 6(13): 3901−3907.
[26] Gallagher SR. GUS Protocols: Using the GUS Gene as a Reporter of Gene Expression. San Diego, CA: Academic Press Inc, 1992: 47−59.
[27] Zhu C, Perry SE. Control of expression and autoregulation ofAGL15, a member of the MADS-box family.Plant J,2005, 41: 583−594.
[28] Miwa T, Kedes L. Duplicated CArG box domains have positive and mutually dependent regulatory roles in expression of the human alpha-cardiac actin gene.Mol Cell Biol, 1987, 7(8): 2803−2813.
[29] Deyholos MK, Sieburth LE. Separable whorl-specific expression and negative regulation by enhancer elements within theAGAMOUSsecond intron.Plant Cell, 2000,12(10): 1799−1810.
[30] Parcy F, Nilsson O, Busch MA,et al. A genetic framework for floral patterning.Nature, 1998, 395(6702): 561−566.
Regulation pattern of theFRUITFULL(FUL) gene ofArabidopsis thaliana
Tingting Chu1,2, Hua Xie1,2, Yong Xu2, and Rongcai Ma1,2
1College of Life Science,Capital Normal University,Beijing100048,China
2Beijing Agro-Biotechnology Research Center,Beijing Academy of Agriculture and Forestry Sciences,Beijing100097,China
Received:March 18, 2010;Accepted:May 24, 2010
Supported by:National Basic Research Program of China (973 Program) (No. 2007CB1087).
Corresponding author:Rongcai Ma. E-mail: marc@bjny.gov.cn
国家重点基础研究发展计划 (973计划) (No. 2007CB1087) 资助。
