慢病毒载体感染成年食蟹猴骨髓间充质干细胞
2010-10-11任振华王淑艳张颖邹春林张愚
任振华,王淑艳,张颖,邹春林,张愚
1 首都医科大学 宣武医院细胞治疗中心,北京 100053
2 安徽医科大学 人体解剖学教研室,合肥 230032
组织工程与细胞培养
慢病毒载体感染成年食蟹猴骨髓间充质干细胞
任振华1,2,王淑艳1,张颖1,邹春林1,张愚1
1 首都医科大学 宣武医院细胞治疗中心,北京 100053
2 安徽医科大学 人体解剖学教研室,合肥 230032
骨髓间充质干细胞 (Mesenchymal stem cells,MSCs) 具有增殖和多向分化潜能,临床应用广泛,近年来备受关注。另一方面,MSCs易于转导和表达外源基因,是理想的基因工程细胞。非人灵长类 (NHPs) 和人类具有非常相近的遗传背景,NHPs模型在评价药物疗效和移植治疗等方面具有不可替代的价值。本研究采用密度梯度离心法分离成年食蟹猴骨髓单核细胞 (Marrow mononuclear cells,MNCs),贴壁培养 MSCs。同时构建表达绿色荧光蛋白 (Green fluorescent protein,GFP) 的慢病毒载体,感染成年食蟹猴MSCs。结果显示,体外培养的成年食蟹猴MSCs均感染猴泡沫病毒 (Simian foamy virus,SFV),体外培养成年食蟹猴MSCs必须添加抗病毒药物Tenofovir。但由于食蟹猴MSCs感染SFV,以及培养中添加了抗病毒药物Tenofovir,慢病毒载体的感染效率明显降低 (<10%)。本研究通过停用抗病毒药,在细胞复苏后6 d转染慢病毒,可大幅提高慢病毒的感染效率 (>50%)。为成年食蟹猴MSCs作为基因工程细胞应用于实验和临床研究提供了技术保证。
食蟹猴骨髓间充质干细胞,绿色荧光蛋白,慢病毒载体,猴泡沫病毒,转导
Abstract:Mesenchymal stem cells (MSCs) have received considerable attention for various therapeutic approaches in recent years. MSCs are also easy to genetically modify to express therapeutic genes by using lentiviral vectors. Because of the similarities in genetics, physiology and metabolism between non-human primates (NHPs) and humans, NHPs models are invaluable for researching human disorders and for developing therapeutic strategies. Therefore, MSCs derived from NHPs could be a powerful tool for cell therapy and genetic engineering. Studies from captive and free-ranging adult NHPs show that up to 100% were infected with simian foamy virus (SFV). In this study, we found that all cultured MSCs derived from adult cynomolgus monkey were infected with SFV by RT-PCR. Therefore, antiviral drugs must be added in MSCs culture. However, because of SFV infection and additive antiviral drugs, the infection efficiency of the lentiviral vectors reduced significantly. In this study, we improved the infection efficiency by disabled antiviral drugs before lentiviral infection. It might be provide technical assistance for the culture of adult cynomolgus monkey MSCs as genetically engineered cells applied to clinical and experimental research.
Keywords: cynomolgus monkey mesenchymal stem cells, green fluorescent protein, lentiviral vectors, simian foamy viruses,transduction
骨髓间充质干细胞 (MSCs) 是来自于骨髓的成体干细胞,因其具有增殖和多向分化潜能、造血支持、免疫调控等特点而备受关注[1-2]。MSCs在体外可分化成为脂肪、成骨、软骨等中胚层的组织细胞。由于其良好的可塑性和不涉及伦理争议,MSCs成为组织工程和细胞治疗的最佳种子细胞[3-5]。在遗传学上,MSCs易于转导、表达外源基因[6]。不论是质粒、还是病毒载体均可携带目的基因转导MSCs,在体外长期、高效地表达,而不影响干细胞的特性[7-9]。因此,MSCs是基因工程理想的靶细胞。
非人灵长类 (NHPs) 和人类具有非常相近的遗传背景[10-11],实验显示NHPs与人类MSCs具有相似的生物学特征[12]。NHPs模型在评价药物疗效和移植治疗等方面具有不可替代的价值[13]。然而,研究显示成年 NHPs感染猴泡沫病毒 (SFV) 高达100%[14],体外培养来自于NHPs的MSCs必须添加抗病毒药物[15],这给MSCs慢病毒感染带来了困难。本研究采用密度梯度离心法,分离培养成年食蟹猴MSCs,复苏后的MSCs停用抗病毒药,在停药6 d后感染绿色荧光蛋白 (GFP) 慢病毒载体,大幅提高成年食蟹猴MSCs慢病毒感染效率,为食蟹猴MSCs作为基因工程细胞进一步应用于实验或临床研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1实验动物
实验动物包括6只8~10岁健康成年食蟹猴和1只SFV阴性幼年食蟹猴,由广西南宁灵康赛诺科生物科技有限公司提供,灵长类动物按照国际实验动物评估和认证管理委员会 (AAALAC) 的标准饲养,动物病原体检疫和生物安全检验合格。
1.1.2细胞和质粒
293T细胞由北京大学生命科学院分子生物学实验室惠赠。慢病毒载体转移质粒DUET101-GFP、包装质粒CMV△8.91和PMD.G由美国Johns Hopkins大学程临钊教授惠赠。
1.1.3实验试剂
细胞培养试剂DMEM-F12、DMEM、OPTI-MEM、MSC-Qualified FBS、BSA、0.25%Trysin-EDTA、GlutaMAX™-I Supplement、N2、青链霉素等购自Invitrogen公司。Ficoll-Paque TM Plus单核细胞分离液购自 StemCell公司。碱性成纤维细胞生长因子(bFGF) 购自 R&D公司。转染试剂 Lipofectamine 2000购自 Invitrogen公司。Polybrene、DMSO、Transferrin购自Sigma公司。潮霉素 (Hygromycin)购自 Roche公司。逆转录酶 SSII和 Trizol购自Invitrogen公司。rTaq酶购自TaKaRa公司,DNA mini kit购自 Qiagen公司。Tenofovir购自 LGM Pharmaceuticals公司。
1.2 实验方法
1.2.1食蟹猴MSCs培养
无菌条件下从食蟹猴髂骨嵴抽取5 mL骨髓,加入等体积的 DPBS稀释,贴壁缓慢加入离心管内盛有等体积的Ficoll分离液上,2 500 r/min离心20 min,小心吸取中间层细胞置于另一离心管中,PBS洗涤 2次,5×105cells/mL单核细胞种植在DMEM低糖培养基,包含10% FBS、1%青链霉素、1% GlutaMAX、20 ng/mL bFGF 和 10 µmol/L Tenofovir,5% CO2、37℃孵箱培养,24 h后更换培养基,80%长满后 0.25%胰酶消化传代。体外培养扩增 MSCs到一定数量后冻存,每毫升冻存液中细胞不应低于106个细胞,异丙醇逐步降温,−80℃过夜,转移到液氮中保存。
1.2.2体外培养MSCs感染SFV
按照DNA提取试剂盒的操作步骤,提取食蟹猴MSCs基因组DNA。用Trizol裂解MSCs,提取RNA,Oligo(dT) 逆转成cDNA。按照文献报道[16-17],特异引物检测体外培养的食蟹猴 MSCs感染 SFV的比例。引物序列包括:round 1:forward 5′-AGGATGGT GGGGACCAGCTA-3′;reverse 5′-GCTGCCCCTTG GTCAGAGTG-3′。round 2:forward 5′-CAGTGAA TTCCAGAATCTCTTC-3′;reverse 5′-CACTTATCCC ACTAGATGGTTC-3′。
1.2.3慢病毒载体包装和浓缩
慢病毒包装采用脂质体介导的瞬时转染法,293T细胞培养在高糖 DMEM 培养基,包含 10%FBS、1% Glutamine和1%青链霉素。将293T细胞传代于多聚赖氨酸包被的培养皿,待细胞80%汇合后转染。转染过程中,首先将构建好的编码GFP的转移质粒 DUET101、包装质粒 CMV△8.91和PMD.G按一定比例溶于 OPTI-MEM 中,同时将Lipofectamine 2 000溶于等体积的OPTI-MEM中,室温放置5 min。然后将两者混合,轻柔混匀,室温静置20 min。用OPTI-MEM培养基更换293T细胞培养基后,加入转染混合液。待转染混合液培养8~12 h后,换成ITS培养基 (DMEM高糖培养基包含10 µg/mL Insulin、5 µg/mL Transferrin、1% Glutamine和1%青链霉素),分别于24 h和48 h后收集病毒上清,用0.45 µm滤器过滤细胞碎片,4℃保存。将病毒上清加入 Ultra-Plus 20滤膜,4℃、4 000× g离心20 min,所得浓缩病毒转染293T细胞进行滴度鉴定后,−80℃保存,用于下一步实验。
1.2.4慢病毒载体感染MSCs
将成年食蟹猴MSCs冻存管从液氮中取出,37℃迅速解冻,转移入15 mL离心管中加入10 mL不含抗病毒药物Tenofovir的MSCs培养基,1 000 r/min离心2 min。吸出上清,种植于含有或不含抗病毒药物Tenofovir的MSCs培养基中。按1∶3传代,用含有或不含抗病毒药物Tenofovir的MSCs培养基继续培养 2~6 d。等到细胞长满 70%,更换新鲜培养基,根据GFP慢病毒滴度和细胞数量,分别于不同的时间点 (2、4、6 d),按不同拷贝数 (1、5、10、15) 加入病毒上清,同时按培养基体积加入8 µg/mL的polybrene。孵育20 h后弃去转染液,加入新鲜培养基。继续培养1周后,荧光显微镜观察GFP阳性细胞,流式细胞仪计数慢病毒感染效率。SFV阴性食蟹猴MSCs作为对照。
1.3 统计分析
数据以x±s表示,SPSS16.0软件进行统计分析。采用单因素方差分析,P<0.05认为差异有统计学意义。
2 结果
2.1 成年食蟹猴MSCs培养
骨髓单核细胞 (MNCs) 以 2×105cells/cm2接种于25 cm2的培养瓶,48 h后更换培养基,2~4 d后出现增殖克隆,部分细胞呈纺锤形或多角形,大小长短不一。经8~10 d培养,细胞80%融合,细胞形态转变成以长梭形为主,呈涡旋状排列生长。胰酶消化传代,当细胞扩增到一定数量后冻存。
2.2 慢病毒载体包装和滴度检测
GFP慢病毒载体DUET101包含2个启动子结构EF1-α和PGK,分别驱动GFP基因和潮霉素抗性基因 (图1E)。慢病毒载体系统的3个质粒DUET101、CMV8.91和PMD.G按一定比例共转染293T细胞(图1A、1B),收集感染后24 h,48 h的上清,浓缩后感染293T细胞 (图1C),流式细胞仪计数GFP阳性细胞比例达 95% (图 1D),计算病毒滴度为1×107TU/mL (TU,Transduction unit)。

图1 慢病毒载体包装及滴度检测Fig.1 Package and titer detection of lentiviral vectors. (A)293T cells (Magnification, 100×). (B) Package of lentiviral vectors in 293T cells (20 h after lipofectin transfection,Magnification, 100×). (C) Detection of the lentiviral titer by infecting 293T cells with concentrated virus (Magnification,100×). (D) The percentage of GFP positive cells by flow cytometry. (E) Sketch map of lentiviral vectors encoding GFP.
2.3 成年食蟹猴MSCs感染猴泡沫病毒 (SFV)
研究报道3岁以上的非人灵长类 (NHPs) 感染猴泡沫病毒 (SFV) 比例高达100%[14]。与前人的报道一致[15],体外培养食蟹猴MSCs添加抗病毒药物Tenofovir,避免出现因 SFV感染引起的细胞融合(图2A)。而没有添加抗病毒药物Tenofovir,将出现大的融合细胞,细胞无法分裂增殖 (图2B)。RT-PCR确认出现融合细胞的MSCs感染SFV (图2C)。结果显示,随机选择的6只8~10岁健康成年食蟹猴均感染SFV,体外培养必须添加Tenofovir,否则不超过3代即出现大片融合细胞,无法继续传代培养 (图2D)。添加抗病毒药物能继续体外培养,且能维持MSCs正常的细胞形态和增殖分化能力[15]。
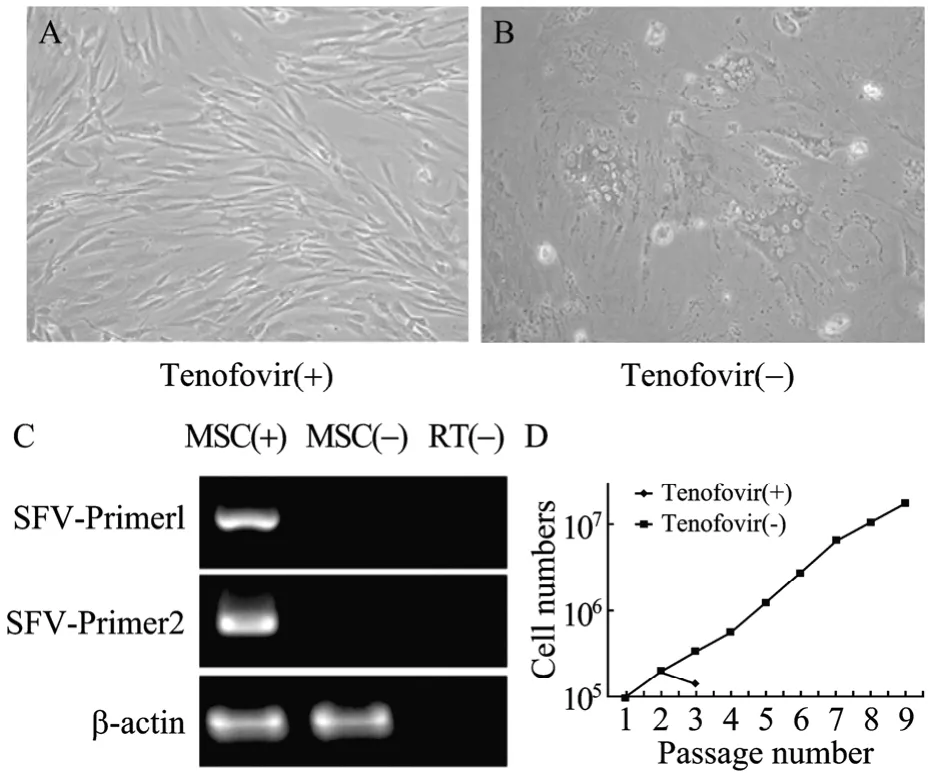
图2 成年食蟹猴MSCs感染SFVFig.2 SFV infection in cultured MSCs of adult cynomolgus monkey. (A) MSCs culture with Tenofovir (Magnification,200×). (B) The morphology of fusion cells were showed in MSCs culture without Tenofovir (Magnification, 200×). (C)RT-PCR reconfirmed MSCs infected with SFV. MSC (+) or (-)indicated the presence or absence of fusion cells in MSCs culture. (D) Adult cynomolgus monkey MSCs could be passaged for more than 10 with Tenofovir, and not more than passage 3 without Tenofovir.
2.4 成年食蟹猴MSC转染慢病毒
SFV阴性的食蟹猴MSCs作为对照,检测慢病毒感染食蟹猴MSCs效率。结果显示,慢病毒MOI值为5和10,食蟹猴MSCs感染效率可达到80%以上 (图3A)。在MOI值为10的条件下,随着感染时间延长,感染效率逐渐提高,20 h后到达平台水平,感染效率为85%左右 (图3B)。

图 3 不同拷贝数或感染时间条件下慢病毒感染 SFV阴性MSCs的效率Fig.3 Infection efficiency of SFV negative MSCs with lentiviral vectors at different MOI or infection times. (A) The percentage of GFP positive cells at different MOI (*P<0.05,
成年食蟹猴MSCs 均感染SFV,体外培养必须添加抗病毒药物Tenofovir (图4A、4F)。与SFV阴性MSCs感染效率比较 (图3和图4E、4J),SFV阳性MSCs由于感染SFV,以及培养添加的抗病毒药物 Tenofovir,明显降低慢病毒感染效率 (<10%)(图4G和图5)。因此,为了提高慢病毒的感染效率,在复苏成年食蟹猴 MSCs后停用抗病毒药物,分别于不同的时间点,感染慢病毒 (图 4H、4I和图5),随着停用时间的延长转染效率相应增加,停用 6 d后慢病毒转染效率可达到50% (图4I和图5)。但另一方面,由于成年食蟹猴MSCs感染SFV,随着停用抗病毒药物时间的延长,会出现融合细胞 (平均超过8 d后),MSCs将无法继续传代培养。

图4 停用抗病毒药物Tenofovir后不同时间点慢病毒载体的感染效率Fig.4 Infection efficiency of SFV positive MSCs without Tenofovir with lentiviral vectors at different time point after recovery by fluorescence microscope. (A) and (F) SFV positive MSCs with or without Tenofovir in culture (Magnification, 200×). (B) and (G)The very low infection efficiency of SFV positive MSCs with Tenofovir (Magnification, 400×). (C) and (H) The infection efficiency of SFV positive MSCs without Tenofovir at 2 days after the recovery was about 15% (Magnification, 200×). (D) and (I) The infection efficiency of SFV positive MSCs without Tenofovir at 6 days after the recovery was more than 50% (Magnification, 200×). (E) and(J) As a control, lentiviral vectors infected SFV negative MSCs, and the infection efficiency was about 85% (Magnification, 100×).
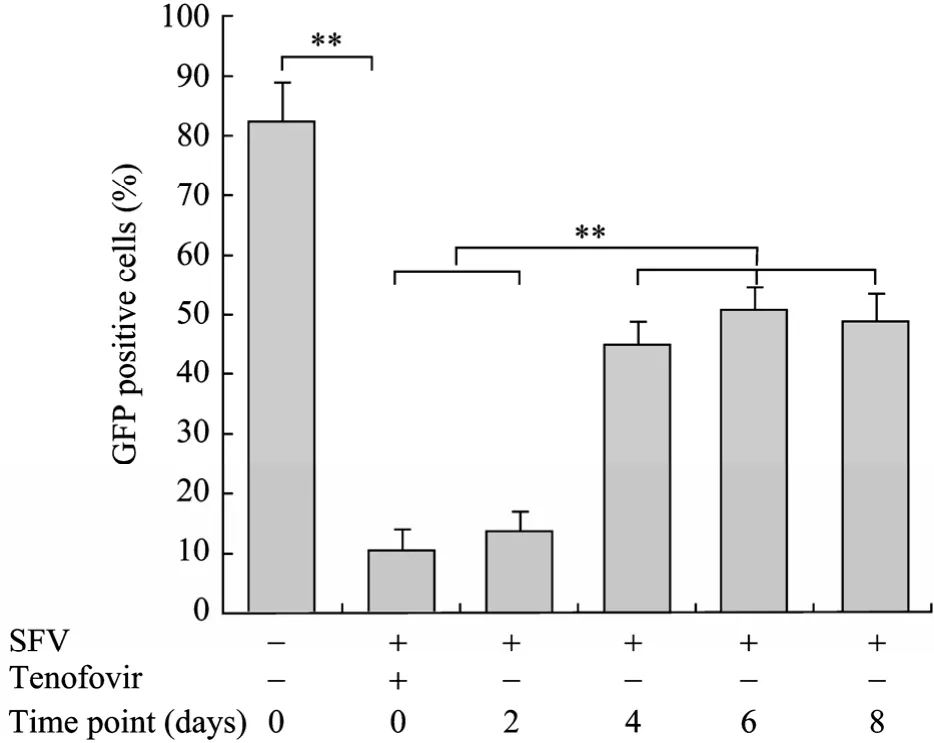
图5 流式细胞仪检测停用抗病毒药物Tenofovir不同时间点慢病毒载体的感染效率Fig.5 Infection efficiency of SFV positive MSCs without Tenofovir at different time point after the recovery of by flow cytometry (**P<0.01).
3 讨论
猴泡沫病毒 (SFV) 主要感染非人灵长类(NHPs),包括大猩猩、狒狒、猴等。SFV通过体液传播,能感染经常接触 NHPs的人群或其他物种。虽然研究显示捕获的或野外的 3岁以上的 NHPs感染SFV比例高达100%[14],但至今尚未发现SFV对NHPs有致病性。SFV物种间的传播会引起致病性的改变[18-19],但尚没有确切的证据表明人类感染 SFV而致病[20]。与之前的研究一致,本研究发现,体外培养8~10岁食蟹猴MSCs均感染SFV,体外培养扩增MSCs必须添加抗病毒药物。
慢病毒和 SFV均属于逆转录病毒科,为 RNA病毒[21-22],病毒基因均包括gag、pol和env 3个基本结构基因。目前,现有的慢病毒载体来源于多个物种,如HIV-1、2型和SIV等。对HIV来源的慢病毒载体构建研究最广泛和深入,它与一般的逆转录病毒载体不同的是,对分裂细胞和非分裂细胞均具有感染能力,可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达[23]。本研究发现,体外构建的GFP慢病毒载体,感染293T细胞和食蟹猴MSCs效率分别高达 95%和85%以上,并能在体外持续表达。
MSCs可以自体取材,体外扩增,可作为基因工程改造细胞,不存在免疫排斥,上述优点使MSCs成为各种疾病基因治疗中不可替代的重要载体[24-26]。研究显示,MSCs作为基因工程细胞,易于接受外援基因。对比各种基因转导 MSCs的方法,慢病毒具有最高的感染效率,并能稳定表达[27]。本研究发现,成年食蟹猴MSCs均感染SFV,体外培养MSCs必须添加抗病毒药物,但由于SFV感染和添加抗病毒药物的影响,慢病毒感染效率非常低下。因此,为了提高慢病毒的感染效率,复苏成年食蟹猴 MSCs后停用抗病毒药物,停药 6 d慢病毒转染效率可达到50%,大幅提高SFV阳性MSCs的感染效率。另一方面,停用抗病毒的时间不宜过长,超过8 d后,MSCs会出现因SFV感染而引起的融合细胞,MSCs将无法继续传代培养。本研究解决了因SFV感染而引起的食蟹猴 MSCs慢病毒感染效率低下的问题,为食蟹猴 MSCs作为基因工程载体细胞应用于实验和临床研究提供了技术保证。
REFERENCES
[1] Abdallah BM, Kassem M. Human mesenchymal stem cells: from basic biology to clinical applications.Gene Ther, 2008, 15(2): 109–116.
[2] Barry FP, Murphy JM. Mesenchymal stem cells: clinical applications and biological characterization.Int J Biochem Cell Biol, 2004, 36(4): 568–584.
[3] Agata H, Watanabe N, Ishii Y,et al. Feasibility and efficacy of bone tissue engineering using human bone marrow stromal cells cultivated in serum-free conditions.Biochem Biophys Res Commun, 2009, 382(2): 353–358.
[4] Porada CD, Zanjani ED, Almeida-Porad G. Adult mesenchymal stem cells: a pluripotent population with multiple applications.Curr Stem Cell Res Ther, 2006,1(3): 365–369.
[5] Krampera M, Pizzolo G, Aprili G,et al. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair.Bone, 2006, 39(4): 678–683.
[6] Bartholomew A, Patil S, Mackay A,et al. Baboon mesenchymal stem cells can be genetically modified to secrete human erythropoietinin vivo.Hum Gene Ther,2001, 12(12): 1527–1541.
[7] Chan J, O’Donoghue K, de la Fuente J,et al. Human fetal mesenchymal stem cells as vehicles for gene delivery.Stem Cells, 2005, 23(1): 93–102.
[8] Lee K, Majumdav MK, Buyaner D,et al. Human mesenchymal stem cells maintain transgene expression during expansion and differentiation.Mol Ther, 2001,3(6): 857–864.
[9] Zhang XY, La Russa VF, Bao L,et al. Lentiviral vectors for sustained transgene expression in human bone marrow-derived stromal cells.Mol Ther, 2002, 5(5Pt 1):555–565.
[10] Boffelli D, McAuliffe J, Ovcharenko D,et al.Phylogenetic shadowing of primate sequences to find functional regions of the human genome.Science, 2003,299(5611): 1391–1394.
[11] Dunbar CE. The use of nonhuman primate models to improve gene transfer into haematopoietic stem cells.J Intern Med, 2001, 249(4): 329–338.
[12] Izadpanah R, Joswig T, Tsien F,et al. Characterization of multipotent mesenchymal stem cells from the bone marrow of rhesus macaques.Stem Cells Dev, 2005, 14(4):440–451.
[13] Inaba M, Adachi Y, Hisha H,et al. Extensive studies on perfusion method plus intra-bone marrow-bone marrow transplantation using cynomolgus monkeys.Stem Cells,2007, 25(8): 2098–2103.
[14] Jones-Engel L, Steinkraus KA, Murray SM,et al.Sensitive assays for simian foamy viruses reveal a high prevalence of infection in commensal, free-ranging Asian monkeys.J Virol, 2007, 81(14): 7330–7337.
[15] Lee CC, Ye F, Tarantal AF. Comparison of growth and differentiation of fetal and adult rhesus monkey mesenchymal stem cells.Stem Cells Dev, 2006, 15(2):209–220.
[16] Jones-Engel L, Engel GA, Schillaci MA,et al. Primate-tohuman retroviral transmission in Asia.Emerg Infect Dis,2005, 11(7): 1028–1035.
[17] Jones-Engel L, May CC, Engel GA,et al. Diverse contexts of zoonotic transmission of simian foamy viruses in Asia.Emerg Infect Dis, 2008, 14(8): 1200–1208.
[18] Murray SM, Picker LJ, Axthelm MK,et al. Expanded tissue targets for foamy virus replication with simian immunodeficiency virus-Induced immunosuppression.J Virol, 2006, 80(2): 663–670.
[19] Cummins JE Jr, Boneva RS, Switzer WM,et al. Mucosal and systemic antibody responses in humans infected with Simian foamy virus.J Virol, 2005, 79(20): 13186–13189.
[20] Switzer WM, Bhullar V, Shanmugam V,et al. Frequent simian foamy virus infection in persons occupationally exposed to nonhuman primates.J Virol, 2004, 78(6):2780–2789.
[21] Neuman-Haefielin D. Foamy viruses.Intervirology, 1993,35: 196–207.
[22] Lai Z, Brady RO. Gene transfer into the central nervous systemin vivousing a recombinant lentivirus vector.JNeurosci Res, 2002, 67(3): 363–371.
[23] Chang LJ, Gay EE. The molecular genetics of lentiviral vectors--current and future perspectives.Curr Gene Ther,2001, 1(3): 237–251.
[24] Himes BT, Neuhuber B, Coleman C,et al. Recovery of function following grafting of human bone marrow-derived stromal cells into the injured spinal cord.Neurorehabil Neural Repair, 2006, 20(2): 278–296.
[25] Lee RH, Hsu SC, Munoz J,et al. A subset of human rapidly self-renewing marrow stromal cells preferentially engraft in mice.Blood, 2006, 107(5): 2153–2161.
[26] Gregory CA, Prockop DJ, Spees JL. Non-hematopoietic bone marrow stem cells: molecular control of expansion and differentiation.Exp Cell Res, 2005, 306(2): 330–335.
[27] McMahon JM, Conroy S, Lyons M,et al. Gene transfer into rat mesenchymal stem cells: a comparative study of viral and nonviral vectors.Stem Cells Dev, 2006, 15(1):87–96.
Improving infection efficiency of adult cynomolgus monkey mesenchymal stem cells with lentiviral vectors
Zhenhua Ren1,2, Shuyan Wang1, Ying Zhang1, Chunlin Zou1, and Y. Alex Zhang1
1Cell Therapy Center,Xuanwu Hospital,Capital Medical University,Beijing100053,China
2Department of Anatomy,Anhui Medical University,Hefei230032,China
Received:January 27, 2010;Accepted:March 26, 2010
Supported by:Scientific Project of Beijing Municipal Science & Technology Commission (No. D07050701350703).
Corresponding author:Y. Alex Zhang. Tel: +86-10-63184557; Fax: +86-10-83198889; E-mail: yaz@bjsap.org
北京市科委科技计划 (No. D07050701350703) 资助。
