抗重金属汞离子抗体的制备及鉴定
2010-10-11赵丽王凤龙杨慧李鹏刘满杏李霞
赵丽,王凤龙,杨慧,李鹏,刘满杏,李霞,3
1 内蒙古农业大学动物科学与医学学院,呼和浩特 010018
2 北京市农林科学院蔬菜研究中心,北京 100097
3 北京农产品质量检测与农田环境监测技术研究中心,北京 100097
动物及兽医生物技术
抗重金属汞离子抗体的制备及鉴定
赵丽1,2,王凤龙1,杨慧2,李鹏2,刘满杏2,李霞2,3
1 内蒙古农业大学动物科学与医学学院,呼和浩特 010018
2 北京市农林科学院蔬菜研究中心,北京 100097
3 北京农产品质量检测与农田环境监测技术研究中心,北京 100097
汞、镉、铅等重金属引起的环境污染已在世界范围内造成危害。快速、廉价地监测生境中重金属是减小其对人类及动物危害的先决条件。传统检测方法无法满足高通量的现场检测,建立更快速、更经济的免疫分析法检测汞离子是生产及经济发展的需要。本研究中,报道了汞特异性单克隆抗体的制备与筛选方法和结果。因 Hg2+太小以至于不能引起免疫反应,所以用螯合剂 (二乙烯三胺五乙酸,DTPA) 将金属离子与载体蛋白 (匙孔血蓝蛋白,KLH) 连接起来。成功合成、鉴定汞复合物抗原后,免疫 BALB/c小鼠,通过细胞融合获得了稳定分泌抗体的杂交瘤细胞。用极限稀释法亚克隆,通过ELISA筛选,获得了2株稳定分泌抗汞离子抗体的细胞株 (H2H5,H1H8)。小鼠腹腔注射1×107H2H5、H1H8细胞株制备腹水,腹水抗体效价都在1∶51 200以上。经鉴定两株杂交瘤均为IgG1亚类,轻链为kappa型且分泌抗体稳定性较好。实验结果为汞离子残留免疫学检测方法的建立提供了技术基础,对提高风险评估工作的效率和质量,保障食品安全有重要现实意义。
汞,螯合抗原,单克隆抗体,酶联免疫吸附法
Abstract:The environmental pollution by heavy metals such as mercury, cadmium and lead has become a worldwide public health hazard. To rapidly and inexpensively monitor environmental heavy metals is a prerequisite for minimizing human and animal exposure. The development of immunoassays to detect mercury ion residues has been a promising trend with the advantage of rapid and cheap operation. We reported the isolation and characterization of mercury-specific monoclonal antibodies. Because Hg2+ions are too small to elicit an immune response, the metal was coupled to protein carrier (keyhole limpet, KLH) using a chelator (diethylenetriamine pentaacetic acid, DTPA). After the synthesis of antigen and characterization,monoclonal antibodies against mercury ions were generated by immunizing BALB/c mice with mercury conjugated antigen(Hg-DTPA-KLH). The stable hybridoma cell lines were produced by fusion of murine splenocytes and SP2/0 myeloma cells.The hybridoma cells were subcloned by the limiting dilution and screened by ELISA, two hybridoma cell lines producing stably specific monoclonal antibodies (MAbs) against mercury ions were obtained, named H2H5 and H1H8. The ascites fluid was produced in BABL/c mice by intraperitoneal injection of 1×107H2H5 and H1H8 cells, respectively. The titers of ascites were all above 1:51 200. The isotyping of secrete antibodies from two hybridoma cell lines was IgG1,kappatype. These data laid a potency of establishing immunoassays methods of determining Hg2+ion residues and had the realistic significance for improving the efficiency and quality of risk assessment.
Keywords:mercury, chelated antigen, monoclonal antibody, ELISA
近年来,重金属污染事件层出不穷、愈演愈烈,人类赖以生存的空气、土壤、蔬菜和动物均受到了重金属等毒物的污染。环境污染和饲料药物添加剂的滥用,造成畜禽产品重金属残留不同程度超标[1]。作物中积累的重金属离子通过食物链的生物放大作用进入人畜体内,威胁人畜健康[2]。汞是蓄积作用较强的元素,主要在动物体内蓄积。湖泊、沼泽中的水生植物、水产品易蓄积大量的汞。上世纪50年代后期,农业上使用含汞杀螨剂以来,汞对土壤、自然水系和大气的污染日益严重。汞污染在世界的某些地区已成为大众健康的公害[3]。快速灵敏地检测食物中的重金属含量是保障食品安全的基础,传统检测重金属残留的分析方法包括原子吸收光谱分析(Atomic absorption spectroscopy,AAS) 和电感耦合等离子发射光谱 (Inductively coupled plasma atomic emission spectroscopy,ICP-AES) 等[4]是灵敏、可靠的,但昂贵的仪器、专业的分析人员及复杂的样品前处理限制了这些方法的应用。检测必须在具备大型分析仪器的重点实验室内进行,无法用于现场检测,而且受到费用高、处理量有限和检测时间长等限制[5]。传统的重金属检测方法不适合蔬菜、水果等保鲜期短、利润低和需大通量检测的样品。
国外对重金属免疫检测技术以重金属螯合物特异性单克隆抗体识别重金属或重金属螯合剂抗原为基础,建立快速检测方法已经有一定的研究成果[6]。本研究室利用单克隆抗体技术,研究和建立重金属的免疫学检测方法。并利用其快速、廉价、灵敏和特异性强的优点,将该方法发展成便于现场检测的便携方法,从而适用于农畜产品的抽样检测及进出口通关的快速检验[7]。对提高风险评估工作的效率和质量,保障食品安全有重要现实意义。本研究报告了金属汞离子螯合物的单克隆抗体的获得、鉴定方法和结果,为汞离子残留免疫学检测方法的建立打下了基础。
1 材料与方法
1.1 材料
1.1.1试剂
汞离子 (Hg2+)、匙孔血蓝蛋白 (KLH)、卵清蛋白 (OVA)、牛血清白蛋白 (BSA)、佐剂 (FCA、FICA)、聚乙二醇 (PEG)、8-氮鸟嘌呤 (8-AG) (美国Sigma 公司);螯合剂 DTPA (日本 DOJINDO);DMEM高糖基础培养基、台盼蓝 (北京索来宝科技有限公司);四甲基联苯胺 (TMB) (天根生化科技 (北京)有限公司);辣根过氧化物酶标记的羊抗小鼠 IgG(IgG-HRP)、辣根过氧化物酶标记的羊抗小鼠 IgM(IgM-HRP) (北京中杉金桥生物技术有限公司);抗体亚型鉴定试剂盒、Tween-20 (瑞士 Roche公司);HEPES (北京华美生物工程公司);胎牛血清 (FBS)(杭州四季青公司);BCA蛋白质浓度检测试剂盒 (美国Novagen公司)。
1.1.2实验动物
BALB/c小鼠 (雌性,6周龄),购于中国军事医学科学院实验动物中心。
1.1.3细胞
SP2/0小鼠骨髓瘤细胞,哈尔滨兽医研究所王雪峰赠送。
1.1.4仪器及其他
可调微量加样器 (法国Gilson公司);酶联免疫分析仪 (美国 Bio-Rad公司);全自动洗板机 (美国AWARENESS Technology公司);磁力搅拌器 (北京金辉盛业科技有限公司);纯水系统、CentriconYM-30超滤管 (美国Millipore公司);聚苯乙烯酶联反应板、24孔、96孔细胞培养板、细胞培养瓶 (美国Corning/Costar公司)。
1.2 方法
1.2.1抗原的制备与鉴定
Hg-DTPA-KLH:取5.65 mg DTPA加入1 mL HEPES缓冲液 (pH 9.73) 中形成A液,转入反应器,再加入浓度为3.46 mol/L的Hg(NO3)210 µL,室温下反应 30 min后同时加入 0.4 mL HEPES缓冲液(pH 9.73) 和1.7 mL浓度为5.9 g/L的KLH,调节pH至9.0,室温下搅拌反应12 h。偶联反应后,用预处理的CentriconYM-30超滤管对蛋白质复合物进行分离纯化,除去没有参与反应的 Hg2+、螯合剂DTPA和Hg-DTPA复合物。
Hg-DTPA-OVA的合成方法同上,DTPA-OVA的合成方法同上用超纯水代替金属离子即可。超滤后用BCA试剂盒测定复合物蛋白浓度[8]。参照国标GB/T 17141-1997,用石墨炉原子吸收光谱法检测超滤后的上清、滤过液及HEPES液中Hg2+浓度[9]。
1.2.2小鼠的免疫及融合小鼠的选择
小鼠的免疫:首免时,免疫抗原与等体积的弗氏完全佐剂充分混匀后乳化1~2 h[10],每只BABL/c小鼠皮下多点注射200 µg抗原。3周后第2次免疫,相同剂量抗原与等体积的弗氏不完全佐剂充分乳化后免疫,以后每隔2周免疫1次,方法同第2次免疫。第3次免疫及以后每次免疫后7 d,尾静脉采血,分离血清,测定血清的效价和产生抗体的特异性。
融合小鼠的选择:用间接ELISA法选择融合小鼠,方法如下:1) 包被:用HBS (10 mmol/L,pH 7.4)稀释Hg- DTPA-OVA和DTPA-OVA,并以相同的浓度 5 mg/L分别包被到96孔酶标板上,50 µL/孔,4℃过夜或37℃孵化2 h;2) 封闭:PBST洗涤5次,拍干,按 100 µL/孔加入 3% BSA,37℃封闭 1 h;3) 一抗:洗涤同上,加入相同的待检血清,以未免疫小鼠的血清作阴性对照,50 µL/孔,37℃孵化1 h;4) 酶标二抗:洗涤同上,辣根过氧化物酶标记的羊抗鼠 IgG/IgM (混合物) 1∶5 000 稀释后,50 µL/孔,37℃孵育1 h;5) 显色:洗涤同上,加入显色液TMB,50 µL/孔,37℃孵育 15 min;6) 终止反应:按50 µL/孔加1 mol/L盐酸终止反应;7) 酶标仪上测OD450值,以空白孔调零。按公式计算差异率Differnce%= (OD450of Hg-DTPA-OVA−OD450of DTPA-OVA)/OD450of DTPA-OVA×100%。
1.2.3细胞融合
融合前3 d加强免疫小鼠。融合前1 d制备饲养细胞,将细胞浓度调至1×105/mL,按0.1 mL/孔加到96孔细胞培养板内,备用。取小鼠脾脏及处于对数生长期的SP2/0骨髓瘤细胞株以6∶1数量比混合,用 50% PEG介导融合,将融合后的细胞加入到含饲养细胞的培养板中,0.1 mL/孔,37℃、5%CO2培养箱培养[11]。
1.2.4阳性融合孔的筛选及阳性融合细胞的克隆
待细胞长满孔底的 1/3后,检测融合孔上清,方法同1.2.2中融合小鼠的选择,一抗是细胞上清,用未融合孔作阴性对照。用极限稀释法克隆阳性细胞,细胞上清的检测方法同阳性融合孔的筛选。
1.2.5杂交瘤染色体核型的鉴定[12]
取对数生长期杂交瘤细胞株H1H8和H2H5,用终浓度为0.05~0.1 mg/L的秋水仙素处理4~6 h,收集细胞后用低渗KCl溶液处理30 min,固定液固定,滴加细胞悬液到4℃预冷的载玻片上,室温自然干燥,Giemsa染色,经光学显微镜观察,挑选细胞形态完整染色体分散均匀的细胞计数。每株计数 5个细胞,记录染色体数目并算出平均值。
1.2.6腹水型单克隆抗体的制备
取8~10周龄的雌性BABL/c小鼠,腹腔注射石蜡油 (0.5 mL/只),1~2周后分别腹腔注射1×106个杂交瘤H2H5和HIH8,接种细胞7~10 d后密切观察动物的健康状况与腹水征象,抽取腹水。室温放置30 min后,4℃放置1.5~2 h后,12 000 r/min离心2 min,取上清−20℃保存备检。梯度稀释腹水型抗体后检测小鼠腹水效价,检测方法同1.2.2中融合小鼠的选择,一抗是稀释后的腹水。
1.2.7抗汞离子抗体亚型的鉴定
取出正在培养的杂交瘤 H2H5和 HIH8细胞上清,按 1∶50稀释后,按照鼠单抗亚型鉴定试剂盒ISOStripTM Monoclonal Antibody Isotyping Kit说明书操作,取稀释液0.15 mL加入试剂盒小管中,室温放置1 min。待其自然溶解后,轻轻混匀。然后将试剂条插到小管底部,大约5 min后,当最前端条带在两对“+”中间出现时,即可见与杂交瘤细胞株所分泌的抗体亚类和轻链类型对应的指示条带所在位置,从而确定抗体亚型。
1.2.8杂交瘤分泌抗体稳定性的测定
将杂交瘤细胞株冻存后,过一段时间再复苏并且连续培养后测抗体效价。检测方法同阳性融合孔的筛选,用 Hg-DTPA-OVA包被酶标板,二抗用辣根过氧化物酶标记的羊抗小鼠IgG。
2 结果
2.1 抗原的制备与鉴定
超滤后用BCA试剂盒测定蛋白浓度,绘制标准曲线后,据公式y=0.0008x+0.0065(R2=0.9995) (y表示OD570,x表示蛋白浓度 (mg/L)) 计算出上清中完全抗原Hg-DTPA-KLH蛋白浓度为4.615 g/L,滤过液中蛋白浓度为0.01 g/L。
用石墨炉原子吸收光谱法检测 Hg2+结果:Hg-DTPA-KLH、DTPA-KLH、HEPES溶液中汞离子的浓度分别为208 mg/kg、0 mg/kg、0 mg/kg。如果抗原未合成成功,游离的 Hg2+或 Hg-DTPA会随着超滤而被过滤掉,超滤后的上清中不会含有Hg2+,而我们从超滤后的上清中检测出了 Hg2+且含量较高,证明抗原合成成功。
2.2 融合小鼠的选择
五免后检测小鼠血清中抗体效价后,计算各小鼠的差异率的结果显示 1号小鼠差异率最高。几只小鼠同时产生了抗DTPA和Hg-DTPA的抗体,但是1号小鼠抗 Hg-DTPA的抗体水平最高且差异率最大,说明1号小鼠产生针对Hg2+的抗体特异性最强,所以选1号小鼠用于融合 (图1)。
2.3 细胞融合及阳性融合孔的筛选
10 d后96孔细胞培养板中长出肉眼可见的杂交瘤细胞团,待细胞长满孔底的 1/3时取细胞上清检测抗体效价,结果显示杂交瘤H2H5、3D12、H1H8、2A11抗体效价都大于阴性对照的2.1倍,判定为阳性杂交瘤,且H2H5、H1H8的差异率比2A11、3D12的差异率大,4株细胞上清与 Hg-DTPA-OVA反应OD450值均高于与 DTPA-OVA反应OD450值,其中H1H8、H2H5差异较大 (图2),说明这 2株细胞分泌的抗体针对 Hg2+离子的特异性较强,选 H1H8、H2H5进行亚克隆。
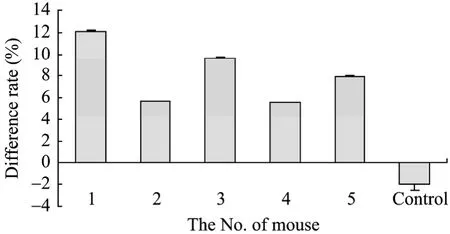
图1 小鼠五免后的差异率Fig.1 Difference rate of the fifth immunized mice.

图2 阳性杂交瘤细胞的筛选Fig.2 Selection of the positive hybridomas.
2.4 阳性融合细胞的亚克隆化
H1H8和H2H5经过2次亚克隆化后分泌的抗体效价有所升高,成功获得稳定的分泌抗Hg2+单克隆抗体的细胞株,还可以看出 H2H5分泌的抗体对金属Hg2+的特异性较H1H8的强 (图3)。

图3 H1H8和H2H5第二次克隆后细胞上清抗体效价Fig.3 Supernatant titer of hybridoma H1H8 and H2H5 after the second cloning.
2.5 杂交瘤细胞染色体核型分析
SP2/0细胞的染色体数目平均为68条,脾细胞染色体数目平均为40条,而杂交瘤细胞的染色体数目均在100以上,高于2个亲本细胞的染色体数目,说明这2株杂交瘤细胞是 SP2/0细胞和脾细胞的杂交产物。
2.6 腹水型单克隆抗体的制备
取得细胞株 H1H8和 H2H5腹水型抗体后检测得出H1H8小鼠腹水效价可达1∶51 200,而 H2H5的效价大于1∶51 200 (图4)。
2.7 抗汞离子抗体Ig类和亚类的鉴定
当最前端条带出现在两对“+”中间时,抗体亚类和轻链指示条带分别在 G1、k位置,即细胞株HIH8和H2H5所分泌的抗体均为IgG1亚类,轻链为kappa型 (图 5)。
2.8 杂交瘤分泌抗体稳定性的测定

图4 H1H8和H2H5腹水型单克隆抗体的检测Fig.4 Titer of ascites of H1H8 and H2H5.
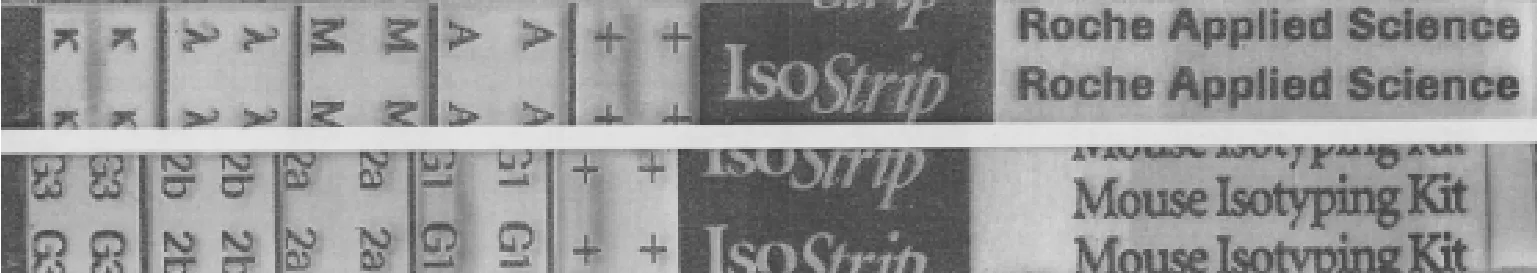
图5 H1H8和和H2H5分泌抗体亚型Fig.5 Isotyping of H1H8 and H2H5 secrete antibody.

图6 H1H8和H2H5分泌抗体的稳定性Fig.6 Stability of H1H8 and H2H5 secrete antibody.
经检测显示细胞株 H2H5和 H1H8分泌抗金属Hg2+单克隆抗体的水平未见明显下降 (图6),表明抗体的稳定性较好,同时可证明亚克隆较成功。效价稍有波动,可能是由于取细胞上清备检时间间隔不同以及每次检测之间的误差所致,属正常。
3 讨论
对重金属的常规性检测方法已经有很多种,有些也已经是非常成熟的技术,但因为重金属离子存在的范围很广,根据检测精度、方便程度和检测成本,每种技术都有其局限性,同时还需合适的场所,因此都不利于在生产中推广应用。本研究所用的免疫学检测技术具有检测速度快、费用低廉、仪器简单易携、灵敏度高和选择性强等优点,可用于现场对重金属进行灵敏、准确、实时、快速的检验分析。免疫分析技术引起人们越来越多的关注,这也是免疫分析技术发展的必然趋势,也是成本低工业化生产所要求的。
由于 Hg2+能与动物体内生物分子发生强烈的不可逆的反应,导致动物中毒,因此,可利用特异性的双功能螯合剂DTPA螯合Hg2+,形成能被动物免疫系统识别的螯合物,但这些重金属复合物是分子量低于1 kDa的半抗原,免疫原性低,不足以引起免疫反应[13]。DTPA除了能螯合金属离子之外,还能与载体蛋白偶联,可以成功制备重金属汞的包被抗原和免疫抗原[14-15]。有多种蛋白质如KLH、BSA、OVA等能作为载体蛋白,但从诱发免疫应答的角度来看,KLH的免疫原性优于 BSA、OVA等,因此本研究用 KLH作为载体蛋白来免疫小鼠以期产生更强的免疫应答。
重金属 Hg2+单克隆抗体制备的关键在于重金属免疫原的制备,所以对免疫原鉴定后再免疫小鼠是成功得到重金属单克隆抗体的保证。本研究先用BCA法测定了超滤后上清中的重金属复合物蛋白浓度,然后用石墨炉原子吸收光谱法检测其中的Hg2+含量,这为之后重金属Hg2+的单克隆抗体的成功制备提供了可靠的保证。
本研究根据差异率筛选融合所用小鼠,差异率越大说明产生针对Hg2+的抗体特异性越强,融合筛选得到阳性杂交瘤细胞的几率就越大。
本研究成功获得了抗重金属 Hg2+或 Hg-DTPA的单克隆抗体,目前正在纯化抗体并对抗体的各项性能进行鉴定。该工作的完成为其他抗重金属抗体的制备提供了可行的方法,也为重金属免疫检测方法的建立及应用 (如ELISA方法、免疫胶体金快速诊断法[16]等) 奠定了基础。
REFERENCES
[1] Pang RY. Livestock and poultry products quality safety problems and countermeasures in China.J Heilj Grain,2007(4): 20−22.
逄瑞玥. 我国畜禽产品质量安全存在的问题及应对策略. 黑龙江粮食, 2007(4): 20−22.
[2] Lang ML, Zhang YX, Chai TY. Advances in the research of genetic engineering of heavy metal resistance and accumulation in plants.Chin J Biotech, 2004, 20(2):157−164.
郎明林, 张玉秀, 柴团耀. 基因工程改良植物重金属抗性与富集能力的研究进展. 生物工程学报, 2004, 20(2):157−164.
[3] Mei GQ. Harmfulness and treatment of heavy metal waste water.Stud Trace Elem Health, 2004, 21(4): 54−56.
梅光泉. 重金属废水的危害及治理. 微量元素与健康研究, 2004, 21(4): 54−56.
[4] Bontidean I, Lloyd JR, Hobman JL,et al. Bacterial metal-resistance proteins and their use in biosensors for the detection of bioavailable heavy metals. J Inorg Biochemy, 2000, 79(1/4): 225−229.
[5] Liu GL, Wang JF , Li ZY,et al. Advances in heavy metal ions immunoassay.Chin J Biotech, 2006, 22(6): 877−881.
刘功良, 王菊芳, 李志勇, 等. 重金属离子的免疫检测研究进展. 生物工程学报, 2006, 22(6): 877−881.
[6] Blake DA, Jones RM, BlakeⅡ RC. Antibody -based sensors for heavy metal ions.Biosens Bioelectron, 2001,16(9-12): 799−809.
[7] Blake RC, Delehanty JB, Khosraviani M. Allosteric binding properties of a monoclonal antibody and its fab fragment.Biochemistry, 2003, 42(2): 497−508.
[8] Robert C, Blake II, Andrey R,et al. Novel monoclonal antibodies with specificity for chelated uranium(VI):isolation and binding properties.Bioconjugate Chem,2004, 15(5): 1125−1136.
[9] Khosraviani M, Pavlov AR, Flowers GC,et al. Detection of heavy metals by immunoassay: optimization and validation of a rapid, portable assay for ionic cadmium.Environ Sci Technol, 1998, 32(1): 137−142.
[10] Palmarini M, Murgia C, Fan H. Spliced and prematurely polyadenylated Jaagsiekte sheep retrovirus(JSRV)-specific RNAs from infected or transfected cells.Virology, 2002,294(1): 180−188.
[11] Li FK, Wang CY. Experimental Animals and Animal Experiments Methodology. Zhengzhou: Zhengzhou University Press, 2007: 377.
李凤奎, 王纯耀主编. 实验动物与动物实验方法学. 郑州: 郑州大学出版社, 2007: 377.
[12] Situ ZQ. Cell Culture. Xi′an: World Books Publishing House, 2007: 242.
司徒镇强主编. 细胞培养. 西安: 世界图书出版社,2007: 242.
[13] Yu HN, Jones RM, Blake DA. An immunosensor for autonomous in-line detection of heavy metals: validation.Int J Environ Anal Chem, 2005, 85(12/13): 817−830.
[14] Darwish IA, Blake DA. One-step competitive immunoassay for cadmium ions: development and validation for enviromental water samples.Anal Chem,2001, 73(8): 1889−1895.
[15] Darwish IA, Blake DA. Development and validation of a one-step immunoassay for determination of cadmium in human serum.Anal Chem, 2002, 74(1): 52−58.
[16] Chen FM, Li J, Qu YJ,et al. Application and research progress of the immune colloidal gold technique.Chin J Veter Drug, 2004, 38(8): 33−35.
陈凤梅, 李娟, 曲原君, 等. 免疫胶体金的研究进展及应用. 中国兽药杂志, 2004, 38(8): 33−35.
Preparation and characterization of specific monoclonal antibodies against mercury ions
Li Zhao1,2, Fenglong Wang1, Hui Yang2, Peng Li2, Manxing Liu2, and Xia Li2,3
1College of Animal Science and Medicine, Inner Mongolia Agricultural University,Hohhot010018,China
2Vegetable Research Center of Beijing Academy of Agriculture and Forestry Sciences,Beijing100097,China
3Beijing Research Center for Agri-food Testing and Farmland Monitoring,Beijing100097,China
Received:December 29, 2009;Accepted:April 7, 2010
Supported by:National High Technology Research and Development Program of China (863 Program) (No. 2007AA10Z439), National Natural Science Foundation of China (No. 30671205), Project of Beijing Municipal Science & Technology Commission (No. Z09090501040901).
Corresponding author:Xia Li. Tel: +86-10-51503069; E-mail: lixia@nercv.org
国家高技术研究发展计划 (863计划) (No. 2007AA10Z439),国家自然科学基金 (No. 30671205),北京市科委课题 (No. Z09090501040901)资助。
