利用基因工程改良植物脂肪酸和提高植物含油量的研究进展
2010-10-11夏晗王兴军李孟军肖寒
夏晗,王兴军,李孟军,肖寒
山东省农业科学院高新技术研究中心 农业部黄淮海作物遗传改良与生物技术重点开放实验室 山东省作物与畜禽品种改良生物技术重点实验室,济南 250100
综 述
利用基因工程改良植物脂肪酸和提高植物含油量的研究进展
夏晗,王兴军,李孟军,肖寒
山东省农业科学院高新技术研究中心 农业部黄淮海作物遗传改良与生物技术重点开放实验室 山东省作物与畜禽品种改良生物技术重点实验室,济南 250100
植物脂肪酸和三酰甘油具有重要生理功能以及巨大的食用和工业价值,其生物合成途径较为复杂。近年来,植物脂肪酸和三酰甘油合成代谢途径的研究取得了很大进展,在多种植物中克隆了脂肪酸和三酰甘油合成代谢途径中的关键酶基因,同时发现一些转录因子在调控植物脂肪酸含量和组成中具有重要作用,并在此基础上开展了利用基因工程改良植物脂肪酸和提高植物含油量的研究,取得了一定的进展。以下系统介绍了植物脂肪酸和三酰甘油合成代谢途径中的关键酶基因以及在调控植物脂肪酸含量和组成中具有重要作用的转录因子,综述了基因工程研究所取得的成果,并对其应用前景进行了展望。
植物,脂肪酸,三酰甘油,含油量,转录因子
Abstract:This article reviewed key genes that involved in fatty acid synthesis and triacylglycerol assembly pathway. The transcription factors which play important roles in seed development and oil content were also reviewed. We summarized the achievement in modifying fatty acid composition and increase oil content in plant by gene engineering using these genes.
Keywords:plant, fatty acid, triacylglycerol, oil content, transcription factor
植物体的脂肪代谢是维系其生命活动的基本代谢之一,也为人类提供了重要的能量来源。随着生活水平的日益提高,人们对植物脂肪酸的组成和含量也有了新的、更高的要求。培育含油量更高、各种脂肪酸比例更健康的油料作物新品种是作物育种的任务之一。随着分子生物学与基因工程的飞速发展,大量植物功能基因的分离克隆、表达调控方式和分子机制的阐明,从分子水平上对油料作物进行有目的、有针对性的品质改良已成为传统育种方法的重要补充,并发挥着越来越重要的作用。脂肪酸生物合成途径及其调控的研究不仅具有重要的理论意义,还有广泛的应用前景,如利用基因工程生产有用脂肪酸、改善油和脂肪的品质、增加机体的抗逆性等。以下详细综述了植物脂肪酸和三酰甘油代谢途径上的关键基因、种子油脂积累关键调控因子的研究进展,展望了这些研究的应用前景,以期更好地利用基因工程改造植物自身的脂肪代谢过程,创造优良的油料作物种质。
1 植物脂肪酸和甘油三酯的代谢途径
植物脂类代谢途径非常复杂,其复杂性主要在于代谢途径的细胞区室化以及区室间这些脂库的广泛混合。目前对植物脂肪酸生物合成的主要代谢反应及其相关酶系已有较完整的了解 (图1)。
1.1 植物饱和脂肪酸合成途径和基因工程
脂肪酸合成的前体为乙酰-CoA。它首先在乙酰-CoA羧化酶的作用下合成丙二酰-CoA。然后脂肪酸合成酶以丙二酰-CoA为底物进行连续的聚合反应,以每次循环增加 2个碳的方式合成酰基碳链,进一步合成16至18碳的饱和脂肪酸。高等植物中脂肪酸的生物合成发生在质体中,参与脂肪酸合成的酶主要为乙酰辅酶A羧化酶 (Acetyl-CoA carboxylase,ACCase) 和脂肪酸合酶复合体(Fatty acid synthase complex,FAS)。
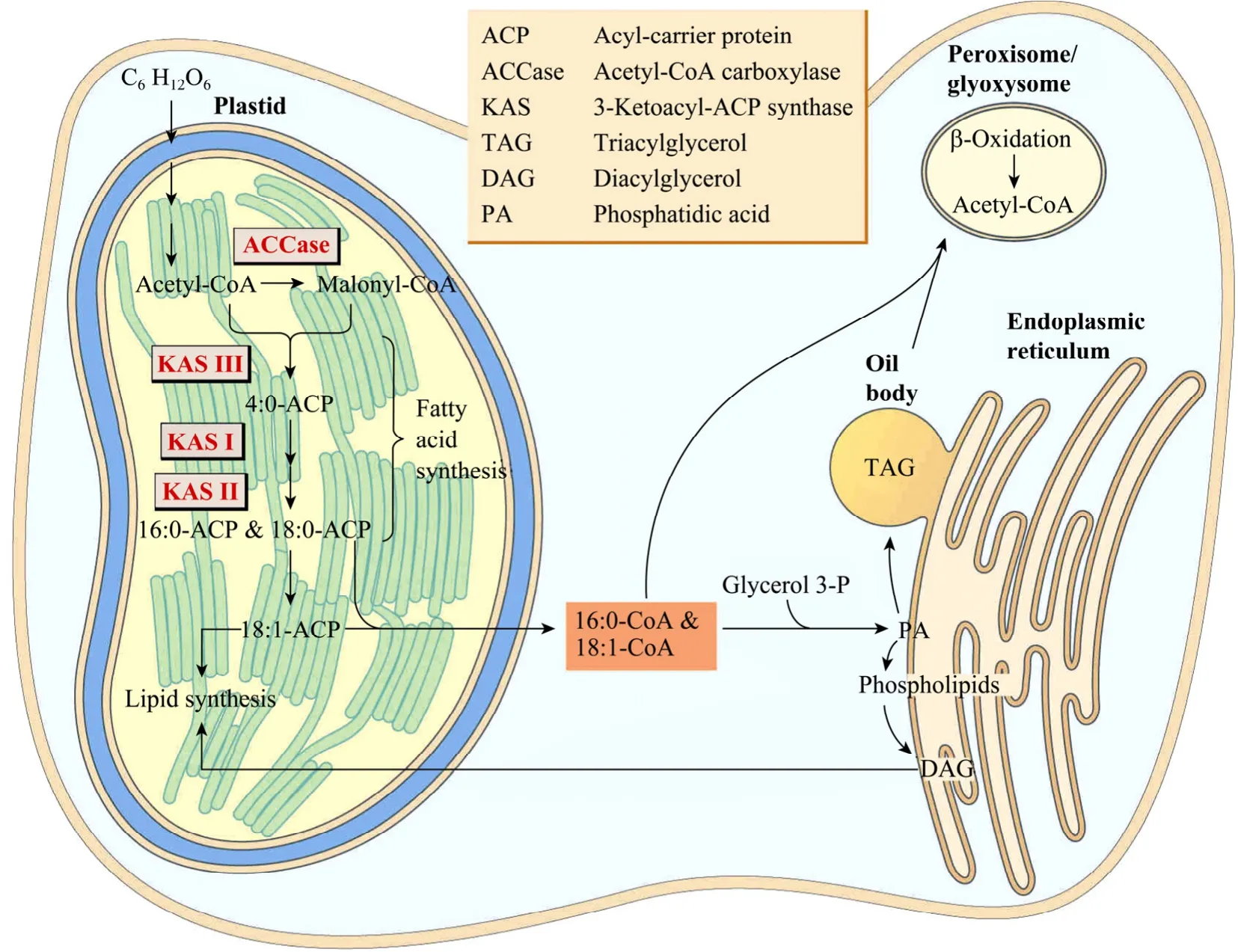
图1 植物细胞内脂肪酸和甘油三酯合成示意图[1]Fig.1 Pathway of fatty acid and triacylglycerol biosynthesis in plants[1].
1.1.1乙酰辅酶A羧化酶
乙酰-CoA羧化酶是脂肪酸生物合成的关键酶之一。它催化依赖ATP的羧化反应,即催化乙酰辅酶A生成丙二酸单酰辅酶A,该步骤是从头合成脂肪酸的第一步反应[2]。在高等植物中存在 2种结构显著不同的乙酰辅酶A羧化酶,即多亚基乙酰辅酶A羧化酶 (Multi-subunit ACCase,MS-ACCase) 和多功能域乙酰辅酶 A 羧化酶 (Multifunctional ACCase,MF-ACCase)[3]。
多亚基乙酰辅酶A羧化酶是一个复合体,由生物素羧基载体蛋白 (Biotin carboxyl carrier protein,BCCP)、生物素羧化酶 (Biotin carboxylase,BC) 和羧基转移酶 (Carboxyltransferase,CT) α和β亚基组成[3]。其中生物素羧基载体蛋白、生物素羧化酶和羧基转移酶α-亚基由核基因编码,而羧基转移酶β-亚基由叶绿体基因组编码[4]。多功能域乙酰辅酶 A羧化酶是一个具有生物素羧基载体蛋白、生物素羧化酶和羧基转移酶 3个结构域的多功能肽链,分子量高于200 kDa[5]。
两种乙酰辅酶A羧化酶在细胞中的定位不同,如玉米、小麦、水稻等禾本科植物的质体和胞质中均为多功能域乙酰辅酶A羧化酶[6-8]。除禾本科植物以外,绝大多数植物具有这2种类型乙酰辅酶A羧化酶,其中多亚基乙酰辅酶A羧化酶定位于质体中,而多功能域乙酰辅酶A羧化酶定位于胞质中,如大豆[9]、烟草[3]、马铃薯[10]、花生[11]等。而在油菜[2]和拟南芥[12]的质体中可能同时含有多亚基乙酰辅酶A羧化酶和多功能域乙酰辅酶A羧化酶。
乙酰辅酶A在细胞内不同区域的羧化反应导致物理隔离的丙二酸单酰辅酶A池。质体中丙二酸单酰辅酶 A池是从头合成脂肪酸反应中产生 C16和C18脂肪酸的前体。胞质丙二酸单酰辅酶A池用于产生C20以上的脂肪酸。除此以外,胞质丙二酸单酰辅酶A还是产生黄酮类化合物、茋类化合物、丙二酸以及丙二酸单酰衍生物[13]的前体。植物ACCase受光和脂酰-CoA调节。光可能通过改变基质 pH、ATP、ADP和镁离子等参数来调节酶活,增加叶片脂类形成[14],从而影响脂肪酸合成[15]。
将叶绿体转运肽与拟南芥的多功能域ACCase基因融合,以种子特异性启动子驱动在油菜种子中过量表达,能使 ACCase活性提高 10~20倍,油菜种子含油量提高了5%,超长链脂肪酸含量增加[16]。有研究表明,将羧基转移酶 β亚基 (accD) 在各种组织的质体中过量表达导致转基因植株叶子中脂肪酸含量增加,植株的叶片明显增长,虽然转基因后代种子中的脂肪酸含量与野生型没有显著变化,但种子产量提高了近 2倍,从而提高了单株种子的产油量[17]。
1.1.2脂肪酸合成酶
生物界中存在 2种类型的脂肪酸合成酶 (Fatty acid synthase,FAS) 催化脂肪酸合成。I型脂肪酸合成酶(Type I FAS) 在1条或2条多亚基肽链上含有全部活性位点,主要存在于脊椎动物、酵母和一些细菌中。II型脂肪酸合成酶 (Type II FAS) 的活性位点分布在不同基因产物上,主要存在于多数细菌、植物质体和线粒体中。
植物质体型FAS为II型脂肪酸合成酶复合体,由酰基载体蛋白 (ACP)、丙二酸单酰 CoA-ACP转移酶(MCAT)、β-酮脂酰-ACP 合酶 (KASI、KASII、KASⅢ)、β-酮脂酰-ACP还原酶 (KR)、β-羟脂酰-ACP脱水酶 (HD) 和烯脂酰-ACP还原酶 (ER) 等部分构成。酰基载体蛋白 (ACP) 携带着结合于 4′-磷酸泛酰巯基乙胺辅基上的不断伸长的酰基链在II型脂肪酸合成酶复合体的2个单体之间穿梭[18]。
乙酰辅酶A羧化酶和MCAT催化形成malonyl-ACP。β-酮脂酰-ACP合酶家族成员催化 malonyl-ACP和acyl-ACP缩合形成β-酮脂酰-ACP。KR催化β-酮脂酰-ACP还原为 β-羟脂酰-ACP是脂肪酸合成中的第一个还原步骤。HD催化β-羟脂酰-ACP脱氢形成trans-2-acyl-ACP。脂肪酸合成每一循环的还原步骤由 ER催化,脂酰-ACP 硫酯酶 (Acyl-ACP thioesterase) 能够催化FAS循环的终止。
有关植物质体type II FAS大部分基因工程改良工作集中在酰基载体蛋白和β-酮脂酰-ACP合酶上。植物酰基载体蛋白由多基因家族编码,在植物中组成型表达[19]或组织特异性表达[20]。在芥菜型油菜Brassica juncea中表达巴西固氮螺菌Azospirillum brasilense的酰基载体蛋白,提高了叶片中C18:3的含量和种子中脂肪酸 C18:1和 C18:2的含量,并提高了种子中不饱和脂肪酸(C18:1)/饱和脂肪酸以及亚油酸(C18:2)/亚麻酸(C18:3)的比值,降低了芥酸(Erucic acid,C22:1) 的含量[21]。
KAS Ⅲ催化 acetyl-CoA和 malonyl-ACP形成4:0-ACP,KAS I催化4:0-ACP延长形成16:0-ACP,KAS II催化16:0-ACP延长形成18:0-ACP。KAS II和 KAS III表达水平的改变可以引起植物种子含油量和脂肪酸组成的改变。Dehesh等[22]在油菜中过量表达萼距花Cuphea hookerianaWalp.的KAS Ⅲ基因,提高了油菜种子中16:0软脂酸的含量,同时伴随着脂肪合成速率和种子含油量的降低,这暗示着植物体内KAS Ⅲ活性的提高导致FAS复合体活性的变化。利用RNAi技术降低拟南芥中KAS II的表达可以显著提高16:0软脂酸含量,转基因后代在胚胎发育早期有致死现象,成活的植株种子中软脂酸含量可达到53%[23]。
不同的脂酰-ACP硫酯酶对脂酰链长度具有选择偏好,月桂树和椰子中的硫酯酶对12:0-ACP具有偏好,因此,通过基因工程的方法可以在植物中富集具有重要工业价值的中链脂肪酸。将月桂树和椰子中的硫酯酶基因转入油菜,转基因油菜籽中月桂酸含量达到40%[24]。
1.2 不饱和脂肪酸的合成途径和基因工程
植物体内饱和脂肪酸可在去饱和酶的作用下形成不饱和脂肪酸,包括棕榈油酸和油酸等单不饱和脂肪酸及亚油酸和亚麻酸等长链多聚不饱和脂肪酸。
1.2.1脂肪酸去饱和酶
棕榈油酸和油酸分别由软脂酸和硬脂酸在 ∆9-脂肪酸去饱和酶的催化下在碳链的第9和第10位碳之间引入双键而形成。单不饱和脂肪酸可进一步形成多不饱和脂肪酸,如油酸在∆12脂肪酸去饱和酶的催化下形成亚油酸,亚油酸在ω3 ∆15-和 (或) ω6∆6-脂肪酸去饱和酶的催化下可分别形成 α-亚麻酸和(或)γ-亚麻酸 (图2)。植物脂肪酸去饱和酶可分为脂酰-ACP去饱和酶 (Acyl-ACP desaturase) 和脂酰-脂去饱和酶 (Acyl-lipid desaturase) 两类。脂酰-ACP去饱和酶存在于植物细胞质体的基质中,以脂酰-ACP为底物催化饱和脂肪酸形成单不饱和脂肪酸。脂酰-脂去饱和酶存在于植物细胞的内质网和叶绿体膜上,以甘油酯中酯化的脂肪酸为底物进行去饱和反应。

图2 脂肪酸去饱和过程示意图[25]Fig.2 Pathway of fatty acid desaturation[25].
1.2.2脂肪酸去饱和酶的基因工程
∆9-硬脂酸去饱和酶和 ∆12-油酸去饱和酶是脂肪酸去饱和途径的关键酶。∆9-硬脂酰 ACP去饱和酶催化18碳的硬脂酸转变为油酸,反义抑制油菜中硬脂酸-ACP去饱和酶基因,不同转基因株系种子中硬脂酸含量从2%到40%之间不等[26]。抑制油菜中的∆12-油酸去饱和酶基因可将油菜中油酸的含量提高到89%[27]。利用RNAi的方法抑制棉花中的∆9-硬脂酰ACP去饱和酶,可使棉籽中硬脂酸含量从2%~3%提高到40%;抑制ω6途径上的∆12去饱和酶,将油酸含量从对照的15%提高到77%;同时,软脂酸含量在高硬脂酸和高油酸转基因株系中明显降低[28]。同样,抑制大豆中∆12-油酸去饱和酶,使大豆油酸含量从不到10%提高到86%[29]。
调节 γ-亚麻酸的组成也是脂肪酸基因工程的重要目标,∆6-脂肪酸去饱和酶在其中起到关键作用。在烟草中过量表达蓝藻的 ∆6-脂肪酸去饱和酶可导致γ-亚麻酸的积累。玻璃苣Borago officinalisL. ∆6-脂肪酸去饱和酶在烟草中表达,转基因烟草叶中 γ-亚麻酸含量达到总脂肪酸含量的3.2%[30]。
ω-3系列多不饱和脂肪酸主要包括 α-亚麻酸、二十碳五烯酸 (EPA,20:5)、二十二碳六烯酸(DHA,22:6),对人体正常的发育具有重要功能并有减轻心脏病风险的特殊作用。近年来,这些多不饱和脂肪酸的需求日益增加,目前人们主要通过从深海鱼类中提取这些脂肪酸,这不仅严重破坏了生态平衡,且费用日益增长。∆15脂肪酸去饱和酶是亚油酸转化成 ω-3系列多不饱和脂肪酸的关键酶,十八碳四烯酸 (SDA) 是 ω-3类长链多不饱和脂肪酸的前体,在人体内易转化成 EPA和 DHA,将玻璃苣中的 ∆6-脂肪酸去饱和酶和拟南芥中的 ∆15脂肪酸去饱和酶共同转入大豆,可以使大豆中SDA含量提高到脂肪酸总量的 29%以上,ω-3类多不饱和脂肪酸含量高达60%[31]。将真菌Fusarium moniliforme中的∆12/15双功能脂肪酸去饱和酶转入大豆,转基因 T1代种子中 α-亚麻酸/亚油酸的比值大大提高,最高的达到对照的7倍[25],高水平α-亚麻酸的积累为EPA和DHA等脂肪酸合成提供了充足的前体。在微生物Acanthamoeba castellanii中克隆的∆12/15双功能去饱和酶能使酵母中积累罕见的十六碳三烯酸 (16:3∆(9,12,15) ω-1),进而可以积累只在深海微生物中报道过的十六碳四烯酸[32],这对阐明脂肪酸脱氢酶系的进化具有重要意义。
1.3 三酰甘油组装酶及其基因工程研究进展
1.3.1三酰甘油组装酶系
利用贮存在胞质中的酰基CoA池,在内质网上通过 3种不同的酰基转移酶的作用合成三酰甘油(Triacylglycerol,TAG),这3种酶分别是作用于sn-1位置上的甘油 3-磷酸酰基转移酶 (Glyceral 3-phosphate acyltransferase,GPAT)、作用于sn-2位置上的溶血磷脂酸酰基转移酶 (Lysophosphatidic acid acyltransferase,LPAT) 和作用于sn-3位置上的二酰甘油酰基转移酶 (Diacyl-glycerol acyltransferase,DGAT)[33]。三种酰基转移酶常具有对脂肪酸的选择性,饱和脂肪酸通常位于三酰甘油的 Sn-1和 Sn-3的位置上,Sn-2的位置上通常被不饱和脂肪酸占据。
1.3.2三酰甘油组装酶的基因工程
研究表明,在拟南芥中过量表达红花和大肠杆菌的GPAT基因可以增加种子含油量和种子重量,含油量可增加 8%~29%[34]。在拟南芥和油菜中过量表达酵母的LPAT基因,种子含油量提高了8%~48%,同时增加了长链脂肪酸的比例和含量[35]。椰子中含有高水平月桂酸,月桂酸在椰子中三酰甘油的3个位置均能找到。将从椰子果分离的LPAT基因和从加利福尼亚月桂树获得的硫酯酶基因在菜籽中共同表达会使菜籽油中月桂酸含量提高到70%[36]。近年来,随着全基因组序列的获得,在拟南芥中至少发现了9个类型的GPAT[37]和9个类型的LPAT[38]基因,它们虽然基本功能相似,但分别作用于不同的底物,表达特性和亚细胞定位差异非常大,这与磷脂广泛参与细胞构架和各种生命代谢相关,人们试图寻找与储藏类三酰甘油合成密切相关的 GPAT和LPAT类型。利用种子特异性启动子在拟南芥中过量表达油菜的两种微粒体 (Microsomal)LPAT基因,其转基因后代种子的重量和脂肪酸含量分别较对照平均增加 6%和 13%[38]。DGAT催化TAGs合成的最后一步反应,通过图位克隆的方法从高油玉米中分离到一个DGAT1-2蛋白,其469位置上苯丙氨酸的插入导致含油量的增加,在常规玉米中表达此基因可使含油量提高41%,使油酸含量提高107%[39]。Ohlrogge和Jaworski认为在TAG合成中存在一个供需调节关系[40],脂肪酸作为“供方”,而提高三酰甘油组装酶的活性即提高了需求,从而大幅提高种子含油量。芯片分析表明,DGAT的过量表达不仅引起TAG生物合成的改变,同时引起种子发育过程中其他基因转录水平和激素水平的改变[41]。
另外,通过抑制磷酸烯醇式丙酮酸羧化酶(PEP) 基因的表达,减少用于蛋白质合成的碳源,使更多的光合作用产物用于脂肪酸合成,也可以提高种子含油量。陈锦清等[42]通过反义抑制油菜PEP基因的表达,成功获得多个籽粒含油量比受体品种提高25%以上的转基因油菜新品种,蛋白质含量与油脂含量呈显著负相关。线粒体型丙酮酸脱氢酶复合体 (PDC) 可将丙酮酸转化成脂肪酸合成的底物乙酰辅酶 A,而丙酮酸脱氢酶复合体激酶 (PDHK)是 PDC的负调控因子,利用反义 RNA方法降低PDHK的活性,减少其对PDC的抑制作用,可提高丙酮酸转化成乙酰辅酶A的能力,最终能显著提高转基因植物种子的含油量[43]。TAG在细胞中的最终储存场所是油体,这个细胞中最小的细胞器由油体蛋白和磷脂单分子层包围三酰甘油组成。研究表明,抑制油体蛋白的表达可使油体体积增大,导致油脂含量的降低[44]。对油菜栽培种中低油和高油品种的油体分析表明,高油品种的油体体积普遍小于低油品种的油体体积,且在种子发育早期、成熟和萌发不同时期有不同的表现[45]。
2 影响种子含油量的调控因子
近年来,随着模式植物功能基因组学的发展和突变体库的构建,植物种子发育过程的分子机制逐渐被阐明。最近的研究表明,影响种子发育的系列转录因子同时影响着种子中油分和蛋白的积累。LEC1、LEC2、ABI3以及FUS3等转录因子在种子发育和物质积累过程中起关键作用,它们处于调控网络的上游,控制着植物发育的多项生物过程。这些基因的突变、过量表达或异位表达对植物的生长发育往往是致命的,或导致生长发育的严重异常。对这些基因表达调控机理的研究,在理论和实践上具有重要意义。
LEC1(Leafy Cotyledon 1)编码CCAAT-Box结合因子HAP3的一个亚基,LEC1基因控制胚胎发育过程中的多个方面,是胚胎发育过程中关键调控因子。在胚胎发育早期 LEC1维持胚柄细胞的特性以及子叶的特性,而在胚胎发育的后期LEC1基因的表达与储藏物质的积累、胚抗脱水性的获得等种子成熟过程相关。在lec1突变体或野生型拟南芥中过量表达LEC1基因,导致转基因后代幼苗畸型,幼苗的叶片上发现胚状体[46]。过量表达拟南芥LEC1基因可影响其他转录因子,如 ABI3、FUS3和WRINKLED1等,提高脂肪酸合成相关基因表达的整体水平,引起脂肪酸和油脂含量的提高[47]。LEC2是含有B3结构域的DNA结合蛋白家族成员之一,与LEC1相似,LEC2控制着植物种子发育过程的多个方面。LEC2活性的提高可促进LEC1、FUS3和ABI3基因的表达,异位表达FUS3可以促进脂肪酸生物合成相关基因的表达[48],而对LEC2的诱导表达可促进叶子中储藏油的积累[49],这可能是因为LEC2间接调控了FUS3的表达引起的。WRINKLED1编码一个AP2/EREB结构域蛋白,35S启动子驱动WRI1的cDNA在拟南芥中过表达,在T4代转基因株系中,种子油分含量提高 10%~20%,且产量没有受到转基因的影响[50]。芯片和 RT-PCR结果表明,WRI1直接调控糖酵解和脂肪酸代谢过程的基因[51-53],而LEC2和LEC1均是影响WRI1表达的上游基因[50,52]。根据当前的研究,在调控种子含油量的复杂网络中LEC1、LEC2、FUS3和ABI3都起着重要的作用。而这4个转录因子均受到植物激素 (生长素、ABA、GA) 的影响,同时调控下游的WRI1、ABI5和AGL15等转录因子[54]。
GLABRA2是一种同源盒蛋白 (Homeobox protein),维持毛状体 (Trichome)和根毛的正常发育,拟南芥GLABRA2基因突变体种子中含油量较野生型提高了 8%,而在植物生长发育和种子的大小方面无显著差异。GLABRA2基因的突变没有改变胚发育过程中LEC1和PICKLE的表达,但引起38个转录因子转录活性的降低[55]。
将大豆Dof4和Dof11转录因子转入拟南芥,引起转基因种子含油量的提高和千粒重的增加,两种蛋白分别提高了乙酰辅酶A羧化酶和长链乙酰辅酶A合成酶的活性并能引起储藏蛋白基因表达下调,从而将能量流向脂肪酸合成的方向转变[56]。
3 展望
植物油不仅是人们日常生活中的必需品,还是能量聚集的自然平台,在自然界碳能源过度开采的今天,植物油是能源的可能替代品之一[57]。植物种子是植物油的主要来源,改良植物种子脂肪酸组成和提高含油量是油料作物研究的永恒课题。
以往的研究主要集中在植物脂肪酸合成途径和三酰甘油合成途径,研究表明,增强三酰甘油途径中酰基转移酶的表达比增强脂肪酸合成能更有效地提高含油量[58],这其中蕴含了“源库”和“供需”的平衡关系,人们通过改变这些平衡,在增加种子含油量方面做出了许多有意义的尝试。当前主要油料作物种子含油量差别很大,例如同是来自豆科的大豆和花生含油量分别在20%和50%左右,但其脂肪合成途径却很相似。这启示我们在漫长的植物进化过程中,种子的脂肪合成效率发生了变化,这主要受种子发育期间基因调控的影响,近年来对种子发育上游转录因子的研究正在揭示这些问题,这对怎样整体提高植物中油脂的转化效率具有重要意义。
随着基因组学和基因工程的发展,对不同生物脂肪酸组成和脂肪酸去饱和酶系的研究逐渐深入,通过特殊脂肪酸去饱和酶改良植物脂肪酸组成,进而提高油料作物的经济附加值成为可能,这将成为作物脂肪酸改良的重要发展方向。但要做到不影响植物生长和脂肪的储藏加工,才能真正应用到生产中去。
我国主要的油料作物有大豆、花生、油菜和向日葵等,其中花生出油率较高,达到50%以上,是经济实用的油料作物。我国50%的花生用来榨油,所以高含油量的花生育种十分重要。同时,作为食用油的重要来源,其脂肪酸成分和保健功能越来越受到人们的重视。我们在构建花生栽培品种鲁花14未成熟籽粒全长cDNA文库的基础上,利用同源克隆和 RACE等方法系统克隆了花生脂肪酸合成途径乙酰辅酶 A羧化酶和脂肪酸合酶复合体的关键基因[11,59],三酰甘油合成基因GPAT、LPAT和DGAT,油脂含量的重要调控基因LEC1[60]、FUS3和WRI1等;对这些基因的多样性、基因结构、表达特性进行了研究,并在模式植物中验证其功能,为通过这些基因进一步调控油料作物中油脂含量和脂肪酸组成奠定了良好的基础。
REFERENCES
[1] Buchanan BB, Gruissem W, Jones RL. Biochemistry &Molecular Biology of Plants. Rockville MD: American Society of Plant Physiologists, 2000: 457.
[2] Schulte W, Töpfer R, Stracke R,et al. Multi-functional acetyl-CoA carboxylase fromBrassica napusis encoded by a multi-gene family: indication for plastidic localization of at least one isoform.Proc Natl Acad Sci USA, 1997, 94(7): 3465−3470.
[3] Shorrosh BS, Roesler KR, Shintani D,et al. Structural analysis, plastid localization, and expression of the biotin carboxylase subunit of acetyl-coenzyme A carboxylase from tobacco.Plant Physiol, 1995, 108(2): 805−812.
[4] Cronan JE. Bacterial membrane lipids: where do we stand?Annu Rev Microbiol, 2003, 57: 203−224.
[5] Schulte W, Schell J, Töpfer R. A gene encoding acetyl coenzyme A carboxylase fromBrassica napus.Plant Physiol, 1994, 106(2): 793−794.
[6] Ashton AR, Jenkins CLD, Whitfield PR. Molecular cloning of two different cDNAs for maize acetyl CoA carboxlylase.Plant Mol Biol, 1994, 24(1): 35−49.
[7] Chalupska D, Lee HY, Faris JD,et al. Acc homoeoloci and the evolution of wheat genomes.Proc Natl Acad Sci USA, 2008, 105(28): 9691−9696.
[8] Konishi T, Sasaki Y. Compartmentalization of two forms of acetyl-CoA carboxylase in plants and the origin of their tolerance toward herbicides.Proc Natl Acad Sci USA,1994, 91(9): 3598−3601.
[9] Reverdatto S, Beilinson V, Nielsen NC. A multisubunit acetylcoenzyme A carboxylase from soybean.Plant Physiol, 1999, 119(3): 961−978.
[10] Lee SS, Jeong WJ, Bae JM,et al. Characterization of the plastid-encoded carboxyltransferase subunit (accD) gene of potato.Mol Cells, 2004, 17(3): 422−429.
[11] Li MJ, Xia H, Zhao CZ,et al. Isolation and characterization of putative acetyl-CoA carboxylases inArachis hypogaeaL.Plant Mol Biol Rep, 2010, 28(1):58−68.
[12] Yanai Y, Kawasaki T, Shimada H,et al. Genomic organization of 251 kDa acetyl-CoA carboxylase genes inArabidopsis: tandem gene duplication has made two differentially expressed isozymes.Plant Cell Physiol,1995, 36(5): 779−787.
[13] Ke J, Wen TN, Nikolau BJ,et al. Coordinate regulation of the nuclear and plastidic genes coding for the subunits of the heteromeric acetyl-coenzyme A carboxylase.Plant Physiol, 2000, 122(4): 1057−1071.
[14] Page RA, Okada S, Harwood JL. Acetyl-CoA carboxylase exerts strong flux control over lipid synthesis in plants.Biochim Biophys Acta, 1994, 1210(3): 369−372.
[15] Post-Beittenmiller D, Roughan PG, Ohlrogge JB.Regulation of plant fatty acid biosynthesis. Analysis of acyl-Coenzyme A and acyl-acyl carrier protein substrate pools in spinach and pea chloroplasts.Plant Physiol, 1992,100(2): 923−930.
[16] Roesler K, Shintani D, Savage L,et al. Targeting of theArabidopsishomomeric acetyl-Coenzyme A carboxylase to plastids of rapeseeds.Plant Physiol, 1997, 113(1):75−81.
[17] Madoka Y, Tomizawa K, Mizoi J,et al. Chloroplast transformation with modified accD operon increased acetyl-CoA carboxylase and causes extension of leaf longevity and increase in seed yield in tobacco.Plant Cell Physiol, 2002, 43(12): 1518−1525.
[18] Zhang YM, Wu B, Zheng J,et al. Key residues responsible for acyl carrier protein and β-ketoacyl-acyl carrier protein reductase (FabG) interaction.J Biol Chem,2003, 278(52): 52935−52943.
[19] Hloušek-Radojčić A, Post-Beittenmiller D, Ohlrogge JB.Expression of constitutive and tissue-specific acyl carrier protein isoforms inArabidopsis.Plant Physiol, 1992,98(1): 206−214.
[20] Bonaventure G, Ohlrogge JB. Differential regulation of mRNA levels of acyl carrier protein isoforms inArabidopsis.Plant Physiol, 2002, 128(1): 223−235.
[21] Jha JK, Sinha S, Maiti MK,et al. Functional expression of an acyl carrier protein (ACP) fromAzospirillum brasilensealters fatty acid profiles inEscherichia coliandBrassica juncea.Plant Physiol Biochem, 2007, 45(6/7): 490−500.
[22] Dehesh K, Tai H, Edwards P,et al. Overexpression of 3-ketoacyl-acyl-carrier protein synthase IIIs in plants reduces the rate of lipid synthesis.Plant Physiol, 2001,125(2): 1103−1114.
[23] Pidkowich MS, Nguyen HT, Heilmann I,et al. Modulating seed beta-ketoacyl-acyl carrier protein synthase II level converts the composition of a temperate seed oil to that of a palm-like tropical oil.Proc Natl Acad Sci USA, 2007,104(11): 4742−4747.
[24] Voelker TA, Hayes TR, Cranmer AM,et al. Genetic engineering of a quantitative trait: metabolic and genetic parameters influencing the accumulation of laurate in rape seed.Plant J, 1996, 9(2): 229−241.
[25] Damude HG, Zhang HX, Farrall L,et al. Identification of bifunctional ∆12/ω3 fatty acid desaturases for improving the ratio of ω3 to ω6 fatty acids in microbes and plants.Proc Natl Acad Sci USA, 2006, 20(6): 9446−9451.
[26] Knutzon DS, Thompson GA, Radke SE,et al.Modification of Brassica seed oil by antisense expression of a stearoyl-acyl carrier protein desaturase gene.Proc Natl Acad Sci USA, 1992, 89(7): 2624−2628.
[27] Stoutjesdijk PA, Hurlestone C, Singh SP,et al. High-oleic acid AustralianBrassica napusandB. junceavarieties produced by co-suppression of endogenous Delta12-desaturases.Biochem Soc Trans, 2000, 28(6): 938−940.
[28] Liu Q, Singh SP, Green AG. High-stearic and High-oleic cottonseed oils produced by hairpin RNA-mediated post-transcriptional gene silencing.Plant Physiol, 2002,129(4): 1732−1743.
[29] Thelen JJ, Ohlrogge JB. Metabolic engineering of fatty acid biosynthesis in plants.Metab Eng, 2002, 4(1): 12−21.
[30] Sayanova O, Smith MA, Lapinskas P,et al. Expression of a borage desaturase cDNA containing an N-terminal cytochrome b5 domain results in the accumulation of high levels of delta 6-desaturated fatty acids in transgenic tobacco.Proc Natl Acad Sci USA, 1997, 94(8):4211−4216.
[31] Eckert H, La Vallee B, Schweiger BJ,et al. Coexpression of the borage Delta 6 desaturase and the Arabidopsis Delta 15 desaturase results in high accumulation of stearidonic acid in the seeds of transgenic soybean.Planta, 2006,224(5): 1050−1057.
[32] Sayanova O, Haslam R, Guschina I,et al. A bifunctional Delta12, Delta15-desaturase fromAcanthamoeba castellaniidirects the synthesis of highly unusual n-1 series unsaturated fatty acids.J Biol Chem, 2006, 281(48):36533−36541.
[33] Zhou YH, Chen ZH. Genetic manipulation and gene engineering of fatty acid metabolism in plant seeds.Bull Bot, 1998, 15(5): 16−23.
周奕华, 陈正华. 植物种子中脂肪酸代谢途径的遗传调控与基因工程. 植物学通报, 1998, 15(5): 16−23.
[34] Jain RK, Coffey M, Lai K,et al. Enhancement of seed oil content by expression of glycerol-3-phosphate acyltransferase genes.Biochem Soc Trans, 2000, 28(6):958−961.
[35] Zou J, Katavic V, Giblin EM,et al. Modification of seed oil content and acyl composition in the brassicaceae by expression of a yeast sn-2 acyltransferase gene.Plant Cell,1997, 9(6): 909−923.
[36] Knutzon DS, Hayes TR, Wyrick A,et al. Lysophosphatidic acid acyltransferase from coconut endosperm mediates the insertion of laurate at the sn-2 position of triacylglycerols in lauric rapeseed oil and can increase total laurate levels.Plant Physiol, 1999, 120(3): 739−746.
[37] Gidda SK, Shockey JM, Rothstein SJ,et al.Arabidopsis thalianaGPAT8 and GPAT9 are localized to the ER and possess distinct ER retrieval signals: functional divergence of the dilysine ER retrieval motif in plant cells.Plant Physiol Bioch, 2009, 47(10): 867−879.
[38] Maisonneuve S, Bessoule JJ, Lessire R,et al. Expressionof rapeseed microsomal lysophosphatidic acid acyltransferase isozymes enhances seed oil content inArabidopsis.Plant Physiol, 2010, 152(2): 670−684.
[39] Zheng PZ, Allen WB, Roesler K,et al. A phenyl- alanine in DGAT is a key determinant of oil content and composition in maize.Nat Genet, 2008, 40(3): 367−372.
[40] Ohlrogge JB, Jaworski JG. Regulation of fatty acid synthesis.Annu Rev Plant Physiol Plant Mol Biol, 1997,48: 109−136.
[41] Sharma N, Anderson M, Kumar A,et al. Transgenic increases in seed oil content are associated with the differential expression of novelBrassica-specific transcripts.BMC Genomics, 2008, 9: 619.
[42] Chen JQ, Lang CX, Hu ZH,et al. Antisense PEP gene regulates to ratio of protein and lipid content inBrassica napusseeds.J Agricul Biotech, 1999, 7(4): 316−320.
陈锦清, 郎春秀, 胡张华, 等. 反义 PEP基因调控油菜籽粒蛋白质/油脂含量比率的研究. 农业生物技术学报,1999, 7(4): 316−320.
[43] Marillia EF, Micallef BJ, Micallef M,et al. Biochemical and physiological studies ofArabidopsis thalianatransgenic lines with repressed expression of the mitochondrial pyruvate dehydrogenase kinase.J Exp Bot,2003, 54(381): 259−270.
[44] Siloto RM, Findlay K, Lopez-Villalobos A,et al. The accumulation of oleosins determines the size of seed oilbodies inArabidopsis.Plant Cell, 2006, 18(8):1961−1974.
[45] Hu Z, Wang X, Zhan G,et al. Unusually large oilbodies are highly correlated with lower oil content inBrassica napus.Plant Cell Rep, 2009, 28(4): 541−549.
[46] Lotan T, Ohto M, Yee KM,et al. Arabidopsis LEAFY COTYLEDON 1 is sufficient to induce embryo development in vegetative cells.Cell, 1998, 93(7):1195−1205.
[47] Mu JY, Tan HL, Zheng Q,et al. LEAFY COTYLEDON1 is a key regulator of fatty acid biosynthesis inArabidopsis.Plant Physiol, 2008, 148(10): 1042−1054.
[48] Wang H, Guo J, Lambert Ket al. Developmental control ofArabidopsisseed oil biosynthesis.Planta, 2007, 226(3):773−783.
[49] Santos Mendoza M, Dubreucq B, Miquel M,et al. LEAFY COTYLEDON 2 activation is sufficient to trigger the accumulation of oil and seed specific mRNAs inArabidopsisleaves.FEBS Lett, 2005, 579(21): 4666−4670.
[50] Cernac A and Benning C. WRINKLED1 encodes an AP2/EREB domain protein involved in the control of storage compound biosynthesis inArabidopsis.Plant J,2004, 40(4): 575−585.
[51] Andre C, Froehlich JE, Moll MR,et al. A heteromeric plastidic pyruvate kinase complex involved in seed oil biosynthesis inArabidopsis.Plant Cell, 2007, 19(6):2006−2022.
[52] Baud S, Mendoza MS, To A,et al. WRINKLED1 specifies the regulatory action of LEAFY COTYLEDON2 towards fatty acid metabolism during seed maturation inArabidopsis.Plant J, 2007, 50(5): 825−838.
[53] Baud S, Wuillème S, Dubreucq B,et al. Function of plastidial pyruvate kinases in seeds ofArabidopsis thaliana.Plant J, 2007, 52(3): 405−419.
[54] Santos-Mendoza M, Dubreucq B, Baud S,et al.Deciphering gene regulatory networks that control seed development and maturation inArabidopsis.Plant J,2008, 54(4): 608−620.
[55] Shen B, Sinkevicius KW, Selinger DA,et al. The homeobox geneGLABRA2affects seed oil content inArabidopsis.Plant Mol Biol, 2006, 60(3): 377−387.
[56] Wang HW, Zhang Bo, Hao YJ,et al. The soybean Dof-type transcription factor genes, GmDof4 and GmDof11, enhance lipid content in the seeds of transgenicArabidopsisplants.Plant J, 2007, 52(4): 716−729.
[57] Durrett T, Benning C and Ohlrogge J. Plant triacylglycerols as feedstocks for the production of biofuels.Plant J, 2008, 54(4): 593−607.
[58] Ramli US, Baker DS, Quant PA,et al. Control analysis of lipid biosynthesis in tissue cultures from oil crops shows that flux control is shared between fatty acid synthesis and lipid assembly.Biochem J, 2002, 364(Pt2): 393−401.
[59] Li MJ, Li AQ, Xia H,et al. Cloning and sequence analysis of putative type II fatty acid synthase genes fromArachis hypogaeaL.J Biosci, 2009, 34(2): 227−238.
[60] Li AQ, Xia H, Wang XJ,et al. Cloning and expression analysis of Peanut (Arachis hypogaeaL.) LEC1.Acta Bot Boreal Occident Sin, 2009, 29(9): 1730−1735.
李爱芹, 夏晗, 王兴军, 等. 花生LEC1基因的克隆及表达研究. 西北植物学报, 2009, 29(9): 1730−1735.
Improving fatty acid composition and increasing triacylglycerol content in plants by gene engineering: a review
Han Xia, Xingjun Wang, Mengjun Li, and Han Xiao
High-Tech Research Center,Shandong Academy of Agricultural Sciences,Key Laboratory of Crop Genetic Improvement and Biotechnology,Huanghuaihai,Ministry of Agriculture,Key Laboratory for Genetic Improvement of Crop,Animal and Poultry of Shandong Province,Ji’nan250100,China
Received:January 20, 2010;Accepted:April 19, 2010
Supported by:National High Technology Research and Development Program of China (863 Program) (No. 2006AA10A114), Natural Science Foundation of Shandong Province, China (No. Y2008D44), Foundation for Excellent Young Scientists of Shandong Province, China (No.2006BS06008), Technology Innovation Foundation of Shandong Academy of Agricultural Sciences and Shandong Personnel Management Office Program (No. 2007YCX001).
Corresponding author:Xingjun Wang. Tel: +86-531-83179470; Fax: +86-531-83178156; E-mail: xingjunw@hotmail.com
国家高技术研究发展计划项目 (863计划) (No. 2006AA10A114),山东省自然科学基金 (No. Y2008D44),山东省优秀中青年科学家奖励基金(No. 2006BS06008),山东省人事厅和山东省农业科学院创新基金 (No. 2007YCX001) 资助。
