胰腺实性假乳头状瘤CT及MRI所见分析
2010-10-09邢鹏毅巴照贵郭建平
邢鹏毅,巴照贵,郭建平
胰腺实性假乳头状瘤 (solid-pseudopapillary tumor of pancreas,SPTP)是一种具有潜在恶性的胰腺肿瘤,因同时具有实性和乳头状的组织结构而得名。由于影像学缺乏特征征象,术前易误诊为其它病变。本文收集经手术病理证实的SPTP 28例,回顾性分析其临床资料及影像特征,以期提高该病的诊断准确率。
1 资料与方法
1.1 一般资料 搜集2008-01~2009-07经手术病理证实的 SPTP 28例,女 25例,男3例;年龄 10~57岁,平均25岁,中位年龄28岁。临床表现:13例无明显症状,查体时偶然发现;15例不明原因腹痛、腹胀。除1例合并有黄疸外,其余27例血胆红素水平均正常。血糖及肿瘤标记物 (CEA,CA-199.CA125)均在正常范围内。
1.2 检查方法 20例患者行CT平扫及增强。采用GE64层螺旋CT扫描机,扫描参数120 kV,300 mA,层厚5 mm,重建层厚1.5 mm,间隔0.625 mm,所有患者均行增强扫描,应用非离子型对比剂优维显300,总量100 ml,以3 ml/s注射。动脉期延迟25 s,门脉期延迟60 s,延迟期180 s行3期扫描。MR扫描采用美国GE公司 Signa 1.5Tesla超导磁共振行平扫和Gd-DTPA多时相动态增强扫描,采用Torso相控表面线圈,T1WI用2D快速扰相位梯度重聚成像(FSPGR序列)和化学位移成像(同反相位成像采用相同的窗宽窗位摄片);T2WI(FSE FAT sat序列):TR 2000~5000ms,TE 86~104ms;层厚 5~8mm,层间距1~3 mm。多时相动态增强扫描采用脂肪抑制 3DFSPGR或LAVA序列,56~80层,屏气 16~20 s,Gd-DTPA 的注射速度按 1.5~3.0 ml/s,剂量为0.1 mmol/kg。
2 结 果
2.1 病变部位、大小和形态 肿瘤均为单发,胰头部10例,胰颈5例,胰体7例,胰尾部6例。肿瘤直径 2.2~11.3 cm。呈圆形或类圆形23例,分叶状5例。25例肿物以外生性生长为主;3例位于胰腺实质内,且直径均<3 cm。27例病灶与正常胰腺实质分界清楚,1例与周围胰腺组织分界欠清晰。
2.2 CT表现 ①本组28例行CT检查17例,术前正确诊断14例(正确率82.3%),平扫13例呈囊实性混杂密度;2例以囊性成分为主,可见壁结节;2例以实性成分为主,周边包膜下可见少量囊性成分;本组28例钙化8例,表现为周边环形钙化5例;中心不规则钙化3例;其中1例为环形钙化合并中心钙化(图1、8);②增强扫描:13例囊实性及2例实性成分为主病灶的实性成分动脉期轻度强化,CT值增加(22.1±4.3)HU,门脉期和平衡期强化程度高于动脉期,CT 值增加(37.7±5.8)HU,接近或略低于胰腺实质的密度,囊性成分无强化;1例囊性为主病灶,囊壁及壁结节明显强化(图2);5例延迟强化可见包膜(图3),余12例未见明显包膜,但与周围组织分界清晰。
2.3 MRI表现 本组28例行MR平扫及增强检查11例,术前正确诊断9例(正确率81.8%)。平扫时7例呈囊实性混杂信号,1例以囊性成分为主,可见囊壁及壁结节;3例以实性成分为主,包膜下可见少量囊性成分。4例病灶内可见点片状短T1WI信号影,压脂未见信号减低,增强未见强化(图4)。增强扫描5例延迟期病灶实性部分呈等于或略高于胰腺信号(图5),6例延迟期可见包膜显示(图6)。
2.4 继发性改变 除1例位于胰头部的囊实性病灶引起胆道系统扩张外,其余患者均未见胆管及胰管扩张征象。8例肿瘤压迫胃后壁或十二指肠降段内侧壁周围的血管受推压,但血管周围的脂肪层仍存在。1例可见肝脏转移,CT表现为环形强化 (图7、8)。

图1 胰尾部分叶状囊实性肿块,病灶周边及病灶内均可见钙化

图2 胰体部明显囊变病灶,其壁及壁结节明显强化

图3 胰体部类圆形肿块,延迟期可见包膜明显强化,显示清晰

图4 T1WI示胰尾部类圆形肿块,其内可见短T1WI信号,术后病例证实为出血
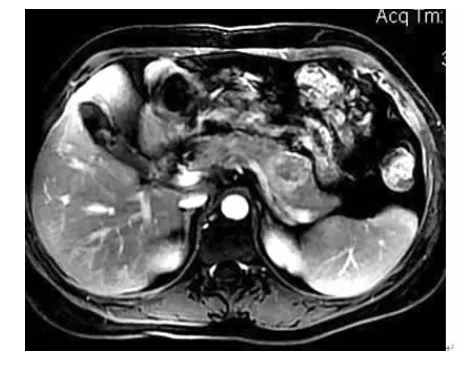
图5 MRI增强扫描示胰尾部囊实性病灶,实性成分延迟期高于胰腺信号

图6 MRI增强扫描示胰体部巨大囊实性病灶,可见包膜延迟强化,显示清晰
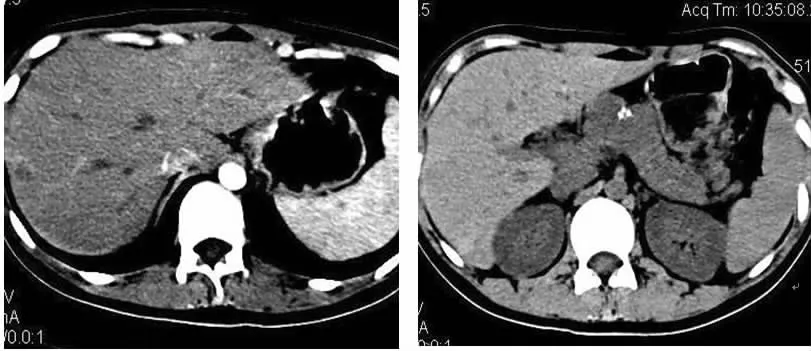
图7、8 为同一病例,胰颈部分叶状肿块,其内可见钙化,并可见肝脏环形强化病灶,术后病理证实为SPTP并肝脏转移。
3 讨 论
SPTP发病率低,仅占胰腺外分泌肿瘤的1%~2%。最早由Frantz于1959年报道,1996年WHO将其统一命名为 SPTP[1,2]。
3.1 SPTP的组织学起源 SPTP的组织起源尚无定论,目前最普遍的观点认为,肿瘤起源于具有多种分化方向的原始多潜能干细胞。其它学说还包括导管上皮起源和胰腺腺泡起源。最新研究还认为STPT可能起源于神经脊细胞[3]。
3.2 临床特点 SPTP是一种低度恶性肿瘤,大多数患者预后良好,甚至有肿瘤特发消退的报道[4],但仍有10%~15%的患者在发现肿瘤的同时已经有肝脏、淋巴结、腹膜和网膜等部位的转移。其恶变的概率随年龄的增长而升高。本组28例中仅1例发生肝脏转移,与文献报道一致[4]。SPTP多见于年轻女性,男女发病比例为1∶9.6,平均发病年龄为30岁;本组28例中女25例,男3例,平均年龄25岁,与文献报道大致相符[5]。
3.3 影像学表现 SPTP可发生于胰腺的任何部位,但以胰头部多见,偶可位于腹膜后而与胰腺无关,甚至位于肝脏[6];本组10例位于胰头,5例位于胰颈,7例位于胰体,6例位于胰尾部,提示病变分布无特异性。病灶直径往往超过10 cm,常有明显的边界,周围组织多受挤压而移位[7];本组仅1例直径超过10 cm(11.3 cm);27例边界清晰,1例与周围胰腺组织分界欠清晰。
肿瘤多以囊实性混杂成分为主,但也可表现为以囊性或实性成分为主的特征。当以囊性成分为主时,实性结构表现为附壁结节;以实性成分为主时,囊性结构多位于包膜下。本组20例呈囊实性表现,3例以囊性成分为主,可见囊壁及壁结节,5例以实性成分为主,仅含少量囊性成分;囊实性混杂成分为主及实性成分为主病灶的囊性成分均以周边分布为主,有别于胰腺癌的中央坏死。Cantisani等[8]认为肿瘤内出血为区别于其它胰腺肿瘤的重要特征。由于受密度分辨率的限制和出血时间的影响,CT对陈旧性出血并不敏感。本组28例中4例MRI检查病灶可见点片状短T1WI信号影,压脂未见信号减低,增强后无强化,术后病理证实为瘤体内出血,占本组28例的14.3%,虽然出现率低但较具特异性;文献报道30%的SPTP可见细条状或斑点状钙化,且以边缘区多见[9]。本组中8例发现钙化占28%,周边环形钙化7例,中心不规则钙化1例。其中1例为环形钙化合并中心钙化,中心钙化均位于囊变区。多数肿瘤包膜完整,厚约2~4 mm,均匀光整,T2WI表现为低信号,增强扫描呈较明显强化,少数肿瘤无完整包膜,偶可侵入囊壁、胰腺实质、静脉或侵及邻近脏器。本组仅1例表现为包膜不完整,包膜在T2WI及CT、MR增强扫描显示清晰,MR在显示包膜方面优于CT。
SPTP增强扫描病灶实性区血供相对比较丰富,动脉期呈不均匀强化,门脉期和平衡期强化程度逐渐增加,但强化程度不及正常胰腺组织;如果肿物囊变,壁结节可见明显强化[10]。本组20例囊实混合性及5例实性成分为主病灶的实性成分动脉期均呈相对胰腺实质的弱强化,门脉期及延迟期强化程度逐渐增加,且CT与MR强化方式一致。其中5例病变延迟期实性部分等于或略高于胰腺信号,其它22例实性部分各期均低于胰腺实质密度或信号。1例囊性成分为主病灶,壁结节及壁均可见明显强化。
由于生长缓慢且质地较软,即使位于胰头部,也很少会引起胆管或胰管扩张;本组28例除1例位于胰头部较大病灶可见胆管轻度扩张,余27例未见胆管及胰管扩张。笔者认为与肿瘤以外生性生长方式有关。文献报道少数SPTP病例可出现肝脏、腹膜、卵巢、皮下等部位的转移及胰周淋巴结转移性肿大;本组1例出现肝脏的转移。
3.4 鉴别诊断 SPTP需与胰腺假性囊肿、胰岛细胞瘤、浆液性囊腺瘤、黏液性囊腺瘤、胰腺癌等鉴别。本组28例术前曾诊断为胰岛细胞瘤2例,囊腺瘤2例,胰腺癌1例。无功能性胰岛细胞瘤体积往往较大其内部也可以发生囊变,从而与SPTP类似。但该病无女性好发的趋势,其内部囊变以中心分布为主,且动态增强后,与正常胰腺实质相比,其内的实性部分早期强化非常明显。浆液性囊腺瘤多见于中年女性,多位于胰头部,壁厚<2 mm,囊壁增强扫描不强化,常为多囊,病灶中心多可见星形瘢痕,钙化常见病,灶中央出现日光放射状钙化是其特征性表现。黏液性囊腺瘤/癌由单囊或少数大囊构成,囊腔直径通常>2 cm,内壁光滑或见乳头状实性组织突入腔内,囊壁厚度各异,可见囊壁或分隔的钙化,囊内可有粗细不等的分隔,而SPTP病灶内无分隔。个别患者与囊性SPTP鉴别困难,仍需进一步研究。胰腺癌多见于老年男性,恶性度高,其特点是癌性病变常位于胰腺实质轮廓内,与正常胰腺多分界不清,坏死的囊变区常为不规则形,且以病变中心分布为主,早期即可引起胰胆管扩张,侵犯周围的组织器官。
影像技术的进步和临床经验的积累,术前诊断SPTP是可能的,当发现中青年女性,来自胰腺的囊实性肿瘤性病变,表现为边界清晰,实性成分呈轻中度渐进性强化时,应想到该病的可能。CT和MRI都可以对绝大多数病例做出术前正确诊断。
[1]Coleman KM,Doherty MC,Bigler SA.Solid pseudopapillary tumor of the pancreas.Radiographics,2003,23(6):1644-1648.
[2]Ulusan S,Bal N,Kizilkilic O,et al.Case report:solid-pseudopapillary tumor of the pancreas associated with dorsal agenesis.Br J Radiol,2005,78(929):441-443.
[3]Chen C,Jing W,Gulati P,et al.Melanocytic diffentiation in a solid pseudopapillary tumor of the pancreas[J].Gastroenterol,2004,39(6):579-583.
[4]Hachiya M,Hachiya Y,Mitsui K,et al.Solid,cystic and vanishing tumors of the pancreas[J].Clin Imaging,2003,27(2):106-108.
[5]Kang CM,Ki m KS,Choi JS,et al.Solid-pseudopapillary tumor of the pancreas suggesting malignant potential[J].Pancreas,2006,32(3):276-280.
[6]缪 飞,展 颖,汪登斌,等.胰腺实性假乳头状瘤的CT诊断和鉴别诊断. 中华放射学杂志,2003,37(5):417-421.
[7]赵玉沛,胡 亚,廖 泉,等.胰腺实性假乳头状瘤的诊断和治疗. 中华外科杂志,2005,43(1):53-55.
[8]Cantidani V,Mortele KJ,Levy A,et al.MR imaging features of solid pseudopapillary tumor of the pancreas in adult and pediatric patients.AJR Am J Roentgenol,2003,37(5):417-421.
[9]Buetow PC,Buck JL,Pantongrag-B rown L,et al.Solid and papillary epithelial neoplasm of the pancreas:imaging-pathologiccorrelation of 56 cases[J].Radiology,1996,199(3):707-711.
[10]张立华,杨 宁,冯 逢,等.胰腺实性假乳头状瘤的CT表现.基础医学与临床,2008,28(1):80-83.
