缺磷胁迫下番茄侧根形成与miR164及NAC1表达的关系
2010-10-08曾后清朱毅勇沈其荣黄思齐杨志敏
曾后清,朱毅勇*,包 勇,沈其荣,郭 凯,黄思齐,杨志敏
(1南京农业大学资源与环境科学学院,江苏南京210095;2南京农业大学生命科学学院,江苏南京210095)
磷是植物生长的一种重要营养元素。施入土壤中的磷肥大部分被土壤中的铁铝氧化物所吸附或与土壤中的钙形成沉淀,还有一部分转化为有机磷。因此,磷在土壤中的有效性较低,是造成植物缺磷的一个主要原因。在缺磷胁迫下,植物根系通常会产生大量的侧根来扩大根系在土壤中的吸收面积。由于侧根的发生与磷的有效性有很好的相关性,因此一直受到研究者的关注[1-2]。研究表明,缺磷对侧根的形成在某种程度上依赖于生长素作用;缺磷时植物侧根对生长素的敏感性提高[3],并影响生长素在根系中的分布[4]。此外,侧根发生过程中生长素信号还受到转录因子NAC1的介导,其表达强度与生长素浓度、侧根的发生量呈高度正相关[5-6]。最近在拟南芥中发现,NAC1的表达受到miR164的调控。miR164与NAC1 mRNA特异性结合,引起NAC1 mRNA降解,进而影响侧根的发育与形成[7]。但是,植物在缺磷情况下侧根发生是否与miR164及其靶基因NAC1有关,国内外尚未见报道。
MicroRNA(miRNA)是近年来在真核细胞中发现的一类内源具有调控其他基因表达的、非编码(蛋白质)的小分子 RNA,长度为20~ 24 nt[8]。目前对miRNA作用机制的研究显示,成熟的miRNA先与RISC(RNA-induced silencing complex)的复合物结合,再特异性地与碱基互补的同源mRNA配对结合,若是碱基完全互补,则引起靶 mRNA的降解[9];若miRNA与靶mRNA不完全互补时,则与对应的靶mRNA的3′端非翻译区(3′UTR)结合阻止转录后翻译[10-11]。前者主要存在于植物中,而后者主要在动物中比较常见。miRNA主要参与基因后转录水平的调控,通过调节其对应的靶基因来控制植物生长发育,包括根、叶、花和输导组织的形态发生与分化等[12-16]。此外,miRNA在调节植物对干旱、盐害及植物养分等环境胁迫的反应方面也起着重要作用[17]。番茄是一种重要的蔬果,也是研究根系形态发育(如侧根和根毛)的模式植物。因此,本试验利用番茄幼苗研究了不同供磷水平下根系的形态变化和磷素缺乏情况下侧根发生与生长素的关系,以及缺磷情况下其根系中调控生长素信号的转录因子NAC1与miR164在转录水平上的表达关系,为研究植物在缺磷胁迫下的生理机制提供依据。
1 材料与方法
1.1 材料培养和处理
番茄(Lycopersicon esculentum)品种为苏红 2008(江苏省农科院提供)。种子用2%的次氯酸钠消毒8 min,在1 mmol/L CaSO4溶液中浸泡6 h后于 22℃黑暗中发芽。2 d后将露白的种子均匀地播在漂浮于营养液面的尼龙网上。营养液组成为:0.7 mmol/L Ca(NO3)2、0.5 mmol/L NH4H2PO4、1.5 mmol/L KNO3、4.75 μ mol/L FeSO4、0.5 mmol/L Mg-SO4 、11.5 μ mol/L H3BO3 、1.25 μ mol/L MnCl2 、0.2 μ mol/L ZnSO4 、0.32 μ mol/L CuSO4 、0.025 μ mol/L H2MoO4和 4.75 μ mol/L Na2EDTA(pH 5.5)。对 于磷浓度处理,加入 0、0.005、0.05、0.5 mmol/L NH4H2PO4,不足0.5 mmol/L的部分以NH4Cl代替。植物在生长箱中培养,温度为23℃,每天光照12 h。营养液每天更换一次,到第5 d时采样分析。外加生长素抑制剂与外源生长素的浓度分别为50 nmol/L NPA与10 nmol/L NAA,在每天更换营养液时根据试验设计要求加入。由于所有番茄培养时间均为5 d,如无特别说明,则外加生长素抑制剂与外源生长素时间均为5 d,如加入时间为4 d,表示移栽1d后加入,依次类推;不加生长素抑制剂和外源生长素的为对照,试验均重复3次。
1.2 测定项目与方法
根系形态分析:将番茄幼苗在茎与根的交界处切开,根长、侧根数和侧根原基测量在体视镜下进行。根长,侧根长用直尺测量,侧根原基数在体视镜下计数。
植物磷含量测定:将幼苗在液氮中迅速冷冻,研磨后称取50 mg冻干粉溶解于50 mL 10%(v/v)TCA中,4℃往复振荡15 min。12000×g离心5 min后取上清液,用钼蓝比色法测定磷含量[18]。
根系总RNA采用Trizol(Invitrogen)提取:由于成熟miRNA片断太短,因此先对其进行polyA加尾处理[16]。 反应体系 为 25 μ L(1.5 μ g total RNAs、1 mmol/L ATP、2.5 mmol/L MnCl2和 2 U polyA polymerase),反应条件37℃60 min。加尾后的RNA直接进行反转录,反应体系为 25 μ L,其中含有12.5 μ L ployA加尾的产物,0.5 mmol/L dNTP,200 UMMLV 反转录酶(Promega),1 μ L 锚 定引物[5′-CGAACATGTACAGTCCATGGATAG d(T)30(A,G or C)(A,G,C or T)-3′],获得 cDNA 产物。以 EF-1a作为内参,其扩增所用引物为:正义链 5′-AGACCACCAAGTACTACTGCAC-3′;反 义 链 5′-CCACCAATCTTGTACACATCC-3′。扩增NAC1 的引物为:正义链 5′-CCCTTGGACTTTGATACAC-3′;反 义 链 5′-TGGCTTTCC AGTAACCAGATACG-3′。扩增miR164的引物为:正义链即为miRNA序列,反义链为加尾所含序列(5′-CGAACATGTACAGTCCATGGATAG-3′)。 反 应 体系:25 μ L[包括 10 mmol/L Tris-HCl(pH 8.3)、50mmol/L KCl、1.5 mmol/L MgCl2、0.01%Gelatin 、0.01%Triton X-100、0.2 mmol/L dNTP、2U Taq DNA polymerase(TaKaRa)、0.5mmol/L primer]。反应条件为:94℃预变性3 min。25循环:1)94℃变性,30 s;2)72℃退火,30 s;3)65℃延伸,40 s,最后保持72℃,5 min。
实验数据均使用SPSS 13.0进行统计与分析。
2 结果与分析
2.1 磷有效性对番茄幼苗根系形态的影响
番茄种子发芽后,直接转移到含有不同磷浓度的营养液中。培育5 d后发现,完全缺磷营养下的番茄幼苗侧根数量最多,平均有6条;5 μ mol/L Pi处理下的幼苗平均有5条侧根。当磷浓度达到50 μ mol/L时,侧根数目明显减少,仅有 2~3条;当磷浓度达到500 μ mol/L时,侧根数量平均为1条(图1A)。同时,侧根的总长度也随着营养液中磷浓度的升高而降低,其变化趋势与侧根数目的变化一致(图1B)。相比之下,培养5 d后主根的长度在0~5 μ mol/L磷浓度范围内无显著差异,而且比50~500 μ mol/L磷浓度下培养的主根略长一些(图1C)。幼苗体内的磷含量随着营养液中磷浓度的增高而显著增加(图1D)。
为了避免完全缺磷可能带来的其他影响,我们选取了 5 μ mol/L 和 500 μ mol/L 的供磷浓 度作为缺磷胁迫处理(-P)与供磷对照(+P)进行以下研究。
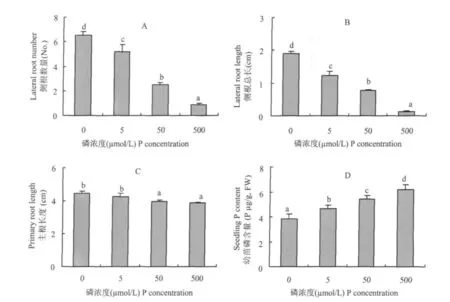
图1 不同供磷浓度下番茄幼苗的根系形态及其体内磷含量Fig.1 Morphology of root system and phosphate content of tomato seedlings cultivated under different P levels
2.2 生长素对番茄幼苗侧根发育的影响
生长素是影响根系形态变化的一个重要因素。在缺磷与供磷营养液中分别加入生长素运输抑制剂NPA和外源生长素NAA,结果发现,在外加NPA的情况下,缺磷和供磷植物的侧根发生都受到强烈的抑制,植株几乎没有长出侧根;而加入NAA后,供磷植物也产生了大量的侧根,与不加NAA的缺磷植物的侧根数目相近;缺磷植物在外加NAA的情况下,也产生了更多的侧根,并且有显著差异(图2A)。植物侧根的总长度变化在外加NPA与NAA时,与侧根的发生量变化一致(图2B)。除了侧根以外,侧根原基的数目在NPA的处理下也受到明显的抑制,外加NAA显著促进了侧根原基的数目(图2C)。
2.3 磷有效性与生长素运输对侧根发育的交互作用
为了进一步研究缺磷诱导侧根发生与生长素之间的关系,将缺磷番茄幼苗用NPA进行不同时间段的连续处理5 d。结果发现,移栽1和2 d后用NPA处理,即连续处理4和3 d,几乎完全抑制了侧根形成(图3A),侧根的伸长生长也相应地受到抑制(图3B)。相比之下,移栽3~4 d后的缺磷幼苗用NPA连续处理2和1 d,虽然也减少了侧根的形成数量,但与对照相比,仅减少了30%(图3A)。因此,第3和第4 d是侧根形成的重要时期。相对而言,侧根的伸长生长却受到了强烈的影响,表现为侧根总长度下降了80%(图3B)。为了明确生长素对侧根形成早期的调控影响,观察了NPA处理对侧根原基数量的发生的影响(图3C),结果发现,连续3和4 d的NPA处理均明显减少了侧根原基的数量,达50%以上;连续用NPA处理1及2 d对侧根原基数量的抑制分别减弱为20%和30%左右。与侧根形成数量受NPA抑制的结果相比(图3A),生长素抑制剂NPA对侧根原基是否发育成侧根的影响更大。

图2 生长素抑制剂NPA与外源生长素NAA对缺磷与供磷番茄幼苗侧根发育的影响Fig.2 Effect of NPA and NAA on the development of tomato lateral roots under P deficiency and sufficient conditions

图3 不同时间段NPA处理对缺磷番茄侧根发育的影响Fig.3 Effect of NPA on the development of tomato lateral roots under P deficiency
2.4 NAC1与miR164在侧根形成过程中的表达变化
为了验证转录因子NAC1与miR164在侧根发育过程中可能的作用,本试验观察了番茄根系侧根发生的过程。如图4A所示,番茄幼苗从第3 d开始长出侧根,到第4 d时是侧根大量形成的时期。通过半定量RT-PCR分析发现,在第3和第4 d的24 h中NAC1在缺磷植物与供磷植物的根系中的表达都有上升的趋势,但缺磷植物的NAC1表达量要明显高于供磷植物。与此同时,miR164的表达量在缺磷植物中始终低于供磷植物(图4B)。
3 讨论
土壤中磷素缺乏的主要原因是磷在土壤中容易被固定,移动性差,因此截获是植物根系获得土壤中磷素的一个主要方式。植物根系通过分枝,产生大量侧根以扩大吸收范围。本试验中,随着营养液中供磷浓度的降低,侧根数逐渐增加,侧根总长度也随之增加,与磷有效性之间体现了较好的负相关(图1)。说明外界环境中磷的有效性是决定植物根系形态变化的一个重要因素。相比之下,主根的长度与外界供磷浓度之间没有类似的关系。主根在缺磷胁迫下(0~ 5 μ mol/L)比不缺磷时(50~ 500 μ mol/L)略有伸长。类似的情况在拟南芥中也有发现[3],并且只有在供磷水平低于50 μ mol/L时,根系鲜重才显著增加;但是在各个低磷浓度处理之间无显著差异。结合本试验结果(图1A、C),在缺磷胁迫下,植物根系(包括主根与侧根)生长得到了促进;同时从图1D可知,外界磷浓度是造成植物体内磷含量差异的一个主要原因。

图4 番茄幼苗根系发育过程及其侧根发育过程中NAC1与miR164的表达变化Fig.4 Root morphology of tomato seedlings and expression pattern of NAC1 and miR164 during the development of lateral roots
根系形态的改变与外界环境中供磷水平密切相关,但最终是通过影响植物体内的激素调控来实现的。在本试验中(图2A),外加生长素运输抑制剂NPA严重抑制了缺磷植物的侧根发生,而施用外源生长素NAA则导致供磷植物也产生大量的侧根。说明缺磷时番茄幼苗侧根的生长依赖于生长素;相应的,侧根长度的变化也与此一致(图2B)。尽管侧根原基的数量变化也有上述类似的趋势(图2C),但是供磷植物所形成的侧根原基亦达到缺磷植物的75%左右,即使在加入生长素抑制剂NPA的情况下,无论供磷还是缺磷植物的侧根原基数量都没有完全受到抑制,相比之下侧根形成则完全受到抑制(图2A)。此外,即使加入了外源生长素NAA后,供磷和缺磷植物所增加的侧根原基数量也很少,这与NAA处理下侧根大量形成有着明显的差别。说明侧根原基的形成也需要生长素,但是对生长素的敏感性及依赖性不如侧根发生过程时那么强烈。由此可知,缺磷是诱导侧根原基增多的一个主要原因,缺磷信号通过植物体内的生长素使更多的侧根原基发育成侧根。
由于生长素是在植物的地上部分合成并运输到根系组织,因此生长素的极性运输决定了生长素在根系中的浓度与分布[19]。NPA是抑制生长素极性运输的一种化学试剂。通过NPA对缺磷胁迫下的番茄幼苗进行处理时发现,前期开始处理彻底抑制了侧根的形成,而后期处理则无法完全抑制侧根的形成(图3A)。表明前期处理可能导致缺磷诱导产生的生长素在向地性运输过程中受到抑制而无法在根系中积累,以至于侧根形成受阻。尽管侧根原基的数量并没有受到完全的抑制(图3C),而后期NPA处理可能无法改变根系中已有的生长素的作用,植物仍能够形成侧根。但是,由于处理后生长素的运输开始受到抑制,导致侧根形成数量减少。相比之下,无论处理时间长短,侧根的伸长生长都受到了NPA强烈的抑制(图3B),说明生长素对侧根的伸长生长影响更大。
NAC1是NAC家族中的一员,是一个转录因子,能激活生长素信号途径中两个下游基因DBP和AIR3。NAC1不仅本身受生长素诱导,同时也调控生长素信号来促进侧根的形成和发育。因此,NAC1的过表达与反义转基因拟南芥分别显示出侧根增加与侧根减少两种表型[5]。从图4A中可知,番茄幼苗生长到第3~4 d,是侧根迅速形成的主要时期。在24 h之内(图4B),无论是缺磷还是供磷植物的NAC1表达都有上升的趋势,但是缺磷植物的NAC1表达量明显高于供磷植物。因此推测,在这个侧根迅速形成的过程中,NAC1的表达增强是激活侧根发育的重要原因之一。而与NAC1互补的miR164表达水平则始终表现为缺磷处理比供磷要低,在趋势上与NAC1的表达差异相反。说明miR164在缺磷胁迫时下调,是NAC1的表达水平升高的一个重要原因,对缺磷植物大量形成侧根起到重要的调控作用。但是缺磷又是如何来调控miR164的表达,还有待进一步的研究。
[1] Sánchez-Calder ón L,López-Bucio J,Chacón-López A et al.Phosphate starvation induces a determinate developmental program in the roots of Arabidopsis thaliana[J].Plant Cell Physiol.,2005,46:174-184.
[2] 刘鹏,区伟贞,王金祥,等.磷的有效性与植物侧根的发生发育[J].植物生理学通讯,2006,42(3):395-400.Liu P,Qu W Z,Wang J X et al.Phosphorus availability and lateral root initiation and development of plants[J].Plant Physiol.Commun.,2006,42(3):395-400.
[3] López-Bucio J,Hernandez-Abreu E,Sanchez-Calderon L et al.Phosphate availability alters architecture and causes changes in hormone sensitivity in the Arabidopsis root system[J].Plant Physiol.,2002,129:244-256.
[4] López-Bucio J,Hernandez-Abreu E,Sanchez-Calderon L et al.An auxin transport independent pathway is involved in phosphate stress-induced root architectural alterations in Arabidopsis.Identification of BIG as a mediator of auxin in pericycle cell activation[J].Plant Physiol.,2005,137:681-691.
[5] Xie Q,Frugis G,Colgan D,Chua N H.Arabidopsis NAC1transduces auxin signal downstream of TIR1 to promote lateral root development[J].Genes Devel.,2000,14:3024-3036.
[6] 王友华,段留生,卢孟柱,等.NAC1上游调控区表达特征及其与侧根激素诱导的关系[J].中国科学C辑(生命科学),2006,36(3):217-222.Wang Y H,Duan L S,Lu M Z et al.Expression of NAC1 up-stream regulatory region and its relationship to the lateral root initiation induced by gibberellins and auxins[J].Sci.China Ser.C(Life Sci.),2006,36(3):217-222.
[7] Guo H,Xie Q,Fei J,Chua N.MicroRNA directs mRNA cleavage of the transcription factor NAC1 to downregaulate auxin signals for Arabidopsis lateral root development[J].Plant Cell.2005,17:1376-1386.
[8] Bartel D.MicroRNAs:Genomics,biogenesis,mechanism and function[J].Cell,2004,116:281-297.
[9] Hammond S M,Bernstein E,Beach D,Hannon G J.An RNA—directed nuclease mediates post-transcriptional gene silencing in Drosphila cells[J].Nature.2002,404:293-296.
[10] Chen X.microRNA biogenesis and function in plants[J].FEBS Lett.,2005,579:5923-5931.
[11] Zhang B,Pan X,Cobb G P,Anderson T A.Plant microRNA:A small regulatory molecule with big impact[J].Devel.Biol.,2006,289:3-6.
[12] Jones-Rhoades M W,Bartel D P.Computational identification of plant microRNAs and their targets,including a stress-inducedmiRNA[J].Mol.Cell.2004,14:787-799.
[13] Mallory A C,Vaucheret H.Functionsof microRNAs and relatedmall RNAs in plants[J].Nat Genet.,2006,38:31-37.
[14] Wang J W,Wang L J,Mao Y B et al.Control of root cap formation by microRNA-targeted auxin response factors in Arabidopsis[J].Plant Cell,2005,17:2204-2216.
[15] Zhang B,Pan X,Anderson T A.Identification of 188 conserved maize microRNAs and their targets[J].FEBS Lett.,2006,580(15):3753-3762.
[16] Zhou Z S,Wang S J,Yang Z M.Bioinformatic identification and expression analysis of new microRNAs from Medicago truncatula[J].Biochem.Biophy.Res.Comm.,2008,374:538-542.
[17] Sunkar R,Zhu J K.Novel and stress-regulated microRNAs and other small RNAs from Arabidopsis[J].Plant Cell,2004,16:2001-2019.
[18] Rytcher A M,Milkulska D D.The relationship between status and cyanide-resistant respiration in bean roots[J].Physiol.Plant.,1990,79:383-388.
[19] Narcy P,Canivenc G,Muller B et al.A role for auxin redistribution in the responses of the root system architecture to phosphate starvation in Arabidopsis[J].Plant Physiol.,2005,138:2061-2074.
