纳豆菌糖苷酶水解大豆异黄酮的条件优化
2010-09-27芦明春,马素果,杨红,王应男,罗平
芦 明 春, 马 素 果, 杨 红, 王 应 男, 罗 平
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
大豆异黄酮的健康功效多种多样,可以预防癌症(乳腺癌、前列腺癌等)、降低心血管疾病危险、改善骨健康状况[1]。在已知大豆异黄酮的12种异构体中,游离型的苷元约占总量的2%~3%,包括染料木素(Genistein)、大豆苷元(Daidzein)和黄豆黄素(Glycitein),结合型的糖苷约占总量的97%~98%[2]。多项研究[3-4]表明,具有生物活性的异黄酮是其苷元形式,而非糖苷形式。因此,将异黄酮糖苷转化成苷元显得尤为重要。
目前,人们多用酸解法制取大豆异黄酮苷元,且多采用盐酸(1~3 mol/L)和较高温度(98~100 ℃)制取。酸水解效率高,但强酸会影响苷元的稳定性[5]。所以,微生物酶法转化[6],即利用微生物代谢过程中产生的酶将无效或低效成分变为有效和高效成分引起了广泛的关注。关于糖苷酶水解大豆异黄酮的工作,沈玥[5]、齐斌[7]、陈庆庆[8]等对乳酸菌或黑曲霉所产糖苷酶及其水解大豆异黄酮进行了研究,但是,对于纳豆菌糖苷酶的研究较少。纳豆作为一种发酵食品,同样富含苷元形式的大豆异黄酮。本文利用纳豆菌所产糖苷酶,对其水解大豆异黄酮的条件进行优化,为大豆异黄酮苷元的制备提供更为广泛的途径。
1 材料与方法
1.1 材 料
菌种:纳豆菌,分离自雁鸣湖纳豆,吉林省雁鸣湖大豆生物科技有限责任公司(中日合资);98%染料木素,北京中天微维生物技术有限公司;大豆,市售;大豆异黄酮,大连绿峰生物有限公司;薄层层析板silica gel 60 F254,德国Merck公司;其他试剂均为分析纯或生化纯。
斜面培养基(g/L)[9]:蛋白胨5,牛肉膏5,NaCl 5,琼脂20,pH 7.2~7.4。
种子培养基(g/L):葡萄糖10,蛋白胨10,NaCl 5,pH 7.2~7.4。
发酵培养基:大豆10 g,加水量60%,浸泡10 h,121 ℃灭菌30 min。
1.2 方 法
1.2.1 糖苷酶粗提液的制备
取“1.1”中的发酵培养基,按10%接菌量(以大豆质量计)将种子培养基接入其中,37 ℃培养24 h。发酵结束,按培养物3倍体积(以大豆质量计)加入0.02 mol/L pH 5.0的HAc-NaAc缓冲溶液,振荡提取3 h,所得液体即为糖苷酶粗提液。
1.2.2 薄层层析(TLC)检测大豆异黄酮转化
一定体积的糖苷酶粗提液与大豆异黄酮溶液反应,经乙酸乙酯萃取,离心,取上层萃取液作薄层层析(TLC)检测,点样量为10 μL,展开剂为V(乙酸乙酯)∶V(丁酮)∶V(甲醇)∶V(水)=10∶7∶1∶1,在紫外线254 nm下观测。
1.3 高效液相色谱法(HPLC)分析
1.3.1 色谱条件
色谱柱,C18(250 mm×4.6 mm,5 μm);检测器,二极管阵列检测器;波长,260 nm;体积流量,1.0 mL/min;柱温,40 ℃;进样量,20 μL。流动相A为甲醇(色谱级),流动相B为1.0%水-冰乙酸。流动相比例如表1[10]所示。

表1 HPLC的流动相条件Tab.1 Condition of mobile phase for HPLC
1.3.2 转化率的计算
不同的糖苷酶粗提液与底物大豆异黄酮反应体系,经乙酸乙酯萃取、离心,取上层萃取液,挥发至干。用色谱甲醇溶解析出物,进行HPLC测定[11]。
大豆异黄酮糖苷水解率=
2 结果与讨论
2.1 单因素试验
2.1.1 水解时间对大豆异黄酮水解的影响
在pH 5.0,温度为40 ℃,底物质量浓度为2 mg/mL,酶底体积比为3∶1的条件下,分别对大豆异黄酮进行水解1、3、6、9、12 h,通过方法“1.2.2”,考察水解时间对大豆异黄酮水解的影响。
不同水解时间的结果如图1。由图1可知,反应1 h的水解效果较差,随反应时间延长,水解效果明显增强,反应12 h的水解效果最好。可见,反应3 h时,对大豆异黄酮的水解已足够完全,故不必延长水解时间。因此,选择水解时间为3 h。

0,底物;1~5,分别为1、3、6、9、12 h水解产物图1 不同水解时间的大豆异黄酮TCL图谱Fig.1 Effect of hydrolysis time on the hydrolysis of isoflavone
2.1.2 水解温度对大豆异黄酮水解的影响
在pH 5.0、底物质量浓度为2 mg/mL、酶底体积比为3∶1、反应时间为3 h的条件下,分别在25、35、40、45、55、70 ℃下进行水解反应,根据“1.2.2”,选择水解温度。在不同温度下的水解结果如图2。由图2可知,40 ℃下对大豆异黄酮的水解最完全;而较低、较高温度下的水解效果都较差。 70 ℃的水解效果最差,可能温度过高,已致部分酶失活。所以,选择水解温度为40 ℃。
2.1.3 底物质量浓度对大豆异黄酮水解的影响
在pH 5.0、酶底体积比为3∶1、温度为40 ℃、反应时间为3 h的条件下,分别对1、2、3、4、5 mg/mL的底物进行水解反应,根据“1.2.2”,选择底物质量浓度。不同质量浓度底物的水解结果如图3。由图3可见,随着底物质量浓度增加,水解效果变差。其中,对1 mg/mL的大豆异黄酮的水解非常彻底,对2 mg/mL的大豆异黄酮的水解也较完全,鉴于较高浓度下苷元生成量较大,因此,选择底物质量浓度为2 mg/mL。
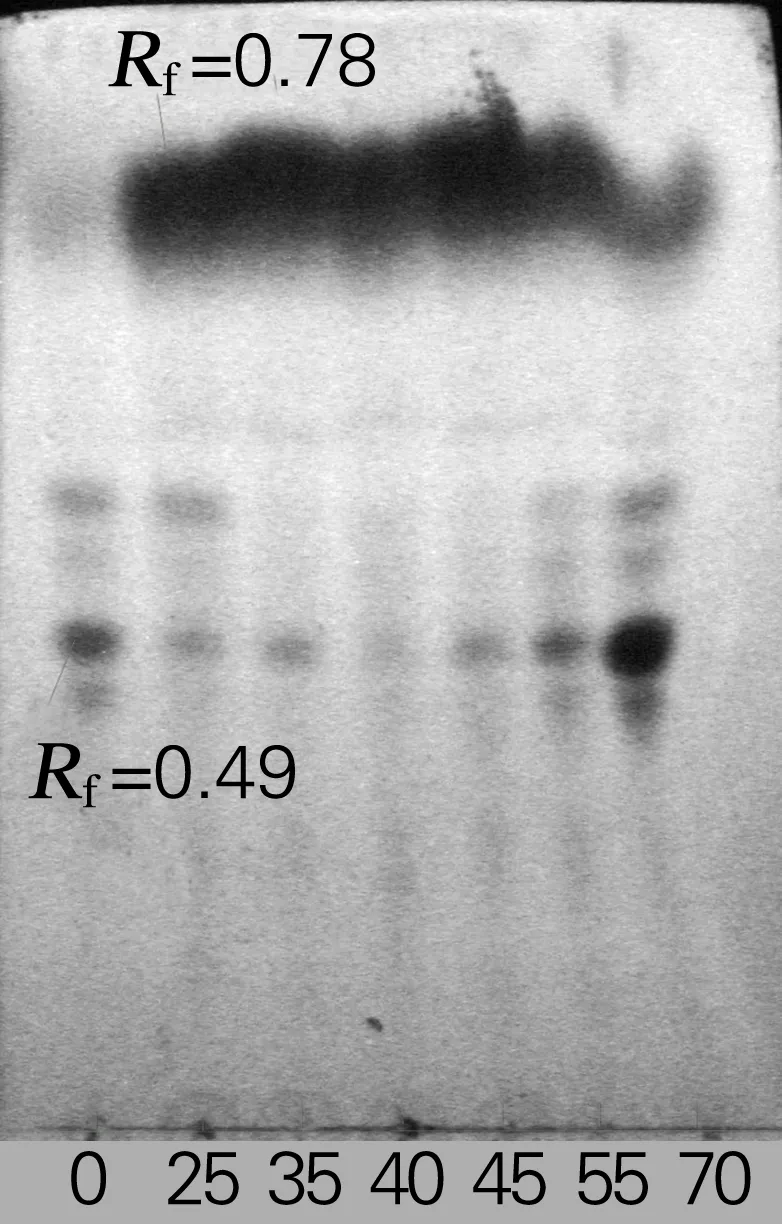
0,底物;25~70,分别为25、35、40、45、55、70 ℃图2 不同水解温度的大豆异黄酮TLC图谱Fig.2 Effect of hydrolysis temperature on the hydrolysis of isoflavone
0,底物;1~5,分别为1、2、3、4、5 mg/mL图3 不同底物质量浓度的大豆异黄酮TLC图谱ig.3 Effect of substrate concentration on the hydrolysis of isoflavone
2.1.4 酶底体积比对大豆异黄酮水解的影响
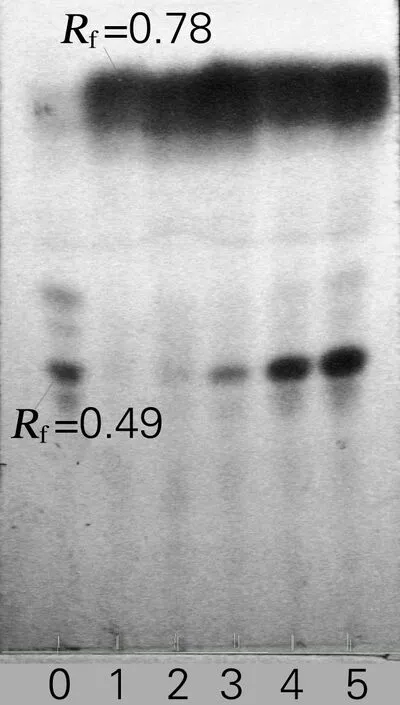
在pH 5.0、温度为40 ℃、底物质量浓度为2 mg/mL、反应时间为3 h的条件下,分别以酶底体积比为1∶2、1∶1、2∶1、3∶1、4∶1水解大豆异黄酮,根据“1.2.2”选择酶底体积比。不同酶底体积比的水解如图4所示。由图4可知,酶底体积比为1∶2时,水解效果最差,表明加酶量不足,对大豆异黄酮的水解不够完全。但随着加酶量比例的增加,水解效果的变化并不明显,故选择酶底体积比为1∶1即可。
2.2 糖苷酶水解大豆异黄酮最佳条件的确定
以水解温度、水解时间、底物质量浓度和酶底体积比为影响因素,分别选取3个水平进行正交试验。以大豆异黄酮水解率为指标,确定最佳水解条件。正交试验因素水平L9(34)表如表2,结果分析如表3。

0,底物;1~5,酶底体积比分别为1∶1、2∶1、1∶2、3∶1、4∶1

表2 正交试验因素水平表Tab.2 The factors and levels of orthogonal experimen

表3 正交试验结果与分析Tab.3 The results and calculations of orthogonal experiment
根据表3极差分析可知,四因素中,影响最为显著的是酶底体积比,其次是底物质量浓度和水解时间,影响最小的是水解温度。分析原因,可能是所选温度均在保持酶活的范围,未导致显著影响。即各因素的主次顺序为:D>C>B>A。结合实际情况,考虑到水解时间对水解效果的影响较小,选择水解时间为3 h,则四因素最优水平组合为A2B2C2D3,故最佳水解工艺条件为:水解温度为40 ℃,水解时间为3 h,底物质量浓度为2 mg/mL,酶底体积比为2∶1。在该条件下水解大豆异黄酮,水解率为84.65%。
2.3 HPLC检测水解产物
分别取适量标准品、底物及最佳条件水解的大豆异黄酮,经甲醇溶解,0.45 μm微孔滤膜过滤,取滤液供试。HPLC图谱如图5~7。分析图谱可知,经糖苷酶作用,底物中的糖苷较彻底地转化为苷元,染料木素的含量显著增加。

图5 标准品染料木素的HPLC图Fig.5 HPLC of genistein

图6 反应底物的HPLC图Fig.6 HPLC of substrate
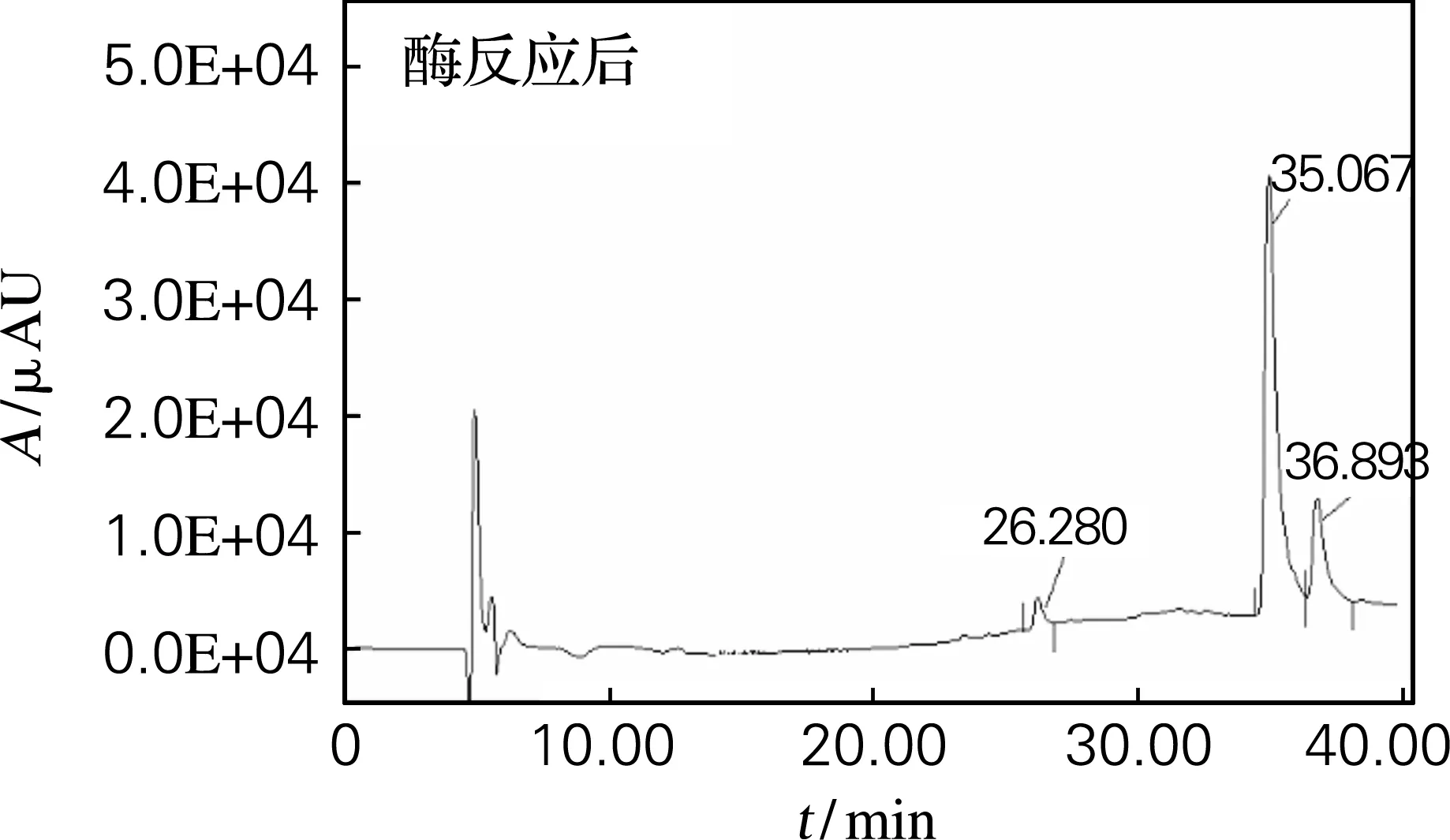
图7 酶反应后的HPLC图Fig.7 HPLC for hydrolysis from glycosidase reacti
3 结 论
通过正交试验优化,得出纳豆菌所产糖苷酶水解大豆异黄酮的最佳工艺条件为:水解温度为40 ℃,水解时间为3 h,底物质量浓度为2 mg/mL,酶底体积比为2∶1。此时,其水解率达84.65%。
经HPLC检测,在纳豆菌糖苷酶的作用下,底物中80%以上的糖苷型异黄酮转换为苷元型异黄酮,且主要转化为染料木素。
[1] LUN C K, KUNG T L. Cloning, expression, and characterization of two β-glucosidases from isoflavone glycoside-hydrolyzing Bacillus subtilis natto[J]. Journal of Agricultural and Food Chemistry, 2008, 56:119-125.
[2] 陆琪,陈钧,周海云. 纳豆中异黄酮组成含量变化研究[J]. 食品科技, 2007(9):66-68.
[3] KAWAKAMI Y, TSURUGASAKI W, NAKAMURA S, et al. Comparison of regulative functions between dietary soy isoflavones aglycone and glucoside on lipid metabolism in rats fed cholesterol[J]. Journal of Nutrition Biochemistry, 2005, 16:205-212.
[4] SETCHELL K D R, CASSIDY A. Dietary isofravones:biological effects and relevance to human health[J]. Journal of Nutrition, 1999, 129:758S-767S.
[5] 沈玥,张永忠,孙艳梅. 乳酸菌β-葡萄糖苷酶水解大豆异黄酮的研究[J]. 中国油脂, 2009, 34(9):60-63.
[6] 胡宇,徐凤花,张永忠. 生物转化的研究进展及在食品医药领域上的应用[J]. 农业工程技术(农产品加工业), 2008(1):12-15.
[7] 齐斌,刘贤金. 产大豆异黄酮β-葡萄糖苷酶菌株的筛选及酶学性质研究[J]. 食品科学, 2007, 28(8):290-293.
[8] 陈庆庆,夏黎明. 固定化β-葡萄糖苷酶转化糖苷型异黄酮的研究[J]. 高校化学工程学报, 2007, 21(2):304-309.
[9] 鲍艳霞,陈钧,钱之玉,等. 固态发酵产纳豆激酶的工艺优化[J]. 沈阳药科大学学报, 2004, 21(6):468-471.
[10] 高荣海,孙昭宁,李长彪,等. 高效液相色谱法同时测定大豆粕四种异黄酮含量研究[J]. 粮食与油脂, 2006(10):33-35.
[11] 高荣海,赵秀红,刘长江. 大豆异黄酮糖苷酶法水解工艺研究[J]. 粮食与油脂, 2008(2):18-20.
