靶向口蹄疫病毒IRES区RNA干扰位点的选择及shRNA表达载体的构建与鉴定*
2010-09-26崔丽瑾王兴龙任林柱李晓艳郎需龙张付贤王英超
崔丽瑾,王兴龙,2*,任林柱,李晓艳,郎需龙,张付贤,王英超
(1.军事医学科学院军事兽医研究所,吉林长春 130062;2.吉林大学人兽共患病研究所,吉林长春 130062;3.吉林大学畜牧兽医学院,吉林长春 130062)
口蹄疫病毒(Foot-and-m outh disease virus,FMDV)是小RNA病毒科的典型代表,引起偶蹄动物的急性接触性传染病。由于其血清型众多,变异频繁,各血清型之间没有交叉保护,给该病的防控造成很大困难。2009年1至4月份,我国南方的多个省份相继发生A型、亚洲1型口蹄疫疫情,对口蹄疫防控策略的研究更加紧迫。RNA干扰(RNA interference,RNAi)是小的短双链 RNA,即小干扰RNA(small interfering RNA,siRNA)介导的对靶基因转录后水平的抑制作用,该作用具有高度特异性,已被广泛作为肿瘤治疗和抑制病毒感染的特异性手段,并取得了良好的进展。
FMDV基因组为单股正链 RNA,全长约8.5 kb,可直接作为信使RNA,是RNAi作用的适合对象。FMDV具有小RNA病毒的共同特征,其RNA的5′末端没有帽子结构[1],蛋白翻译起始于5′非翻译区中的内部顺式调控元件,即内部核糖体进入位点(IRES)。目前已证实IRES是FMDV基因组中存在的惟一一个蛋白翻译顺式调控元件,它以某种特殊的机制关闭宿主细胞的蛋白合成来合成病毒自己所需的蛋白质,完成病毒的复制和装配,并导致机体的一系列病理损害。鉴于 IRES在FMDV复制过程中所起的关键作用,本研究对其序列的保守性和二级结构进行了分析,筛选了2个RNA干扰靶位,并构建了shRNA真核表达载体,为进一步研究针对IRES区域的RNA干扰效果、构建口蹄疫病毒RNAi技术体系提供一定的理论依据和试验基础。
1 材料与方法
1.1 材料
FMDV WFL株cDNA序列(GenBank登录号:EF175732,由军事医学科学院军事兽医研究所第五研究室获得),大肠埃希菌(E.coli)DH 5α、载体pSilerncer 1.0-U6(Am bion公司)由军事医学科学院军事兽医研究所动物性食品安全研究室第五研究室保存。T4 DNA ligase为Promega公司产品,限制性内切酶、DNA M arker、DNA 凝胶回收纯化试剂盒均为宝生物工程(大连)有限公司产品,LB培养基为OXOID公司产品。
1.2 方法
1.2.1 FMDV IRES序列保守性分析 随机选取了GenBank上发表的7个血清型的FMDV IRES区段的cDNA序列28条,与试验用WFL株的相应区段用DNA Star进行同源性比对,考察序列的保守性,并寻找最保守的区域。
1.2.2 FMDV IRES序列二级结构及功能区分析利用网上RNA secondary structure prediction工具对 WFL株 IRES序列进行二级结构预测(http://www.genebee.msu.su/services/rna2-re-duced.htmL),并结合国内外对IRES二级结构及功能区域的研究结果,共同作为siRNA靶序列选择的参考依据。
1.2.3 siRNA靶序列的选择 将试验用FMDV WFL株IRES的 cDNA序列提交Ambion公司的网上siRNA在线设计软件(http://www.abmion.com/tech lib/m isc/siRNA finder.htmL),在给出的候选干扰靶序列中选择GC%在30%~60%之间、并经网上Blast检验,保留与宿主基因无明显同源性的序列,参考1.2.1和1.2.2的分析结果,作为理论筛选确定的siRNA靶序列。
1.2.4 shRNAs表达质粒的构建 根据U 6载体要求,将选择的siRNA序列设计成shRNA表达模板的DNA插入序列,由上海生工生物工程技术服务有限公司分别合成61 nt的shRNA编码链和53 nt的互补链DNA,退火后连接U6载体大片段。将连接产物转化DH 5α感受态细菌,涂布于含Amp+的LB琼脂平板,挑取单个菌落扩大培养,小量提取质粒[2]进行酶切鉴定并交上海鼎安生物科技公司测序。
2 结果
2.1 FMDV IRES序列的保守性分析
本试验所使用的FMDV WFL株为O型,其全长为8 155 nt,其中,IRES序列在WFL株全基因组中的位置为 602 nt~1 039 nt,长度为 458 nt。经DNA Star比对,与GenBank上发布的7个血清型FMDV基因组的相应序列的同源性在73.5%~100%之间,特别是除南非(SAT)Ⅰ、Ⅱ、Ⅲ之外的O、A、C和A sia 1型之间的同源性高于86.4%,说明FMDV的IRES区段保守性较好,适合作为RNA i的靶区段。
2.2 FMDV WFL株IRES序列二级结构预测及功能区分析结果
利用网上在线 RNA secondary structure prediction工具对WFL株IRES序列进行了二级结构预测,结果见图1。从图1中可以看出,IRES序列在不同部位形成了茎(stem region)和环结构,siRNA序列的选择应尽量避开复杂的二级结构,选择容易结合的环(loop region)部。Pilipenko E V等[3]对3株脑心肌炎病毒、3株FMDV和3株Theiler鼠脑心肌炎病毒的IRES二级结构分析表明,上述毒株的IRES均具有相同的5个结构域的折叠。而且上述毒株的IRES二级结构拥有部分相同的单链序列。张显升等[4]的研究表明,通过 IRES二级结构分析,第72、164、207、208、377和406位点均位于所有毒株IRES二级结构的环中。而 IRES的第373~405位非常保守,序列为TTCTT(A)TAAAAGC(T)GC(T)CCC(T)AGTTTAAAAAGCTTCTA,此区域的A/T含量高达73%,而且在这个区域的两翼富含G/C。因此,推断这个区域可能是FMDV的复制原点(病毒编码的依赖RNA的RNA聚名酶结合位点),或是与翻译起始或某些蛋白因子的识别或结合有关的位点[5]。

图1 IRES序列的二级结构预测效果图Fig.1 The secondary structure prediction of IRES sequence
2.3 靶序列的选择结果
参照Am bion公司的 siRNA在线设计软件给出WFL株的IRES序列的siRNA干扰靶序列结果,经Blast检验,去除与宿主存在同源的序列,结合序列保守性分析、基因序列功能区分析,确定了分别针对265 nt~283 nt和395 nt~413 nt的2个siRNA干扰靶序列,分别处于在图1上标注的 A(IRES-12)和B(IRES-20)位置,其核酸序列见表1,其中IRES-20位于多分支环(m ultibranched loop)中,属于siRNA最易结合部位;IRES-12位于发夹环(hairpin loop)中,属于比较易结合部位。其保守性分析结果如图2所示,可见 IRES-12、IRES-20在7个血清型间都表现出很高的同源性。
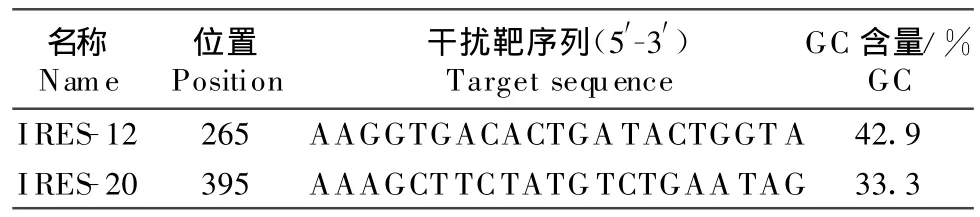
表1 siRNA的靶序列Table1 Target sequences of siRNA
2.4 pSilencer 1.0-U6-shRNA表达质粒的构建及鉴定
合成的单链DNA插入序列为由9 nt的非互补碱基(即小发夹结构的“环”)分割的反向互补序列,以保证在U 6启动子指导下转录成单链时,能按碱基互补原则形成小发夹结构的RNA分子(shRNA)(表2)。互补的DNA模板退火后分别形成ApaⅠ和Eco RⅠ酶切位点的黏性末端,与同样经 ApaⅠ和Eco RⅠ双酶切线性化的pSilencer1.0-U 6载体片段连接,小提重组质粒以 Hin dⅢ酶切进行初步鉴定,证明外源片段已连入载体(图3),之后,经测序和序列分析,表明 shRNA表达片段插入正确,U6启动子序列无突变发生,图4为测序峰图,序列下划线部分为插入序列的茎环部。

图2 siRNA靶序列同源性分析结果Fig.2 H om ology analysis for target sequences of siRNA

表2 针对载体pSilencer1.0-U6表达shRNA的DNA插入序列Table2 DNA insert sequences exp ressing shRNAs for the vector pSilencer1.0-U 6

图3 重组质粒酶切鉴定结果Fig.3 Identification of recombinant plasm ids by endonu clease digestion

图4 重组质粒插入序列部分的测序峰图Fig.4 Sequencing diagram of the insert sequence of recombinan t plasm id
3 讨论
RNA干扰对靶RNA的降解,不仅能够抑制病毒蛋白成分的产生,同时能够直接减少病毒的数量,并抑制其在细胞内的复制,达到最终清除病毒的目的,因此其对病毒性疾病的防控具有重要的临床应用价值。国内外一些学者已经开展了关于FMDV的RNA i的研究,但因所选择的siRNA的序列不同,所报道的对 FMDV的抑制效果差异很大。Ronen K等[6]报道针对FMDV 3B和3D基因设计的siRNA对FMDV的抑制效率可达100%。Chen W Z等[7]研究了siRNA对FMD表面抗原蛋白VP1基因的抑制作用,结果表明,在BHK-21细胞中siRNA表达质粒可使FMDV VP1基因的表达降低80%~90%。de Los Santos T等[8]证明针对FMDV基因非编码区设计的shRNA可有效地抑制多种血清型的FMDV复制。
由于FMDV像其他的RNA病毒一样,具有很高的遗传多态性,迄今为止,血清学分析发现了多达7种的血清型和超过60种的亚型,而且,每个亚型都有许多基因组变异的毒株[9]。因此,针对病毒基因组的保守区域设计siRNA是利用RNA干扰技术抑制病毒增殖的关键。其干扰靶序列的保守性越高,作用于各种血清型的干扰潜力就越大。
IRES是小RNA病毒翻译起始的调控元件,在FMDV复制过程中起着非常重要的作用。张显升等[4]对China/99等包括 O、A、Asia I等血清型的8条FMDV IRES序列进行了比对,发现China/99株与 O1 K 、O1 Campos、A sia 1 、A 24、A 12、TWCP/97和TW TY/97等7个毒株的IRES核苷酸序列无明显的差异,表明该段序列较为保守。从本研究给出的序列比对直观结果(图2)可以看出,所选siRNA干扰靶位点序列大部分在流行较为广泛的O、A、C、Asia 1型之间保守性比较高,也有部分序列在7个血清型都呈现较好的保守性,说明所选择的siRNA序列有很好的干扰FMDV复制的潜力。虽然有悖于干扰设计时选用编码这为靶位的一般原则,但该区域的高度保守性及重要功能决定了它可以作为干扰的理想靶位。
研究还表明,在m RNA中局部形成的二级结构会影响siRNA的靶位点可及性[10],因此,正确地预测m RNA二级结构的能力,可能是获得高效siRNA的一个重要因素。Hellen C V等[11]根据对一级结构的序列、结构和二级结构的系统变异分析,报道过小RNA病毒科的IRES至少有两种类型的二级结构图形。他提到,由于都是以专业软件进行的二级结构预测,因此还无法断定何种二级结构最为正确,但二级结构的预测却能为今后的研究提供必不可少的依据。本研究利用网上专业工具对IRES的RNA二级结构进行预测,以便考察备选的siRNA序列在基因序列二级结构中的大致位置,为干扰位点的选择提供了一种参考依据。
目前,RNAi技术的应用研究发展迅速,然而并非所有指向靶基因的siRNA在导入细胞后都能够产生RNAi,其中siRNA序列的设计、筛选和导入都非常关键。siRNA的有效性高度依赖其特定靶位点的确定,而关于siRNA序列的选择,目前尚无完全统一的准则,几大研究机构的网站及公司的设计软件设计的siRNA的序列也有不统一之处。本研究通过对IRES序列的全面分析,选择了针对FMDV复制的重要功能区,且高度保守、易于结合的2个干扰靶位,构建了shRNA表达质粒,利用这种具有反折结构的DNA模板可以在哺乳动物细胞中转录成众多的shRNA,启动RNAi的效应,避开了RNA操作的困难,为应用RNA i技术防控和抑制FMDV感染进行了有益探索。
[1]Sangar D V,Row lands D J,Brow n F,et al.Protein covalen tly linked to foot-and-mouth disease virus RNA[J].Nature,1977,268(5621):648-650.
[2]萨姆布鲁克 J,拉塞尔 DW.分子克隆实验指南[M].3版.黄培堂,译.北京:科学出版社,2002:30-32.
[3]Pilipenko E V,Blinov V M,Chernov B K,etal.Conservation of the secondary structure elements of the 5′-un translated region of cardio-and aph thovirus RNAs[J].Nucleic Acids Res,1989,17(14):5701-5711.
[4]张显升,任 艳,魏艳丽,等.小RNA病毒蛋白翻译调控元件研究进展[J].中国生物工程杂志,2004,24(6):6-11.
[5]孙乃恩,孙东旭,朱德煦.分子生物学[M].江苏南京:南京大学出版社,1996:7-200.
[6]Kahana R,Kuznetzova L,Rogel A,et al.Inhibition of footand-mouth disease virus replication by sm all in terfering RNA[J].JGen V irol,2004,85:3213-3217.
[7]Chen W Z,YanW Y,Du Q Y,et al.RNA Interference targeting VP1 inhibits foot-and-mouth disease virus replication in BHK-21 cellsand suck ling m ice[J].JV irol,2004,78(13):6900-6907.
[8]de Los Santos T,W u Q H,de Avlia Botton S,et al.Short hairpin RNA targeted to the high ly conserved 2B nonstru ctural p rotein coding region inhibits replication of m ultiple serotypes of foot-and-mouth disease virus[J].V irology,2005,35(2):222-231.
[9]Sob rino F,Saiz M,Jim enez-C lavero M A,et al.Foot-andm ou th disease virus:a long know n virus but a cu rrent th reat[J].Vet Res,2001,32:1-30.
[10]K retschmer-Kazem i Far R,Sczakiel G.The activity of siRNA in mamm alian cells is related to structu ral target accessibility:a comparison w ith antisense oligonuc leotides[J].Nuc leic Acids Res,2003,31:4417-4424.
[11]Hellen C V,Wimm er T.T ranslation of encephalomyocarditis virus RNA by in ternal ribosome en try[J].Curr Top M icrobiol Imm unol,1995,203:31-63.
