清洁催化氧化合成己二酸
2010-09-26魏莉陈梅刘娜王少君王吉峰
魏莉,陈梅,刘娜,王少君,王吉峰
(大连工业大学 化工与材料学院,辽宁 大连 116034)
0 引言
己二酸是重要的有机化工原料和中间体,主要用于生产尼龙-6,6纤维、尼龙-6,6树脂、聚氨酯、泡沫塑料等,需求量逐年增加。传统的硝酸氧化法由于设备腐蚀严重,并产生大量的N2O污染物,已不满足21世纪绿色化工的要求。以过氧化氢水溶液氧化环己烯合成己二酸的副产物只有水,可以实现清洁生产,具有良好的开发前景,成为近年的研究热点[1-3]。但是,目前报道的催化剂主要是NaWO4·2H2O,催化体系中大多使用有机溶剂、相转移剂、助剂或有机酸配体[4-6],在绿色溶剂离子液体中的研究少有报道[7]。本文研究在不使用有机溶剂的情况下,以30%的H2O2为氧化剂,在常规离子液体和酸性离子液体中,考察磷钨酸催化氧化环己烯合成己二酸的活性。
1 实 验
1.1 原 料
N-甲基咪唑、溴丁烷、溴己烷、30%的过氧化氢、环己烯、磷钨酸,均为分析纯、市售。
1.2 合成方法
1.2.1 [Hmim]HSO4离子液体的制备
在N2保护的四口烧瓶中,加入8.2g N-甲基咪唑(7.9mL,0.1mol),置于冰水浴中冷却到0~5℃。剧烈搅拌下用恒压滴液漏斗滴加10.2g 98%浓硫酸和10.0mL水的混合液,室温继续搅拌2h,反应物在75℃减压除水,即得到无色透明液体[Hmim]HSO4。
1.2.2 [Bmim]Br离子液体的制备
在N2保护的三口烧瓶中,加入8.2g N-甲基咪唑(7.9mL,0.1mol)、溴代正丁烷(10.7mL,0.1mol)和正庚烷溶剂0.5mL,在80℃加热搅拌至回流,反应18h后冷却至室温,分液取出烧瓶下层的黏稠液体([Bmim]Br的粗产物),再用乙酸乙酯洗涤除去未反应的溴代正丁烷,然后经减压蒸馏获得白色固体[Bmim]Br。
1.2.3 [Bmim]CF3COO离子液体的制备
在装有搅拌器、回流冷凝管、温度计和恒压滴液漏斗的四口烧瓶中,加入[Bmim]Br 0.5mol,冰水浴冷却30min,用滴液漏斗慢慢滴加三氟乙酸57.0g(0.5mol),滴加完毕后慢慢升至室温,继续反应2h,反应结束后即得[Bmim]CF3COO离子液体。
1.2.4 [Hmim]Br离子液体的制备
在装有搅拌器、回流冷凝管、温度计和氮气导管的四口烧瓶中,加入8.2g N-甲基咪唑(7.9mL,0.1mol)、溴代正己烷(16.8mL,0.12mol)及正庚烷溶剂0.5mL,在N2保护下加热至回流,70℃搅拌反应24h,冷却后取出下层的酒红色黏稠液体([Hmim]Br粗产品)。少量乙酸乙酯反复洗涤除去未反应的溴代正己烷,用旋转蒸发除去溶剂,然后减压蒸馏后得到产物[Hmim]Br。
1.2.5 己二酸的合成
向三口烧瓶内加入0.72g磷钨酸(约0.25mmol),44.5mL 30%的过氧化氢、一定量的离子液体,加入到配有搅拌功能的250mL三口烧瓶内,调节好转速。搅拌15min后,再加入10.5mL环己烯(约0.1mol),控制好温度,回流6~10h。反应结束后得到透明溶液,将其放入冰箱中冷藏,保持0~5℃,静止12h后,有大量己二酸白色晶体析出,减压抽滤得到白色晶体。
2 结果与讨论
2.1 产物的鉴定
产物的红外光谱如图1所示,特征峰2 500~3 000cm-1为羧基上O—H的伸缩振动,1 694cm-1非常吻合,可确定产物为己二酸;产物在XT5型显微熔点测定仪上测定熔点为150~152℃,这和己二酸的文献值[2](152℃)接近,说明产物的纯度较高。
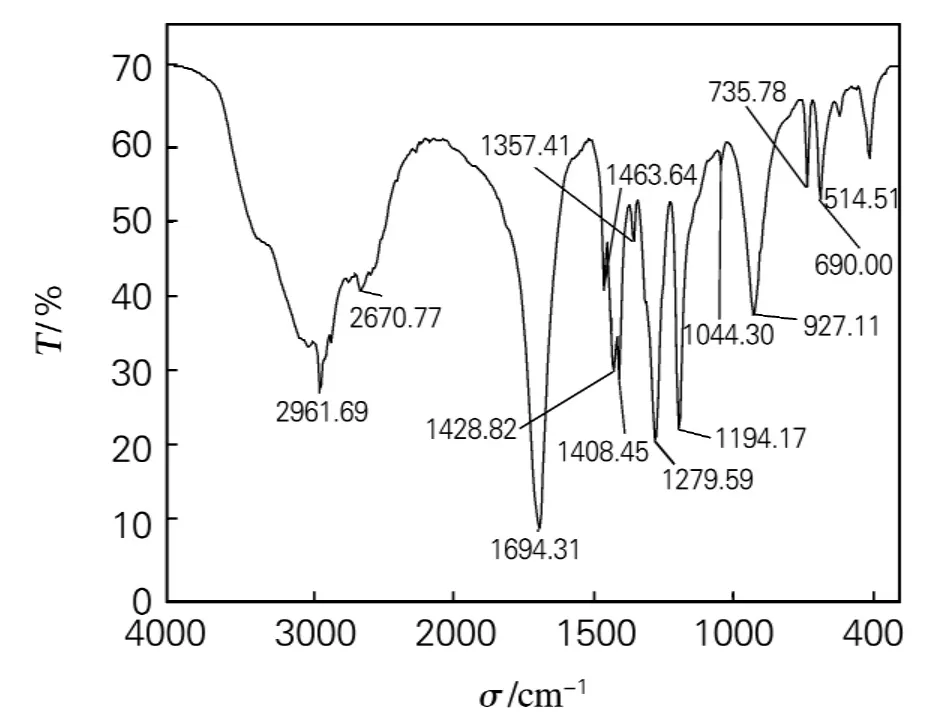
图1 产物己二酸的红外光谱图Fig.1 IR spectra of adipic acid
2.2 不同离子液体对环己烯氧化合成己二酸的影响
表1给出了不同离子液体对磷钨酸催化环己烯氧化合成己二酸活性的影响结果。从表1数据可以看出,在离子液体[Bmim]Br或[Hmim]Br中,反应结束后分别得到橙色和淡红色溶液,将溶液置于0~5℃环境中,并无己二酸晶体析出。对溶液进行红外光谱检测,体系中有己二酸产品,但由于其含量较少,在此离子液体体系中没有析出。

表1 离子液体对磷钨酸催化环己烯氧化合成己二酸活性的影响Tab.1 Effect of ionic liquids on the activity of H3PW12O40oxidation of cyclohexene into adipic acid
在[Hmim]CF3COO和[Hmim]HSO4离子液体中,将反应结束后的溶液置于0~5℃环境中,有大量己二酸晶体析出,分离产物己二酸的收率分别为53.58%和63.77%,相对于未加离子液体的反应,催化活性明显提高,这说明[Hmim]HSO4和[Hmim]CF3COO离子液体的酸性对磷钨酸催化反应有促进作用,离子液体[Hmim]HSO4的酸性要比[Hmim]CF3COO酸性强,以前者为反应介质得到的己二酸收率比后者要高一些。
2.3 离子液体用量对环己烯氧化的影响
图2给出了离子液体用量对环己烯氧化反应的影响。从图2可以看出,随着离子液体的量不断增加,己二酸的产率不断增加。当离子液体的用量为0.75mmol时,再增加离子液体的量,己二酸的收率变化不大。

图2 离子液体用量对环己烯氧化的影响Fig.2 Effect of the amount of ionic liquids on the cyclohexene oxidation
2.4 反应温度对环己烯氧化的影响
表2给出了反应温度对环己烯氧化反应的影响。从表中数据可以看出,在60℃时,反应结束后,己二酸不能在体系中析出,产品产率较低。随着反应温度的升高,己二酸产率有所增加,当温度达到80℃左右时,己二酸的收率最高,为63.77%。当温度再继续增加达到90℃以上时,己二酸的收率降低,这可能是由于温度高,氧化剂H2O2逐渐分解,影响氧化反应效果。

表2 反应温度对环己烯氧化的影响Tab.2 Effect of the reaction temperature on the cyclohexene oxidation
2.5 反应时间对环己烯氧化的影响
图3给出了反应时间对环己烯氧化反应的影响。由图3可以看出,反应时间6h,产品收率很低,随着反应时间的增长,收率提高,在10h左右,其效果最明显,再增加时间,产品收率有减小的趋势,这有可能是生成的己二酸又转化成其他的副产物,从而影响了己二酸的收率。

图3 反应时间对环己烯氧化的影响Fig.3 Effect of the reaction time on the cyclohexene oxidation
2.6 催化剂的循环
反应结束将产品己二酸滤出后,将含有催化剂的离子液体相浓缩到5mL,然后加入H2O2和环己烯按“1.2.5”前的操作进行,催化剂的循环使用结果见表3。催化剂重复使用3次,催化活性基本不变。
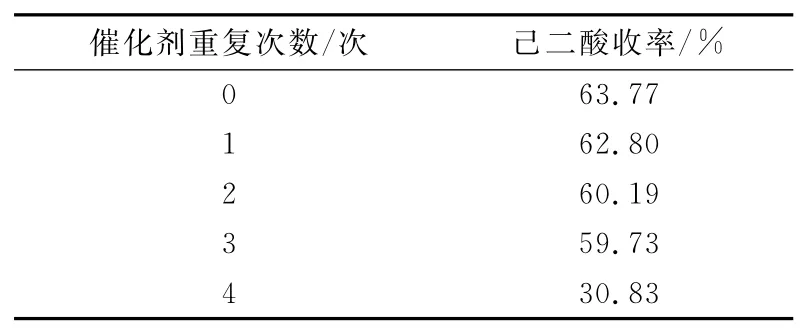
表3 催化剂的循环使用Tab.3 Recycling of the catalyst system
3 结论
以30%过氧化氢为氧源,以磷钨酸为催化剂,当n(催化剂)∶n([Hmim]HSO4)∶n(环己烯)∶n(H2O2)=1∶3∶400∶1 760时,反应温度80℃,反应10h,己二酸的产率为63.77%。离子液体酸性对反催化效果影响较大,含有催化剂的离子液体旋转蒸发浓缩至一定浓度循环使用3次,催化活性基本保持不变。
