5-甲基-4-乙氧羰基-3-腈基-2-对氯苯甲胺基呋喃的合成及其与牛血清白蛋白的相互作用
2010-09-25翟海燕孙绍发
李 艳,翟海燕,孙绍发
(1.咸宁学院化学与生命科学学院,湖北咸宁437100;2.广西质量技术工程学校,南宁替换为 530022)
5-甲基-4-乙氧羰基-3-腈基-2-对氯苯甲胺基呋喃的合成及其与牛血清白蛋白的相互作用
李 艳1,翟海燕2,孙绍发1
(1.咸宁学院化学与生命科学学院,湖北咸宁437100;2.广西质量技术工程学校,南宁替换为 530022)
合成了一种新型的5-甲基-4-乙氧羰基-3-腈基-2-对氯苯甲胺基呋喃有机化合物,通过核磁共振、红外光谱及质谱等对其结构进行了表征;应用荧光光谱及紫外可见光谱法研究了该化合物(CAF)与牛血清白蛋白(BSA)之间在不同温度下的相互作用.实验表明,CAF能强烈猝灭BSA的内源荧光,猝灭机理为动态猝灭.在此基础上计算了二者相互作用的结合常数、结合位点数及热力学参数等,结果表明,CAF与BSA分子以摩尔比1∶1结合,其结合反应主要是熵驱动,主要作用力是疏水力.
5-甲基-4-乙氧羰基-3-腈基-2-对氯苯甲胺基呋喃(CAF);合成;表征;牛血清白蛋白;荧光猝灭;热力学参数
近几十年来,杂环化合物在医药和农药中的不断出现,使得杂环化合物日益成为生物活性物质研究的重点[1],据文献报道,已发现一些杂环胺类化合物表现出很高的抑菌活性,如噌啉衍生物,该类药剂在防治稻瘟病方面表现出突出的特点[2].已有许多专利和文献报道呋喃衍生物的合成及其具有良好的杀菌及抗癌等生物活性[3].
血清白蛋白是血液中含量最丰富的蛋白质,具有许多重要的生理功能,能和许多内源及外源性化学物质以各种方式结合,并携带着这些物质通过血液在体内进行转运、运输、分配和代谢[4].因此,从不同的角度研究以白蛋白为代表的蛋白质与具有生物活性小分子间的相互作用,了解药物的作用机制,已成为一个非常活跃的研究课题.研究药物小分子与蛋白质作用的方法有很多,其中荧光光度法因为具有灵敏度高、选择性好、操作简便易行等特性,得到广泛应用[5].
本文研究了运用原料易得、条件温和及收率较高的反应来合成新型呋喃胺类化合物5-甲基-4-乙氧羰基-3-腈基-2-对氯苯甲胺基呋喃(CAF)[6],并应用荧光猝灭法研究其与BSA的相互作用.
1 合成部分
1.1 主要仪器与试剂
仪器:400型400MHz核磁共振仪(Varian Mercury公司,TMS为内标)、X4型熔点仪(北京第三光学仪器厂,温度未经校正)、Perkin-Elemer PE-983红外光谱仪(KBr压片)、带恒温系统的 F-4500荧光分光光度计(日本日立公司)、UV-2300紫外可见分光光度计(北京普析通用仪器有限公司)、AU Y120电子分析天平.
药品:氯代乙酰乙酸乙酯,丙二腈,对氯苯甲醛,醋酸,硼氢化钠等试剂均为市售分析纯和化学纯.乙醇用金属钠处理后重新蒸馏,三乙胺新蒸馏后用 KOH干燥,甲醇新蒸馏;BSA(Sigma公司)、Tris(生化试剂)、盐酸、NaCl(分析纯)等,BSA溶解在 Tris-HCl(0.05 moL/L Tris,0.10 moL/L NaCl,p H=7.4)缓冲溶液,白蛋白溶液在开始实验前15分钟配制,实验用水为二次亚沸水.
1.2 合成路线[6]
合成路线见图1.
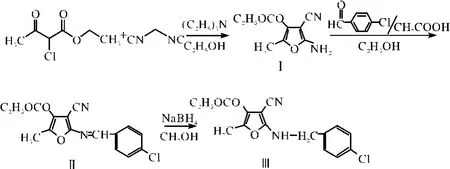
图1 CAF的合成路线图Fig.1 The road map of synthesis of CAF
1.3 合成步骤
1.3.15 -甲基-4-乙氧羰基-3-腈基-2-氨基呋喃 Ⅰ的制备 参考文献方法[6],在冰水浴条件下,应用丙二腈、氯代乙酰乙酸乙酯,在乙醇中,三乙胺催化反应,制得5-甲基-4-乙氧羰基-3-腈基-2-氨基呋喃Ⅰ,白色固体,产率约90%,m.p.224~225℃.
1.3.25 -甲基-4-乙氧羰基-3-腈基呋喃 Schiff碱Ⅱ的制备 向干燥的圆底烧瓶中加入Ⅰ(2 g),无水乙醇(20 mL),芳醛(10 mmol),冰醋酸(8~10滴),在磁力搅拌的作用下加热回流24小时后,冷却到室温,即析出5-甲基-4-乙氧羰基-3-腈基呋喃Schiff碱 Ⅱ,黄色晶体,产率 80%,m.p.153~154℃.1H NMR(CDCl3,400 MHZ)δ:8.14~8.35(m,4H,Ar—H),8.83(s,1H,—CH=N —),4.37~4.43(m,2H,—CH2O),2.66(s,3H,—CH3),1.37~ 1.42(m,3H,CH3—CH2—);IR(KBr)υ:1634(C=N),1715(C=O),1607,1553 cm-1;MS(70 eV)m/z(%):318(M+,11),304(5),216(24),165(15),125(100),105(98),77(16).
1.3.35 -甲基-4-乙氧羰基-3-腈基-2-对氯苯甲胺基呋喃(CAF)Ⅲ的合成 向(100 mL)干燥的圆底烧瓶中加入(3 mmol)SchiffⅡ,再加入10 mL新蒸的无水甲醇,快速加入NaBH4(3 mmol),在圆底烧瓶口安上防氢气外逸的塑料袋(或气球),冰水浴下搅拌1 h,分两次补加NaBH4(3 mmol),移开冰水浴,3小时后,点样,若反应完全,将圆底烧瓶的混合液体缓慢倒入配有磁力搅拌器的冰水浴中,减压抽滤,得到白色固体,用乙醇重结晶得目标化合物Ⅲ,白色晶体,产率70%,m.p.104~105℃.1H NMR(CDCl3,400 MHZ)δ:7.25~7.35(m,4H,Ar—H),5.21(s,1H,—NH —),4.53~4.54(m,2H,—CH2N),4.29~4.33(m,2H,—CH2O),2.45(m,3H,—CH3),1.35~1.37(m,3H,CH3—CH2—);MS(70 eV)m/z(%):320(M+,11),306(5),206(24),167(15),127(100),107(98),79(16).
2 光谱法研究5-甲基-4-乙氧羰基-3-腈基-2-对氯苯甲胺基呋喃(CAF)与牛血清白蛋白(BSA)的相互作用
2.1 实验方法
溶液的配制:配制不同温度(T=298,302,306,310 K)下p H=7.4的 Tris-HCl缓冲溶液;在2 cm的比色皿中分别加入2 mL 1×10-5mol/L的BSA溶液和不同量的化合物CAF,得到化合物CAF与BSA之间不同物质的量之比的系列溶液.
吸收光谱:分别测定化合物 CAF、BSA及1∶1的CAF-BSA溶液的吸收光谱.
荧光光谱:测定各溶液在不同温度下的荧光光谱,选定激发和发射狭缝均为 2.5 nm,以λ=295 nm激发,绘制295~450 nm的荧光光谱图.
2.2 荧光光谱特征
BSA分子中色氨酸,酪氨酸和苯丙氨酸的存在使其具有内源性荧光.以λex=295 nm激发BSA,在295 nm附近有很强的荧光峰,而相同条件下化合物CAF溶液在295 nm附近则没有荧光峰,证明CAF不会发生与BSA相互干扰的荧光.固定BSA的量,随着体系中化合物CAF的浓度的增加,BSA的内源荧光进行有规律的猝灭,如图2所示(Fig.2).
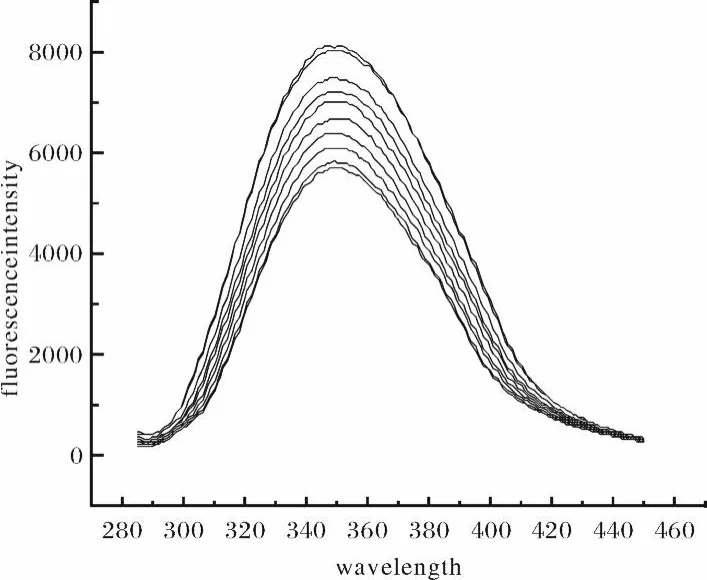
图2 CAF对BSA荧光光谱的影响Fig.2 Quenching of BSA fluorescence spectra by adding CAF
2.35 -甲基-4-乙氧羰基-3-腈基-2-对氯苯甲胺基呋喃(CAF)猝灭BSA机理的推断
荧光猝灭机理通常分为动态猝灭和静态猝灭两种.动态猝灭是猝灭剂和荧光物质的激发态分子之间的相互作用引起的,其猝灭依赖于扩散,由于温度升高会导致扩散系数增大,因此荧光物质的猝灭常数将随温度的升高而增大.其过程遵循Stern-Volmer方程[7].
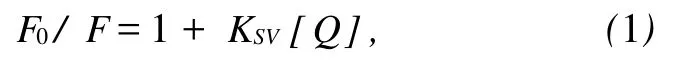

图3 CAF对BSA荧光猝灭的Stern-Volmer图Fig.3 Stern-Volmer plots at four different temperatures
式(1)中 F0和 F分别表示不存在和存在猝灭剂时荧光物质的荧光强度;[Q]为猝灭剂的浓度,KSV是Stern-Volmer猝灭常数.
静态猝灭是猝灭剂与荧光物质分子在基态时生成不发光的配合物,从而导致荧光物质荧光强度降低的过程,温度升高则导致基态配合物稳定性下降,因此静态猝灭常数将随温度的升高而减小,其过程可用下式描述:
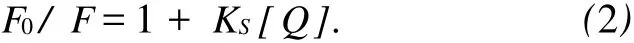
分别测定了四个不同温度(T=298,302,306和310 K)条件下,5-甲基-4-乙氧羰基-3-腈基-2-对氯苯甲胺基呋喃(CAF)对BSA的荧光猝灭情况.图3(Fig.3)为一定浓度范围内不同温度下的[(F0/F)-1]-[Q]关系图.从图3可以看到,不同温度下,猝灭常数不同,且随温度升高 KSV增大,表明上述猝灭为动态猝灭机理.
2.4 作用力类型的确定
药物和生物活性分子之间的相互作用力包括氢键、静电作用力、范德华力、疏水力四种.假设在测定温度范围内焓变变化不大,则它的值和熵变ΔS可以从Vant Hoff方程求得[8].
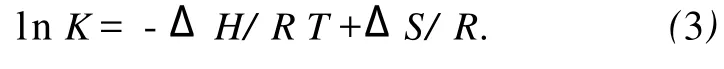
这里 K类似于在相应温度下的Stern-Volmer中的猝灭常数 K[8]SV.自由能变ΔG由下式求得.
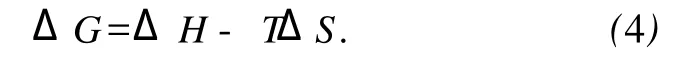
通过lnKSV对1/T作图得图4(Fig.4).
由式(4)计算得自由能变(ΔG)列于表 1.从ΔG的值可以看出SDA与BSA的相互作用是自发的.同时其相互作用的焓变及熵变是增大,表明CAF与BSA的结合主要是熵驱动的,其主要作用力类型为疏水力.
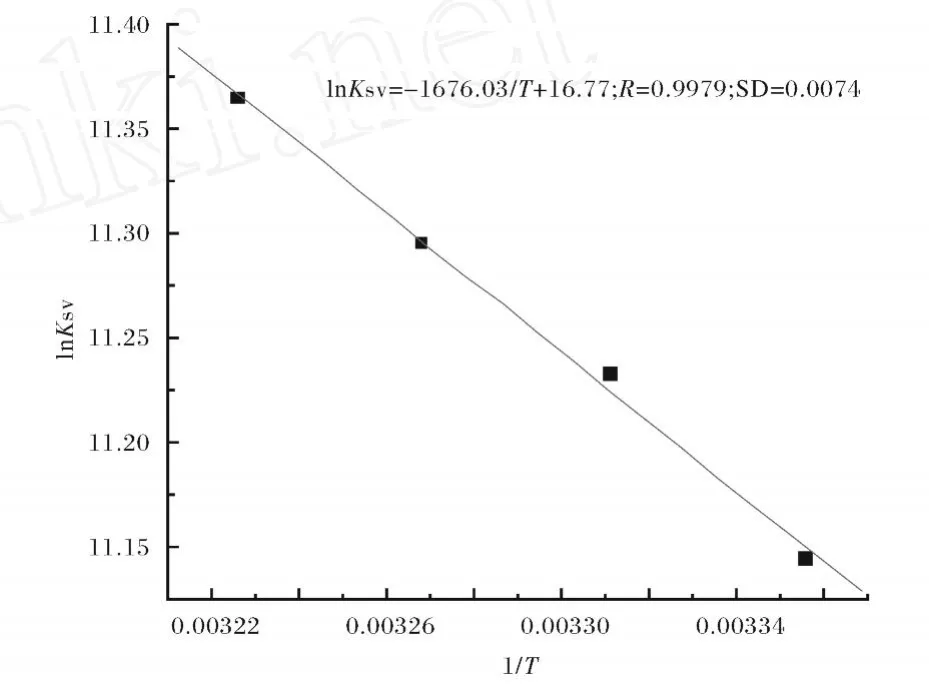
图 4 Van’t-Hoff曲线图Fig.4 Van’t-Hoff plot,p H=7.40,
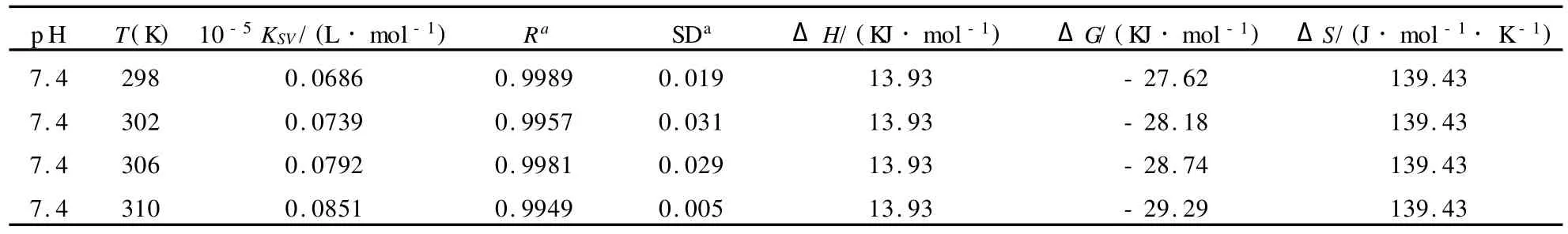
表1 Stern-Volmer动态猝灭常数 KSV及相关热力学参数Tab.1 Stern-Volmer quenching constantKSVand relative thermodynamic parameters
2.5 表观结合常数及结合位点数
当小分子与大分子结合时其结合常数与结合位点数由下式求出:
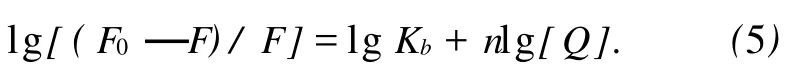
这里 n为结合位点数,Kb为表观结合常数,由(5)式作 lg[(F0/F)-1]~lg[Q]图(见图 5),依直线的斜率和截距即可求出CAF与BSA结合位点数n及表观结合常 Kb.对于不同温度下相关数据的计算结果列于表2.

图5 lg[(F0/F)-1]~lg[Q]曲线图Fig.5 Van’t-Hoff plot,lg[(F0/F)-1]~ lg[Q]

表2 不同温度下的表观结合常数 Kb和结合位点数nTab.2 Binding constantKand Binding sitesn at different temperatures
在按近人体生理条件(p H=7.4,T=310 K)时,相关系数 R大于0.99,结合位点数 n接近1,说明CAF与BSA易以1∶1形成复合物;且温度变化对结合常数影响比较小,说明了CAF与BSA之间有较强的结合作用,可以被蛋白质所贮存和运输.
2.6 结合距离
按 Förster的无辐射能量转移理论可以求得CAF与BSA结合时结合位置与蛋白质分子中荧光发射基团之间的距离[9].
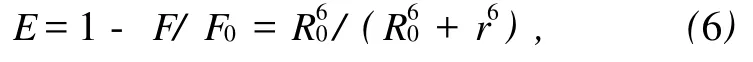
这里 r是给体(BSA)和受体(CAF)之间的距离,R0是转移效率为50%时的临界距离,可由下式求出
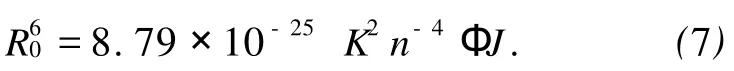
(7)式中 K2为偶极空间取向因子,n为介质的折射指数,Ф为给体的荧光量子产率,J为给体的荧光发射光谱(a)与受体吸收光谱(b)的光谱重叠积分 ,即:
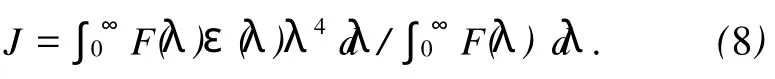
(8)式中 F(λ)为荧光受体在波长λ处的荧光强度,ε(λ)为受体在波长λ处的摩尔吸光系数.图6为CAF与BSA的摩尔比为1∶1时,化合物M的吸收光谱与荧光发射光谱的重叠图.将图中的光谱重叠部分按式(8)求出 J.在上述实验条件下,取K2=2/3,n=1.36,Ф=0.15,将这些数值代入式(7)可出 R0=3.37 nm;通过式(6)求出能量转移效率 E=0.166,根据 R0、E的值,由式(6)算出BSA内色氨酸残基与CAF分子间的距离 r=2.5 nm,符合能量转移理论.说明CAF与BSA是足够靠近(r<7nm),其结合是通过无辐射能量转移而促使蛋白质的荧光猝灭.
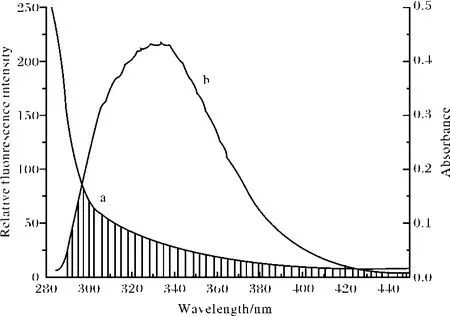
图6 为CAF与BSA的摩尔比为1∶1时,化合物的吸收光谱与荧光发射光谱的重叠图Fig.6 Spectral overlap of the fluorescence of
3 结论
实验合成了化合物 5-甲基-4-乙氧羰基-3-腈基-2-对氯苯甲胺基呋喃(CAF),并通过核磁共振仪、质谱仪、红外光谱仪对合成的产物进行鉴定是成功的.应用荧光光谱法、紫外吸收光谱法研究CAF与BSA的相互作用.研究结果表明CAF对BSA的荧光猝灭机理是动态猝灭过程,从结合位点常数值能断定CAF与BSA以摩尔比1∶1结合,从计算出焓变和熵变值中,其中焓变值为常数,熵变值为正,可表明此结合反应主要是熵驱动,反应中主要作用力是疏水力.
[1]Ding M W,Yang S J,Zhu J.New efficient synthesis of 2-substituted 5,6,7,8-tetrahydro benzothieno[2,3-d]pyrimidin-4(3H)-ones[J].Synthesis,2004,33(1):75-79.
[2]Liang Y,Ding M W,Liu ZJ,Liu X P.A facile and selective synthesis of 2-alkylamino-4(3H)-quinazolinones[J].Synth Commun,2003,33(6):2843-2848.
[3]周雅琴,宋增福,肖枚英,等.呋喃衍生物的合成[J].北京大学学报:自然科学版,1996,32(1):51-53.
[4]马贵斌,杨 频.荧光法研究血清白蛋白与药物的结合作用[J].生物化学杂志,1992(5):624-630.
[5]王丽芳,杨斌盛.羟基-2-萘甲酸与牛血清白蛋白的作用[J].山西大学学报,2006,29(2):171-174.
[6]Hu Y G,Li G H,Ding M W.Efficient synthesis of furo[2,3-d]pyrimidin-4(3H)-ones[J].Arkivoc,2008(8):151-158.
[7]Cyril L,Earl J K,Sperry W M.Biochemists Handbook[M].London:Epon Led Press,1961:84.
[8]Hu YJ,Liu Y,Shen X S,et al.Studies on the interation between 1-hexylcarbamoyl-5 fluorouracil and bovone serum albumin[J].Molecular Structure,2005,738:143-174.
[9]Lakowicz J R.Principles of Fluorescence Spectroscopy[M].New York:Plenum Press,1999:237-265.
[10]孙绍发,於敏敢,朱先军.光谱法研究一种咪唑啉酮类衍生物与牛血清白蛋白的相互作用[J].华中师范大学学报:自然科学版,2007,41(3):171-174.
Abstract:a new compound 5-methyl-4-ethoxycarbonyl-3-cyano-2-parachlorobenzyl aminofuran has been synthesized and characterized by1H NMR,IR and MS.The interaction between 5-methyl-4-ethoxycarbonyl-3-cyano-2-parachlorobenzyl aminofuran(CAF)and Bovine Serum Albumin(BSA)was investigated by fluorescence and absorption spectroscopy.The experimental results showed that the fluorescence quenching of BSA by CAF was a result of the formation of the CAF-BSA complex and dynamic quenching occurred in the fluorescence quenching.The binding sites numbern,apparent corporation constant Kand corresponding thermodynamic parametersΔH,ΔG,ΔSwere calculated.The research results indicated that CAF bound BSA with molar ratio of 1∶1 and the binding reaction was mainly entropy-driven and hydrophobic interactions forces played major role in the reaction.
Key words:5-methyl-4-ethoxycarbonyl-3-cyano-2-parachlorobenzyl aminofuran;synthes;characterizition;Bovine Serum Albumin;fluorescence quenching;thermodynamic parameters
Synthesis and interaction with Bovine Serum Albumin of 5-methyl-4-ethoxycarbonyl-3-cyano-2-parachlorobenzyl aminofuran
LI Yan1,ZHAI Haiyan2,SUN Shaofa1
(1.Department of Chemistry and Life Science,Xianning College,Hubei,Xiangning 437000;2.School of Guangxi Quality and Technical Engineering,Nanning 530022)
S482
A
1000-1190(2010)04-0624-05
2010-06-27.
湖北省教育厅重点项目(D20092840).
*E-mail:liyan750606@yahoo.com.cn.
