离子液体电解质在锂二次电池中的应用研究(上)
2010-09-25房少华
杨 立, 房少华
(上海交通大学化学化工学院,上海200240)
离子液体(Ionic liquid,ILs),是完全由阳离子和阴离子所组成的低熔点盐类物质;与传统的有机溶剂相比,具有以下优异的物理化学性质[1-3]:蒸气压极低,不易挥发;不易燃烧;高热稳定性;液态温度范围宽;高电导率;电化学窗口宽;好的化学稳定性,好的溶解能力。离子液体所具有的这些特性,使其适合作为安全型电解质应用在锂二次电池中。
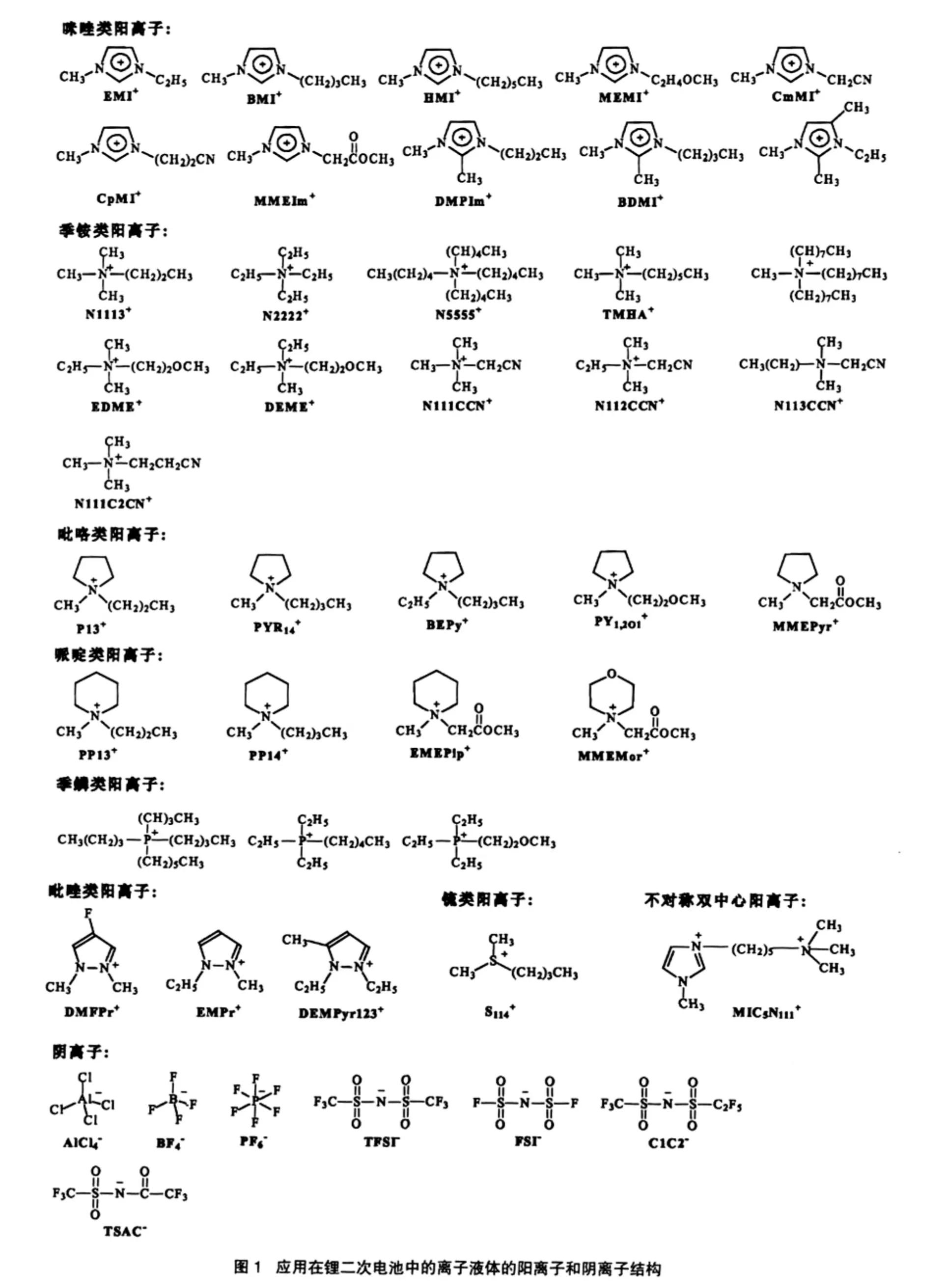
离子液体作为锂二次电池电解质中的组份,有以下几种应用方式:(1)离子液体+锂盐;(2)离子液体+锂盐+有机添加剂;(3)有机溶剂+锂盐+离子液体(离子液体含量少,作为添加剂);(4)有机溶剂+锂盐+离子液体(离子液体含量较多,作为阻燃剂)。由于锂二次电池是由正极材料、负极材料、隔膜和电解质等部分所组成的复杂体系,而离子液体以何种方式应用在锂二次电池中,是由离子液体本身性质和电池的其他部分材料性质等因素共同决定的。目前应用于锂二次电池中的离子液体主要有咪唑类、季铵盐类、吡咯类和哌啶类等,结构如图1所示;本文将从离子液体电解质性质、电解质与正负极材料匹配性以及电池性能等方面,评述各种离子液体电解质在锂二次电池中的应用情况。
1 咪唑类离子液体电解质
由于咪唑类离子液体,特别是1-乙基-3-甲基咪唑阳离子(EMI+)离子液体,具有粘度低、电导率高的特点,在锂二次电池中应用较早,且文献报道较多。
首先被应用在锂二次电池中的是EMIAlCl4离子液体。Fung等[4]采用的电解质组份为:EMICl+AlCl3+LiCl+C6H5SO2Cl(EMICl/AlCl3/LiCl=1.00/1.20/0.15;C6H5SO2Cl浓度为0.05 mol/kg),发现将少量的添加剂C6H5SO2Cl加入电解质中,可有效除去电解质中的通过循环伏安测试,发现通过在电解质加入C6H5SO2Cl后,钨电极表面锂可以电化学沉积和溶解,且在Al电极表面锂电化学沉积和溶解循环可逆性较好;将此电解质应用于LiAl/LiCoO2电池中,充放电电流密度为1.0 mA/cm2,电压范围4.2~2.9 V,20次充放电循环,最大放电容量为112 mAh/g,库仑效率在90%以上。Ui等[5]所采用的电解质组份为:EMICl+AlCl3+LiCl+SOCl2[在含40%(摩尔分数)EMICl和60%(摩尔分数)AlCl3中溶解到饱和浓度的LiCl;SOCl2浓度为0.1 mol/L];发现由于添加剂SOCl2的还原反应可在碳电极表面形成SEI膜(Surface Electrolyte Interphase Film),其可以阻止电解质中的EMI+阳离子嵌入,而允许锂离子嵌入、脱出;分别以人造石墨、天然石墨、软碳和硬碳材料为碳电极进行Li/C电池充放电测试,电流为0.07 mA/cm2(0.1C),在第30次充放电循环时,其放电容量分别为296、325、314、395 mAh/g;最近,Ui等[6]又研究了Al负极与此电解质的相容性,在Al电极表面锂电化学沉积和溶解循环可逆性较好,将电解质应用于Li/LiAl电池中,充放电电流密度为0.1 mA/cm2,首次充放电循环时放电容量为236 mAh/g,库仑效率为79.2%,第10次充放电循环时放电容量为232 mAh/g,库仑效率为77.9%。然而,由于AlCl3吸水性很强,在少量水的作用下易发生水解,且离子液体中纯度无法保证(存在Al2杂质),限制了这类离子液体电解液在锂二次电池中的应用,研究重点逐渐转移到性能更好的含氟阴离子[如、和二(三氟甲基磺酰)亚胺阴离子(TFSI-)等]的离子液体上。
EMI+阳离子的咪唑环上有三个酸性质子,特别是C(2)上的质子具有较强的还原性[7],EMI+阳离子离子液体还原电位约1 V(vs.Li/Li+),如果离子液体电解质本身无法通过反应在锂负极表面生成稳定SEI膜,来阻止电解质的不断反应,金属锂就不宜直接作为电池的负极。Matsumoto等通过循环伏安测试,发现LiTFSI/EMITFSI电解质在Ni电极表面没有发生锂电化学沉积和溶解,而LiTFSI/EMITSAC电解质在Ni工作电极表面发生锂电化学沉积和溶解[8];将LiTFSI/EMITFSI电解质和LiTFSI/EMITSAC电解质尝试应用在Li/LiCoO2电池中,充放电电流为0.1C,电压范围3.2~4.2 V,在30次充放电循环内,容量快速衰减[9-11];可能是锂负极表面没有形成稳定的SEI膜,致使在充放电过程中电解质不断发生分解反应。研究人员选用钛酸锂(Li4Ti5O12)作为负极材料,尽管其它的容量性能并不理想(理论容量为175 mAh/g),但其理论嵌锂电位为1.55 V(vs.Li/Li+)[12],可以避免如含EMI+阳离子的离子液体这样具有高还原电位的在低电位时电化学分解。Nakagawa等[13]根据EMIBF4离子液体的还原电位为1.1 V(vs.Li/Li+),将1 mol/L LiBF4/EMIBF4(25℃时粘度为111 cp,20℃时电导率为3.65 mS/cm)电解质应用在Li4Ti5O12/LiCoO2电池中,并与1 mol/L LiBF4/GBL+EC(体积比为60∶40)有机电解质相比较,充放电电压2.6~1.2 V,在0.2C充放电倍率下,有机电解质电池初始放电容量高于130 mAh/g,而离子液体电解质电池容量约为120 mAh/g,50次充放电循环,容量保持率为94.4%;在0.1C充电倍率下,随着放电倍率的增加,离子液体电解质电池的放电容量逐渐降低,在0.4C放电倍率时,放电容量为112.8 mAh/g。EMITFSI离子液体的还原电位为1.0 V(vs.Li/Li+),Garcia等[14]将1 mol/L LiTFSI/EMITFSI电解质应用在Li4Ti5O12/LiCoO2电池中,并与1 mol/L LiBF4/EMIBF4电解质和1 mol/L LiTFSI/EC+DMC有机电解质相比较;随着充放电倍率的增加,两种离子液体电解质电池容量比有机电解质更快降低,而1 mol/L LiTFSI/EMITFSI电解质电池倍率性能要明显优于1 mol/L LiBF4/EMIBF4;在1C充放电倍率下,1 mol/L LiBF4/EMIBF4电解质电池已无法工作,有机电解质电池容量衰减较快,而1 mol/L LiTFSI/EMITFSI电解质电池在200次充放电循环后放电容量为106 mAh/g,容量衰减率不到10%。由于离子液体与有机溶剂相比,粘度高,为了降低电解质体系粘度,提高电解质电导率,Diaw和Chagnes等[15]先将有机溶剂ACN(乙腈)和GBL与BMIBF4和BMIPF6等离子液体以及LiBF4和LiPF6混合,研究电导率的变化规律;他们[16]选用1 mol/L LiBF4/GBL+BMIBF4(体积比为60∶40)混合电解质,与有机电解质1 mol/L LiPF6/EC+DEC+DMC(体积比为2∶2∶1)相比较,发现混合电解质具有比有机电解质更好的热稳定性,循环伏安研究混合电解质的Li/C(石墨)电池,未发现锂离子嵌入、脱出行为,而混合电解质的Li/Li4Ti5O12电池,发现可逆的锂离子嵌入、脱出行为,在1/15C的倍率下充放电测试,初始容量为157 mAh/g,19次充放电循环后,容量衰减9%,混合电解质的Li/LiCoO2电池无法工作,是由于电解质在正极材料表面的氧化反应,其阻止了锂离子嵌入、脱出。
如果通过对咪唑类离子液体中阳离子或阴离子的结构进行改造,使得离子液体电解质可以通过反应在锂负极表面生成稳定SEI膜,来阻止电解质的不断反应,金属锂就可作为电池的负极。Egashira等[17]选择了含氰基功能团咪唑阳离子的离子液体来构成电解质,LiTFSI/CmMITFSI、LiTFSI/CpMITFSI和 LiTFSI/CmMITFSI+EMITFSI,其中 LiTFSI浓度为 20%(摩尔分数),循环伏安测试发现,不锈钢电极表面有锂电化学沉积和溶解行为,认为有稳定的SEI膜在电极表面生成;接着,又对循环伏安测试后的不锈钢电极表面型貌和表面SEI膜的结构,用SEM和XPS测试方法进行表征分析[18];氰基功能团引入,使得离子液体的粘度明显升高,电导率也显著减小,后续的电池应用数据也再未见报道。将咪唑环上的C(2)的活性氢用烷基取代,不但提高了离子液体的电化学稳定性[19],也使得这些咪唑类的离子液体可以应用在以锂金属为负极的电池中。Seki等[20]选用三烷基咪唑离子液体DMPImTFSI构成离子液体电解质:0.32 mol/kg LiTFSI/DMPImTFSI,应用在Li/LiCoO2电池中,在1/8C的充放电倍率下,电压3.0~4.2 V,初始放电容量为130 mAh/g,50次充放电循环后,容量保持率为93%,研究在1/8C的充电倍率下,在1/8、1/4、1/2、1 C等不同倍率条件下电池放电容量变化,发现1C倍率下,放电容量依然可以达到100 mAh/g以上;接下来,他们又继续研究了不同锂盐浓度条件下 (LiTFSI浓度分别为0.16、0.32、0.48、0.64、0.80 mol/kg),LiTFSI/DMPImTFSI离子液体电解质的电导率以及与金属锂界面性质的变化情况,同时将不同锂盐浓度的电解质应用在Li/LiCoO2电池中,研究不同锂盐浓度对电池放电倍率性的影响,发现锂盐浓度在0.3~0.5 mol/kg的范围时,该离子液体电解质在高倍率放电条件下容量较好,在1/8C的充放电倍率下,0.32 mol/kg LiTFSI/DMPImTFSI电解质,100次充放电循环放电容量依然还有113 mAh/g[21]。Hayashi等[22]合成了含四个烷基咪唑离子液体DEDMIBF4、DEDMITFSI和DEDMIBETI,选择了0.8 mol/L LiTFSI/DEDMITFSI离子液体电解质,应用在Li/Li-CoO2电池中,充放电电流0.1 mA,电压3.0~4.2 V,放电容量约为100 mAh/g,电池性能并不理想。Matsumoto等[23]将EMITFSI离子液体中的阴离子替换为FSI-,发现EMIFSI的粘度和电导率都要优于EMITFSI,其还原电位与EMITFSI相同,而其所构成的电解质0.3 mol/kg LiTFSI/EMIFSI,循环伏安测试发现,由于电解质可以生成SEI膜,使得在铂电极表面有锂电化学沉积和溶解行为;该电解质也可以应用在Li/LiCoO2电池中,显示出好的倍率性能,在1C条件下,放电容量依然可以在120 mAh/g以上,其缺点就是容量衰减较快;如图2所示,当充放电倍率为0.1C时,电压3.2~4.2 V,首次放电容量超过130 mAh/g,而50次充放电循环后,放电容量已经降低到100 mAh/g以下。Guerfi等[24]也报道了将0.7 mol/L LiFSI/EMIFSI电解质应用在Li/LiFePO4电池中,1/4C倍率充电,1C倍率放电,10次充放电循环,放电容量可以达到145 mAh/g;随着放电倍率的增加,容量显著下降,如在放电倍率高于4C时,容量仅45 mAh/g。
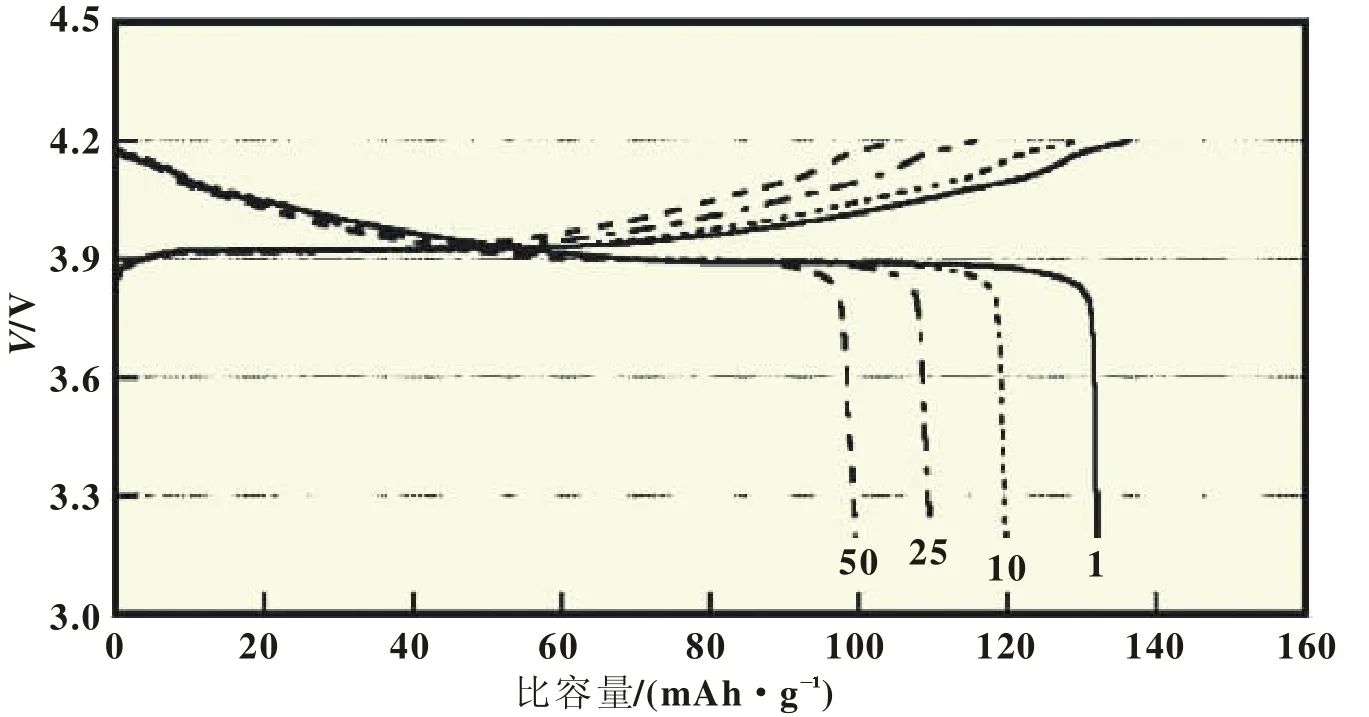
图2 EMIFSI离子液体电解质的Li/LiCoO2电池充放电曲线图[2 3]
如果想将离子液体电解质应用在以石墨作负极的锂二次电池中,除了要避免电解质在石墨负极表面的还原分解之外,更重要的是可以避免电解质中的有机阳离子嵌入行为。要将咪唑类离子液体电解质成功应用于石墨负极的电池中,一种方法就是加入能在石墨负极上形成良好SEI膜的有机添加剂;Holzapfel等[25-26]先选择25%EC(ethylene carbonate)、2%acrylonitrile、10%VC(vinylene carbonate)和5%ES(ethylene sulfite)作为1mol/L LiTFSI/EMITFSI电解质添加剂,通过Li4Ti5O12/C(石墨)电池测试,发现EC添加剂没有效果,其他三种有机添加剂都可以使锂在石墨电极表面可逆的嵌入、脱出,且VC添加剂的性能最好,石墨电极的容量可以达到350 mAh/g;再将5%VC加入1 mol/L LiPF6/EMITFSI电解质中,Li4Ti5O12/C(石墨)电池测试,放电容量达到350 mAh/g,150次充放电循环后,容量损失仅为1.5%~2%,将VC含量降低到2%,容量降低到300 mAh/g,150次充放电循环后,容量损失为4%,将含5%VC的1 mol/L LiPF6/EMITFSI电解质应用于C(石墨)/LiCoO2电池中,30次充放电循环后,只有很少的容量衰减。到目前为止,不加入任何有机试剂成份的离子液体电解质又可以应用于石墨负极电池中的,只有FSI-阴离子的离子液体电解质;Ishikawa等[27]首先通过循环伏安测试,发现0.8 mol/L LiTFSI/EMIFSI应用在Li/C(石墨)电池,与0.8 mol/L LiTFSI/EMITFSI电解质不同,如图3所示,在石墨电极表面没有阳离子嵌入行为,而是可逆的锂嵌入、脱出行为;在0.2C的充放电倍率下,Li/C(石墨)电池30次充放电循环,放电容量保持在360 mAh/g左右,性能与1.0 mol/L LiPF6/EC+DEC(3∶7)有机电解质相近;他们又研究了石墨与0.8 mol/L LiTFSI/EMIFSI离子液体电解质的界面性质[28],使用XPS方法分析Li/C(石墨)电池3次充放电循环后的石墨电极表面构成,发现0.8 mol/L LiTFSI/EMIFSI与0.8 mol/L LiTFSI/EMITFSI电解质的电极表面膜构成相似,且比0.8 mol/L LiTFSI/EC+DMC有机电解质的表面膜更薄,又通过EIS方法研究Li/C(石墨)电池,发现0.8 mol/L LiTFSI/EMIFSI电解质具有比0.8 mol/L LiTFSI/EC+DMC有机电解质更小的界面阻抗,推测0.8 mol/L LiTFSI/EMIFSI电解质中的锂更容量嵌入到石墨电极中;最近,Ishikawa等[29]又报道了EMITFSI与EMIBF4分别与EMIFSI混合所组成离子液体电解质,用循环伏安方法,研究不同配比的混合离子液体电解质时石墨电极表面锂离子嵌入、脱出行为的变化。将离子液体少量加入到有机电解质中,有可能改善电解质的热稳定性,但是否对以石墨为负极的电池性能有所影响呢?Lee等[30]将10%(质量分数)BDMIPF6咪唑类离子液体加入到1 mol/L LiPF6/PC(propylene carbonate)电解质中,C(石墨)/LiCoO2电池测试,发现随着充放电倍率增加,加入离子液体的电解质的电池放电容量显著下降;通过脉冲场梯度核磁技术研究电解质中各种离子的扩散系数,发现这种电解质体系中,有机阳离子BDMI+的扩散能力要高于锂离子,使得有机阳离子BDMI+先到达石墨电极表面从而阻碍了锂离子的嵌入。
除了以上的应用之外,咪唑类离子液体也被报道应用在两种使用新颖的电极材料的锂二次电池中。Markevich等[31]尝试将1 mol/L LiBF4/EMIBF4和1 mol/L LiBF4/BMIBF4离子液体电解质,应用在以LiNi0.5Mn1.5O4为正极材料的电池中,该材料具有较高的工作电压,其锂的嵌入电位约为4.7~4.8 V(vs.Li/Li+);Mo6S8/LiNi0.5Mn1.5O4电池充放电测试,1 mol/L LiBF4/EMIBF4电解质在30℃时,1/6C倍率下,放电容量大约为110 mAh/g,倍率提高到1/2 C时,容量明显降低;1 mol/L LiBF4/BMIBF4电解质在30℃时,1/16C倍率下电池容量快速衰减,当温度升高到60℃时,首次放电容量约为120 mAh/g,但容量衰减也较明显,认为是电解质在正极材料表面不断氧化反应所造成的。Wang等[32]也尝试将1 mol/L LiTFSI/EMITFSI电解质应用在Li/S电池中,而S材料被认为是已知的理论容量最高的正极材料;为了提高S的导电能力,将S渗透到介孔结构的碳中;电池充放电测试,发现离子液体电解质的放电容量和循环性能都要明显好于有机电解质,这主要是由于放电过程中产生的多硫化物在离子液体电解质中溶解能力较差。(待续)

[1]WELTON T.Room-temperature ioic liquids.Solvents for synthesis and catalysis[J].Chem Rev,1999,99(8):2071-2083.
[2]HOLBREY J D,SEDDON K R.Ionic liquids[J].Clean Products Process,1999,1(4):223-236.
[3]WASSERSCHEID P,KEIM W.Ionic liquids-new solutions for transition metal catalysis[J].Angew Chem Int Ed,2000,39(21):3772-3789.
[4]FUNG Y S,ZHOU R Q.Room temperature molten salt as medium for lithium battery[J].J Power Sources,1999,81-82:891-895.
[5]UI K,MINAMI T,ISHIKAWA K,et al.Development of non-flammable lithium secondary battery with ambient-temperature molten salt electrolyte performance of binder-free carbon-negative electrode[J]. J Power Sources,2005,146(1/2):698-702.
[6]UI K,YAMAMOTO K,ISHIKAWA K,et al.Development of non-flammable lithium secondary battery with room-temperature ionic liquid electrolyte:Performance of electroplated Al film negative electrode[J].J Power Sources,2008,183:347-350.
[7]BONHOTE P,DIAS A P,PAPAGEORGION N,et al.Hydrophobic,Highly conductive ambient-temperature molten salts[J]. Inorg Chem,1996,35(5):1168-1178.
[8]MATSUMOTO H,SAKAEBE H,TATSUMI K. Preparation of room temperature ionic liquids based on aliphatic onium cations and asymmetric amide anions and their electrochemical properties as a lithium battery electrolyte[J].J Power sources,2005,146(1/2):45-50.
[9]MATSUMOTO H, SAKAEBE H.N-Methyl-N-propylpiperidinium bis (trifluoromethanesulfonyl)imide (PP13-TFSI)-novel electrolyte base for Li battery[J].Electrochem Commun,2003,5:594-598.
[10]SAKAEBE H,MATSUMOTO H,TATSUMI K.Discharge-charge properties of Li/LiCoO2cellusing room temperature ionic liquids(RTILs)based on quaternary ammonium cation-Effect of the structure[J]. J Power Sources,2005,146:693-697.
[11]SAKAEBE H,MATSUMOTO H,TATSUMI K. Application of room temperature ionic liquids to Li battery[J].Electrochim Acta,2007,53:1048-1054.
[12]PYUN S I,KIM S W,SHIN H C.Lithium transport through Li1+δ[Ti2-yLiy]O4(y=0;1/3)electrodes by analyzing current transients upon large potential steps[J].J Power Sources,1999,81-82:248-254.
[13]NAKAGAWA H,IZUCHI S,KUWANA K,et al.Liquid and polymergel electrolytes for lithium batteries composed of room-temperature molten salt doped by lithium salt[J].J Electrochem Soc,2003,150(6):A695-A670.
[14]GARCIA B,LAVALLEE S,PERRON G,et al.Room temperature molten salts as lithium battery electrolyte[J].Electrochim.Acta,2004,49(26):4583-4588.
[15]DIAW M,CHAGNES A,CARRE B,et al.Mixed ionic liquid as electrolyte for lithium batteries[J].J Power Sources,2005,146(1/2):682-684.
[16]CHAGNES A,DIAW M,CARRE B,et al.Imidazolium-organic solvent mixtures as electrolytes for lithium batteries [J]. J Power Sources,2005,145(1):82-88.
[17]EGASHIRA M,TODO H,YOSHIMOTO N,et al.Functionalized imidazolium ionic liquids as electrolyte components of lithium batteries[J].J Power Sources,2007,174:560-564.
[18]ZHAO L,YAMAKI J,EGSHIRA M.Analysis of SEI formed with cyano-containing imidazolium-based ionic liquid electrolyte in lithium secondary batteries[J].J Power Sources,2007,174:352-358.
[19]BAZITO F F C,KAWANO Y,TORRESI R M.Synthesis and characterization of two ionic liquids with emphasis on their chemical stability towards metallic lithium[J].Electrochim Acta,2007,52:6427-6437.
[20]SEKI S,KOBAYASHI Y,MIYASHIRO H,et al.Lithium secondary batteries using modified-imidazolium room-temperature ionic liquid[J]. J Phys Chem B, 2006, 110 (21):10228-10230.
[21]SEKI S,OHNO Y,KOBAYASHI Y,et al.Imidazolium-based room-temperature ionic liquid for lithium secondary batteries[J].J Electrochem Soc,2007,154(3):A173-A177.
[22]HAYASHI K,NEMOTO Y,AKUTO K,et al. Alkylated imidazolium salt electrolyte for lithium cells[J].J Power Sources,2005,146:689-692.
[23]MATSUMOTO H,SAKAEBE H,TASUMI K,et al.Fast cycling of Li/LiCoO2cell with low-viscosity ionic liquids based on bis(fluorosulfonyl)imide[FSI]-[J].J Power Sources,2006,160:1308-1313.
[24]GUERFI A,DUCHESNE S,KOBAYASHI Y,et al.LiFePO4andgraphite electrodes with ionic liquids based on bis(fluorosulfonyl)imide[FSI]-for Li-ion batteries[J].J Power Sources,2008,175:866-873.
[25]HOZAPFEL M,JOST C,NOYAK P.Stable cycling ofgraphite in an ionic liquid based electrolyte[J].Chem Commun,2004,10(18):2098-2099.
[26]HOZAPFEL M,JOST C,SCHWAB A P,et al. Stabilisation of lithiatedgraphite in an electrolyte based on ionic liquids: an electrochemicaland scanning electron microscopy study[J].Carbon,2005,43(7):1488-1498.
[27]ISHIKAWA M,SUGIMOTO T,KIKUTA M,et al.Pure ionic liquid electrolytes compatible with agraphite carbon negative electrode in rechargeable lithium-ion batteries[J].J Power Sources,2006,162:658-662.
[28]SUGIMOTO T,KIKUTA M,ISHIKO E,et al. Ionic liquid electrolytes compatible withgraphitized carbon negative without additive and their effects on interfacial properties[J].J Power Sources,2008,183:436-440.
[29]SUGIMOTO T,ATSUMI Y,KIKUTA M,et al.Ionic liquid electrolyte systems based on bis(fluorosulfonyl)imide for lithium-ion batteries[J].J Power Sources,2009,189:802-805.
[30]LEE S Y,YONG H H,LEE Y J,et al.Two-cation competition in ionic-liquid-modified electrolytes for lithium ion batteries[J].J Phys Chem.B,2005,109:13663-13667.
[31]MARKEVICH E,BARANCHUGOV V,AURBACH D.On the possibility of using ionic liquids as electrolytes solutions for rechargeable 5 V Li ion batteries[J].Electrochem Commun,2006,8:1331-1334.
[32]WANG J,CHEW S Y,ZHAO Z W,et al.Sulfur-mesoporous carbon composites in conjunction with a novel ionic liquid electrolyte for lithium rechargeable batteries[J].Carbon,2008,46:229-235.
