软骨藻酸多克隆抗体的制备
2010-09-24刘元嫄程金平高利利吴浩东
刘元嫄, 程金平, 高利利, 徐 玮, 吴浩东
(上海交通大学 环境科学与工程学院, 上海 200240)
软骨藻酸多克隆抗体的制备
刘元嫄, 程金平, 高利利, 徐 玮, 吴浩东
(上海交通大学 环境科学与工程学院, 上海 200240)
为建立软骨藻酸(DA)的免疫检测法, 本研究采用活泼酯法将 DA与载体蛋白 KLH(BSA)偶联形成完全免疫抗原(包被抗原), 并通过紫外光谱扫描证明偶联成功与否。用完全免疫抗原 DA-KLH对新西兰白兔进行免疫, 间接ELISA法测定血清效价。实验结果表明偶联成功, 经过19周免疫后血清效价达到1:1600, 纯化后获得效价为1:800的多克隆抗体, 同时也间接证明了合成的完全抗原具有免疫原性,为以后建立免疫分析法奠定了基础。
软骨藻酸; 多克隆抗体; 活泼酯法
软骨藻酸(Domoic Acid, DA)是赤潮毒素失去记忆性贝毒(Amnesic Shellfish Poisoning, ASP)的主要成分。中毒后可引起腹泻、呕吐、严重者可致意识混乱、记忆丧失。DA最早于1958年从树枝软骨藻(Chondria armata) 中分离, 并于随后相继分离了A-H八种异构体[1]。其中异构体A、B、C的毒性远低于DA本身[2]。DA主要通过与谷氨酸受体结合引发一系列生化反应, 从而导致神经元损伤及细胞死亡[3]。自加拿大爱德华王子岛爆发了因食用被DA污染的紫贻贝而导致人类中毒事件后, 引起了人们对贝类产品中 ASP检测的重视, 各国先后制定了 DA的安全限量为20 μg/g贝肉[4]。目前DA较为普遍的检测方法有小白鼠生物检测法、HPLC-UVD法及免疫检测法。小白鼠生物法简单易行, 但其只能毒素的整体水平、精确度低、检测限高、易受其他种类毒素干扰、无法满足人们对食品安全的检测需求;HPLC-UVD法作为水产及水产加工品专业委员会(Codex Committee on Fish and Fishery Products,CCFFP)推荐的方法[5]虽然具有灵敏度高、检测限低的优点, 但因其仪器昂贵、对分析人员的要求高、前处理繁琐而不适用于基层检测单位对大量样品的分析。而免疫检测如ELISA法, 则兼具检测便利快速,精确度较高等特点而已被广泛用于环境污染物及农药兽药残留的检测[6-8]。由于DA分子量小、结构简单无法刺激动物产生抗体, 因此目前为止还没有成熟的商品化检测试剂盒。作者采用活泼酯法将 DA与载体蛋白偶联, 成功制备了完全抗原并免疫新西兰兔获得多克隆抗体, 为建立 DA检测试剂盒奠定了基础。
1 材料与方法
1.1 实验材料
1.1.1 药品
软骨藻酸(DA)购自ALEXIS公司, 纯度为98%;牛血清白蛋白(BSA)、钥孔血蓝蛋白(KLH)、弗式完全佐剂(FCA)、弗式不完全佐剂(FIA)、二甲基亚砜(DMSO)、1-(3-二甲基氨基丙基)-3-乙基 碳化二亚胺盐酸盐(EDC·HCl)均购自 Sigma公司; N-羟基琥珀酰亚胺(NHS)、Tween-20、四甲基联苯胺(TMB)、96孔酶标板、透析袋(截留分子量 8000)均购自上海生工; 辣根过氧化物酶标记羊抗兔 IgG购自北京博奥森生物技术有限公司; Millipore超滤管(截留分子量10000); 无水乙醇、柠檬酸、过氧化氢、磷酸氢二钠、磷酸二氢钾、氯化钠、氯化钾、碳酸钠、碳酸氢钠、浓硫酸等均为分析纯, 购自国药集团化学试剂有限公司。
1.1.2 实验仪器
紫外可见分光光度计; Multiskan Mk 3酶标仪(芬兰雷勃); 隔水式恒温培养箱 GNP-9050型;HANGPING FA2004电子分析天平(上海精密科学仪器有限公司); 单通道微量移液器(Enppendorf); 12通道微量移液器(MedDragon);
1.1.3 实验动物
新西兰大白兔数只, 雌性, 体质量1.8~2 kg, 购自上海陈行实验用兔有限公司。
1.2 实验方法
1.2.1 完全免疫抗原与包被抗原的合成
1 mg DA溶于少量溶剂中(DMSO:水=1:9), 加入0.8 mg EDC·HCl(10 mg/mL)、1.2 mg NHS(20 mg/mL)及少量反应缓冲液(0.1 mol/L PBS, pH7.0), 置于25 ℃反应2 h后转移至4 ℃冰箱内反应过夜。加入用稀释缓冲液(0.01 mol/L PBS, pH7.0)溶解的KLH或BSA 2 mg, 并补加少量反应缓冲液, 置于25 ℃反应3 h后,转移入超滤管4500 r/min离心15 min, 除去未反应完的小分子。适度稀释后, 取少量反应物用紫外分光光度计检测、剩余药品分装后于−20℃保存。
1.2.2 抗体的制备
新西兰白兔在动物房内适应性驯养一周后, 选择身体健康的白兔, 从耳静脉抽取2~4 mL血, 分离阴性血清, −20 ℃冻存备用。一周后进行免疫, 首免用200 μg DA-KLH, 同时分别用KLH和生理盐水作为免疫原作为对照。将偶联物稀释至 0.5 mL, 采用注射器双推法, 与等体积弗式完全佐剂充分乳化, 颈背部多点皮内注射。三周后进行二免, 剂量方法同首免, 与弗式不完全佐剂混合乳化。以后以相同剂量与方法每隔两周免疫一次。从三免开始, 每次免疫一周后, 耳静脉取血2 mL, 测定效价。待效价达到一定程度后, 用等体积的稀释缓冲液稀释后, 耳静脉注射加强免疫。一周后心脏取血, 37 ℃放置1 h, 4 000 r/min、4 ℃离心15 min分离血清。采用辛酸-硫酸铵法对抗血清纯化, 用0.01 mol/L PBS(pH7.4)透析3天除盐, 用少量0.01 mol/L PBS稀释后分装, −20 ℃冻存备用。
1.2.3 抗体效价的测定
采用间接酶联免疫吸附法测定抗体效价。用DA-BSA作包被抗原, 以碳酸盐缓冲液(pH 9.6)做梯度稀释, 每孔 100 μL, 4 ℃包被过夜; 弃去残液后,每孔加 200 μL PBS-T(含 0.05% Tween-20 的 0.01 mol/L PBS溶液, pH 7.4), 振荡洗涤3次, 每次3 min;每孔加200 μL 封闭液(含0.05% BSA的0.01 mol/L PBS), 37 ℃封闭2 h; 拍干板内液体后, 加梯度稀释的血清, 每孔100 μL, 37 ℃孵育1 h; 洗板3次; 加入辣根过氧化酶标记的二抗, 每孔100 μL, 37 ℃孵育1 h; 洗板5次; 每孔加100 μL TMB-H2O2显色液( pH 5.0), 显色10分钟后, 每孔加50 μL 2 mol/L H2SO4终止液, 用酶标仪测定波长450 nm及630 nm处的光吸收值。
2 结果
2.1 完全抗原的偶联与鉴定
采用活泼酯法[7,9,10]将DA上的羧基先与NHS及EDC反应, 先生成酯类中间产物, 然后与载体蛋白上的自由氨基反应形成由酰胺键相连的偶联物。反应方程式如图1。
将合成完的偶联物、DA、KLH、BSA稀释, 用紫外光谱进行特征扫描。如图2、图3可见DA的特征吸收峰在242 nm处, 载体蛋白KLH及BSA的特征吸收峰在280 nm处, 而合成的偶联物的紫外光谱扫描的特征谱线与DA、KLH及BSA的谱线的峰型及最大吸收峰有较大的区别, 可定性证明活泼酯法能成功地将载体蛋白和DA进行偶联。

图1 DA与载体蛋白的偶联Fig. 1 Reactions between DA and carrier protein
2.2 抗体效价的测定
以 DA-BSA为包被抗原, 用棋盘法测定血清效价。P / N≥2.1为阳性判断终点, 以判为阳性的最高稀释倍数为终点效价, 免疫 8次后, 效价变化如图4。在八次免疫过后, 注射DA-KLH的白兔血清中抗体效不再增加, 滴度为 1:1600, 间接证明了合成的完全免疫抗原具有一定的免疫原性。经辛酸-硫酸铵二步法纯化后抗体各个滴度的吸光度值如表1所示。纯化后抗体效价为1:800, 比纯化前下降一个滴度。
3 讨论
本研究采用了活泼酯法将DA与载体蛋白偶联,通过紫外光谱扫描发现偶联物与单体的谱图有较大地差异, 故而定性地证明了成功合成了免疫抗原DA-KLH及包被抗原DA-BSA, 并使用DA-KLH对新西兰白兔进行免疫。经过八次共19周的免疫, 用间接 ELISA法测定效价, 效价达到 1:1600, 纯化后获得效价为1:800的抗体。
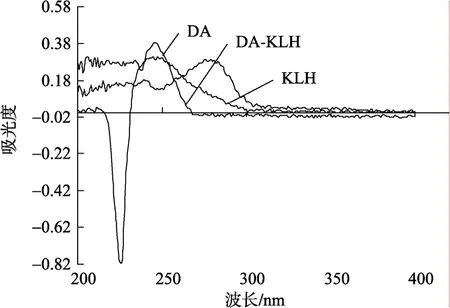
图2 完全免疫抗原DA-KLH紫外光谱扫描图Fig. 2 UV absorption of DA-KLH

图3 包被抗原DA-BSA紫外光谱特征扫描图Fig. 3 UV absorption of DA-BSA
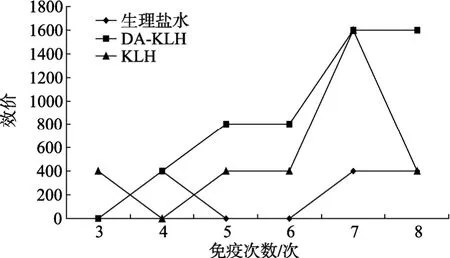
图4 血清中抗体效价的变化Fig. 4 Rabit serum titers determined by indirect ELISA
在诱导动物产生特异性抗体的过程中影响因素颇多, 除了外部环境、动物自身的免疫应答能力等因素外,抗原本身的免疫原性及免疫特性最为重要。小分子半抗原的免疫特性的好坏主要取决于基团结构的复杂性、结构中环的数目、杂原子的数目和结构的不均一性[11]。而半抗原本身又不具备免疫原性, 必须与载体蛋白偶联后才可刺激动物产生抗体。DA上带有3个羧基均可与载体蛋白偶联, 故偶联的时候具有较大的随机性, 易将杂环包裹从而降低特性。但由于DA价格昂贵,不适于对其进行基团修饰, 因此根据文献报道[10], 进行直接偶联, 同时对其方法做了适当改进, 使反应中尽可能得不损失抗原。免疫后结果如图4及表1, 实验表明, 选择了免疫原性较好的KLH作为免疫抗原的载体蛋白, 对实验动物进行常规免疫, 能够刺激动物产生针对DA的抗体, 利用间接ELISA法检测的效价也尚可, 纯化后得到可以使用的抗体, 为今后进一步建立ELISA检测方法奠定了基础。

表1 纯化后抗体效价测定结果Tab. 1 Titers of purified serum by different immunogens
[1] Zaman L O, Arakawa A, Shimosu Y,et al.Two new isomers of domoic acid from a red alga, Chondria armata[J]. Toxicon, 1997, 35(2): 205-212.
[2] Munday R, Holland P T, McNabb P,et al.Comparative toxicity to mice of domoic acid and isodomoic acids A,B and C[J]. Toxicon, 2008, 52(8): 954-956.
[3] Lefebvre K A, Robertson A. Domoic acid and human exposure risks: A review[J]. Toxicon, 2009, 54(10):1016-1021.
[4] 吴多加, 李凤琴. 软骨藻酸与人类健康关系研究进展[J]. 卫生研究, 2005, 34(3): 378-381.
[5] FAO, WHO. Report of the twenty-ninth session of the codex committee on fish and fishery products 31stsession[R]. 2008.144.
[6] 沈红, 李焕荣, 吴国娟, 等. 氨苯磺胺多克隆抗体的制备[J]. 中国兽药杂志, 2006, 40(4): 13-16.
[7] 戴烨, 李方实, 孙峰. 甲磺隆人工抗原的合成及多克隆抗体的制备[J]. 南京工业大学学报, 2007, 29(3): 39-42.
[8] 董玉华, 刘仁沿, 许道艳, 等. 酶联免疫吸附方法分析海水和贝类中的滴滴涕及代谢物[J]. 水产科学,2007, 26(4): 229-233.
[9] 余宇燕, 唐舒雅, 庄惠生. 五氯酚人工抗原的合成与多克隆抗体的制备[J]. 农业环境科学学报, 2007,26(1): 314-317.
[10] Yu F Y, Liu B H, Wu T S,et al. Development of a sensitive enzyme-linked immunosorbent assay for the determination of domoic acid in shellfish[J]. Journal of Agricultural and Food Chemistry, 2004, 52(17): 5 334-5 339.
[11] 吴瑜, 胡昌勤, 金少鸿. 半抗原免疫分析研究进展[J].药物分析杂志, 2007, 27(5): 771-776.
Received: Feb., 22, 2010
Key words:domoic acid; polyclonal antibody; activation ester method
Abstract:To develop an immunoassay of domoic acid (DA), DA was coupled to keyhole limpet hemocyanin (KLH)or bovine serum albumin (BSA) by the activation ester method. The conjugates were characterized by UV absorption. Polyclonal antibodies for domoic acid were generated from rabbits after the animals had been immunized by DA-KLH for 19 weeks. The titer of antiserum was 1:1600, detected by an indirect ELISA. After purification, the titer of antiserum became 1:800. DA-KLH was proved to be a suitable immunogen to prepare antibodies against DA.
(本文编辑:梁德海)
Preparation of polyclonal antibodies against domoic acid
LIU Yuan-yuan, CHENG Jin-ping, GAO Li-li, XU-Wei, WU Hao-dong
(School of Environmental Science and Engineering, Shanghai Jiaotong University, Shanghai 200240, China)
R392-33
A
1000-3096(2010)12-0067-03
2010-02-22;
2010-06-13
上海科委科技攻关项目(08DZ1206302)
刘元 (1985-), 女, 硕士研究生, 主要研究方向为环境健康, Email: yy_liu@sjtu.edu.cn; 程金平, 通信作者, 博士, 副教授,电话: 021-54742823, 13916873206, E-mail: jpcheng@sjtu.edu.cn
