甘草和连翘对牙鲆CYP3A活性影响的研究
2010-09-24韩现芹李吉涛
韩现芹, 李 健, 李吉涛
(1.中国水产科学研究院 黄海水产研究所, 农业部海洋渔业资源可持续利用重点开放实验室, 山东 青岛266071; 2. 国家水产品质量监督检验中心, 山东 青岛 266071)
甘草和连翘对牙鲆CYP3A活性影响的研究
韩现芹1,2, 李 健1,2, 李吉涛1
(1.中国水产科学研究院 黄海水产研究所, 农业部海洋渔业资源可持续利用重点开放实验室, 山东 青岛266071; 2. 国家水产品质量监督检验中心, 山东 青岛 266071)
研究甘草(Glycyrrhiza uralensis)和连翘(Forsythia suspensa)对牙鲆(Paralichthys olivaceus)肝细胞色素P4503A(CYP3A)活性的影响。将牙鲆随机分为3组, 即对照组、甘草组和连翘组, 对照组每日口灌0.9%的生理盐水, 试验组每日1次口灌甘草30 mg/kg和连翘100 mg/kg, 连续口灌6 d, 第7天时, 采用直接测定法和间接测定法(探针药物)进行CYP3A酶活性的测定。结果显示: 在肝微粒体水平上, 甘草和连翘均可明显提高红霉素-N-脱甲基酶活性, 分别提高了1.79倍、4.87倍。与对照组相比, 甘草组和连翘组氨苯砜的半衰期分别降低了 4.51%(P>0.05)和 36.8%(P<0.01); 药时曲线下面积分别减小了
8.28%(P>0.05)和32.3%(P<0.01); 总清除率分别增加了5.63%(P>0.05)和99.3%(P<0.01)。说明连翘对牙鲆CYP3A的活性具有极显著诱导作用, 甘草诱导作用不显著。提示其他药物与连翘合用时, 其有效性和安全性可能会受到影响。
CYP3A 活性; 甘草(Glycyrrhiza uralensis); 连翘(Forsythia suspensa); 氨苯砜; 牙鲆(Paralichthys olivaceus)
细胞色素P450(CYP450)是肝脏混合功能氧化酶系(mixed function oxidase system, 简称MFOS)的主要成分, 主要参与内源性和外源性化合物代谢, 它也可被许多物质, 如治疗药物(如抗生素)、环境化合物及一些天然产物诱导或抑制[1], 已成为近年来药理学、毒理学研究的热点之一。CYP3A是 CYP450超家族的主要成员, 现已发现其参与 50%以上临床常用药物的代谢[2], 与之相关的药物相互作用亦十分多见。该酶活性可以通过一些特异敏感底物来测定, 其中氨苯砜在体内主要经 CYP3A代谢, 故可用其消除速率来反映 CYP3A活性。红霉素-N-脱甲基酶(erythromycin N-demethylase, 简称 ERND)是CYP3A标志性酶, 也可以通过测定肝微粒体中ERND的多少, 获悉肝微粒体中CYP3A酶的活性的大小。目前水产用药物几乎都是从兽药或人用药物直接移植而来, 临床用药很少考虑 CYP450活性对药物代谢的影响, 因而导致药效的下降、中毒和残留的现象, 进而影响了动物性食品安全。甘草(Glycyrrhiza uralensis)和连翘(Forsythia suspensa)是具有保肝护肝、清热解毒等功效的传统中药, 已广泛添加到水产饲料中, 起到了提高水产动物免疫力、降低饲料系数的作用[3], 但对鱼类CYP450活性的影响尚未报道。本试验通过研究氨苯砜及 ERND在牙鲆体内含量的变化, 探讨甘草和连翘对CYP3A酶活性影响的规律, 从而可为其合理用药提出理论指导。
1 材料与方法
1.1 实验动物
牙鲆(Paralichthys olivaceus), 平均体质量(200±20.1)g, 平均体长(24.5±3.2)cm, 4~5 尾/立方水体,饲养于中国水产科学研究院黄海水产研究所麦岛实验基地。实验期间水温(16±2)℃, 盐度(30.4±0.2),充气, 流水, 试验前暂养2周, 每日投喂不含药物的配合饲料(金海力海水鱼配合饲料), 实验前1 d停止投饵。为防饲料对实验结果的影响, 实验期间不投饵。
1.2 药品、试剂与仪器
生甘草、连翘购于青岛同仁堂药店。氨苯砜原粉及标准品批号: 美国 Sigma公司产品, 20060608,纯度≥99 %; 乙腈和甲醇: 德国默克公司产品, 色谱级; 牛血清白蛋白纯度>99.8%, Amresco, 批号1105502; 红霉素: 含量 85%; 其他试剂均为国产分析纯试剂。Agilent 1100型高效液相色谱仪(配紫外吸收检测器); 96孔酶标板。
中草药提取液的制备: 取生甘草100 g加水500 mL, 用水浸泡 0.5~1 h, 加热至沸腾, 煮沸后用文火煎0.5 h, 4层纱布过滤, 残渣加少于第一次的水煎煮,合并两次滤液并浓缩, 使其质量浓度相当于原药0.29 g/mL[4]。连翘提取液制备方法同上, 浓缩后所得质量浓度为0.24 g/mL。
1.3 给药及样品采集
将健康牙鲆随机分为3组, 分别为: (1)正常对照组(0.9%生理盐水); (2)甘草组 30 mg/kg; (3)连翘组100 mg/kg。口灌每天1次, 无回吐者保留试验连续6 d, 于第7天, 从3组中各取10尾鱼, 迅速解剖取出肝脏, 保存于液氮中。
然后对3组剩余牙鲆进行腹腔注射5 mg/kg探针药物氨苯砜, 分别于注射给药后 0.083, 0.167, 0.25,0.5, 0.75, 1, 1.5, 2, 3, 4, 6, 8, 12 h共13个时间点静脉取血。每个时间点每组随机取 5尾从尾静脉一次性无菌采血 1 mL, 分别置于预先涂有肝素钠的离心管中,4 000 r/min离心5 min, 分离出血浆, 保存于−20℃冰箱中待测。
1.4 血浆中氨苯砜的测定
1.4.1 血浆样品的预处理
将血浆自然解冻, 摇匀, 吸取0.2 mL于1.5 mL具塞离心管中, 加入乙腈 0.3 mL, 置漩涡混合器上充分混合, 12 000 r/min离心10 min, 取上清液20µL进行HPLC分析[5]。
1.4.2 色谱条件
色谱柱为 Agilent Tc-C18(250 mm×4.6 mm,5µm), 柱温 30℃, 流动相为乙腈-磷酸二氢钾缓冲液(pH=3.55)(40 : 60, V/V), 流速为1.0 mL/min, 检测波长为260 nm, 一次进样量20 µL。
1.4.3 方法学试验
1.4.3.1 标准曲线的制备
取空白血浆0.25 mL置于1.5 mL离心管中, 加入不同浓度的氨苯砜标准溶液0.25 mL, 使其终质量浓度分别为0.01, 0.02, 0.05, 0.1, 0.2, 0.5, 1, 5, 10 mg/L,然后按“1.4.1”方法操作, 每个样品重复测定5次。以平均峰面积为纵坐标, 质量浓度为横坐标做氨苯砜浓度的标准曲线, 求出回归方程和相关系数。
1.4.3.2 回收率的测定
取空白血浆, 分别加入氨苯砜标准溶液, 制成含氨苯砜 0.25, 2.5, 10 mg/L 3个质量浓度的血样,按样品方法处理后进行测定, 每一浓度设5个重复。获得各样品的峰面积, 再按血浆标准曲线回归方程计算得氨苯砜的浓度值, 并与原来加入量比较, 计算方法回收率。即:

1.4.3.3 方法精密度测定
将上述 0.25, 2.5, 10 mg/L氨苯砜血样, 按“1.4.1”方法处理后进行测定, 每一浓度设 5个重复。每个浓度日内测定5次, 日间测定5次, 计算日内变异和日间变异。
1.5 ERND活性测定
1.5.1 肝微粒体悬液的制备
取出肝脏, 除去脂肪和结缔组织, 用冰凉的0.9%生理盐水漂洗3次, 洗净血污, 滤纸吸干、称质量、将肝转入小烧杯, 用剪刀剪碎肝脏, 转入预冷的手动玻璃Potter匀浆器。按1 : 5(W/V)的比例加入冰冷的匀浆缓冲液, 置冰浴中制成匀浆。先加入3 mL/g匀浆缓冲液, 上、下8次, 制成肝匀浆, 转移到离心管中, 再用2 mL匀浆缓冲液倒入匀浆器中冲洗, 合并两次溶液, 混匀。所有操作均在4℃下进行。匀浆液先以10 000 g, 2℃离心30 min, 弃去沉淀, 取上清液, 即得肝微粒体(MS), 即 S9部分[6], 分装于离心管中, −80℃保存备用。
1.5.2 肝微粒体蛋白浓度测定(BCA法)
1.5.2.1 用牛血清蛋白作标准曲线
BCA试剂分A、B两部分, 使用前按A:B=50:1的比例配制成BCA试剂工作液。各取质量浓度为0.5 g/L的牛血清蛋白标准液0, 2, 4, 8, 16, 20, 24, 32, 40µL, 补充标准品稀释液至40 µL。加200 µL BCA试剂工作液; 混匀后 37℃放置 30 min, 以不含蛋白的试剂为空白对照, 562 nm处比色。以系列浓度的牛血清蛋白为横坐标, OD值为纵坐标绘制标准曲线, 进行线性回归, 求得牛血清蛋白浓度线性回归方程。
1.5.2.2 微粒体样品蛋白浓度测定
将微粒体蛋白样品稀释10倍, 取40 µL稀释液加200 µL BCA试剂工作液, 其余步骤同标准曲线制作, 测定各样品的OD值, 根据标准曲线及稀释倍数计算样品蛋白浓度, 并换算成每克肝中所含的微粒体蛋白含量。
1.5.3 ERND活性测定
1.5.3.1 甲醛标准曲线的制备
先取甲醛溶液0, 0.1, 0.2, 0.4, 0.6, 0.8 mL, 根据情况设定, 用蒸馏水补足至2 mL(此时各试管甲醛终量浓度为: 0, 0.1, 0.2, 0.4, 0.6, 0.8 nmol/mL。再加Nash试剂2 mL, 60℃水浴10 min, 取出后自来水冷却5 min。以空白管调零, 在420 nm处测OD值。以甲醛终浓度为纵坐标, OD值为横坐标制作甲醛标准曲线。
1.5.3.2 ERND活性测定
取0.1 mol/L PBS(pH7.4)1.7 mL, 加微粒体蛋白悬液0.1 mL, 红霉素0.1 mL, 25 ℃水浴温孵2 min后, 测定管加10 mmol/L还原型辅酶Ⅱ(nicotinamide adenine dinucleotide 2'-phosphate,简称 NADPH) 0.1 mL, 空白管加蒸馏水0.1 mL, 25 ℃水浴30 min。各管均加 ZnSO40.35 mL, 混匀, 冰浴 5 min, 加饱和Ba(OH)220.35m L, 混匀, 室温放置5 min后, 11 000 r/min, 离心10 min, 取上清液2 mL, 加Nash试剂2 mL, 60 ℃水浴10 min, 拿出后再冷却5 min, 测酶活。
1.5.3.3 酶活计算
以每毫克蛋白质每分钟使甲醛增加的量表示酶活性。计算公式:
甲醛 (HCHO) nmol/(mg·min)=(OD酶管-OD非酶管)×K×4/10 min(K 为从标准曲线上求得 OD, 相当于HCHO nmol/L数)
1.6 数据分析与处理
实验数据以均值±标准差(Mean±SD)表示, 将所得的药物浓度-时间数据采用药代动力学专用软件DAS2.1.1软件处理, 分别按一、二和三室模型拟合药动学参数, 选择最佳房室模型, 计算药代动力学参数, 通过SPSS13.0软件进行显著性检验。
2 结果
2.1 探针药物氨苯砜间接测定
2.1.1 色谱分析
在上述的色谱条件下, 基线平稳, 药峰与杂峰分离良好, 氨苯砜的保留时间稳定, 出峰时间在10.105 min, 无干扰峰出现。图1分别是空白血浆、空白血浆加入氨苯砜和体内注射氨苯砜后的色谱行为。
2.1.2 标准曲线、回收率与精密度
在本试验液相色谱条件下, 将空白血浆加入相应的标准溶液, 预处理后进行HPLC分析, 计算氨苯砜峰面积(A)对氨苯砜的浓度(C)进行线性回归, 氨苯砜 回 归 方 程 为 A=1006.735C−18.121 (n=5, r=0.9999)。结果表明: 血浆中的氨苯砜在 0.01~10 mg/L质量浓度范围内与峰面积之间的相关性好, 血浆中氨苯砜的最低检测限为 0.01 mg/L, 信噪比(Signal/Noise, 简称S/N)>3。氨苯砜低、中、高(0.25,2.5, 10 mg/L)3种质量浓度的血浆样品的回收率在94.0%~99.2%, 日内变异和日间变异系数均<5%,符合生物样品测定要求。
2.1.3 甘草和连翘对氨苯砜血药浓度的影响
对照组、甘草组和连翘组的牙鲆腹腔注射探针药物后, 测得的血浆浓度如图2所示, 甘草组和连翘组各时间点氨苯砜的平均血药浓度均低于对照组。
2.1.4 甘草和连翘对牙鲆体内氨苯砜药代动力学参数的影响
药动学数据经药代动力学专用软件DAS2.1.1处理, 分别用单室、双室、三室模型进行拟合后, 氨苯砜同二室模型相吻合, 权重为 1/C/C, 其主要药代动力学参数见表1。
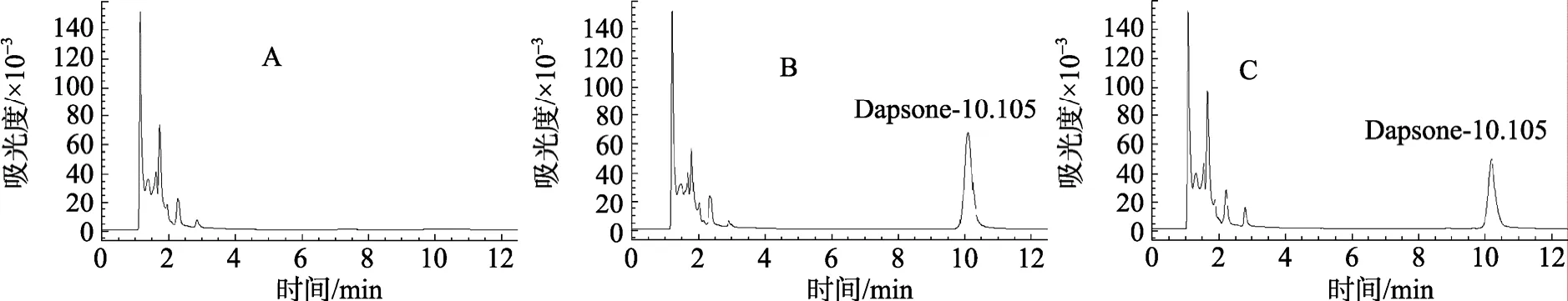
图1 空白血浆(A)、加入氨苯砜的标准血浆(B)和体内注射氨苯砜后的样品血浆(C)的色谱Fig. 1 Representative HPLC chromatograms of (A) blank fish plasma, (B) plasma spiked with dapsone standard, and (C)plasma sample after injections of dapsone
和对照组相比, 甘草组和连翘组氨苯砜的消除半衰期(t1/2β)分别降低了 4.51%(P>0.05)和 36.8%(P<0.01); 药时曲线下面积(area under the concentrationtime curve, 简称 AUC)分别减小了 8.28%(P>0.05)和32.3%(P<0.01)总清除率(the total body clearance, 简称CL)分别增加了 5.63%(P>0.05)和 99.3%(P<0.01)。

表1 甘草和连翘对牙鲆单次腹腔注射氨苯砜(10mg/kg)后主要药代动力学参数的影响(n=5)Tab. 1 Effects of Glycyrrhiza uralensis or Forsythia suspense on main pharmacokinetic parameters of dapsone after a single intraperitoneal administration at 5mg/kg to Paralichthys olivaceus (n=5)

图 2 甘草和连翘对牙鲆单次腹腔注射氨苯砜(5mg/kg)后血药浓度的影响(n=5)Fig. 2 Plasma concentrations of Glycyrrhiza uralensis or Forsythia suspensa after single intraperitoneal administration in dapsone at 5mg/kg(n=5)
2.2 红霉素-N-脱甲基酶活性
2.2.1 牛血清白蛋白标准曲线
BCA法测定肝微粒体蛋白质含量。以系列浓度牛血清白蛋白为横坐标, 相应的 Y 值(OD 值)为纵坐标, 得线性回归方程为Y=1.5806X+0.1488, 相关系数r=0.995。该方法的检测范围为0.01~0.05 mg/L,最低检测限为0.01 mg /L。
2.2.2 甲醛标准曲线
以系列浓度的甲醛为横坐标, 相应的 OD值为纵坐标, 得线性回归方程为 y=3.0191x+0.0195, 相关系数 r=0.9996。该方法中甲醛为 0.10~0.80 µmol/L质量浓度范围内与 OD值有良好的线性关系, 最低检测限为0.10µmol/L。
2.2.3 甘草和连翘对牙鲆肝微粒体蛋白浓度和ERND活性的影响
试验数据采用Microsoft Excel 2003软件进行统计分析, 结果以均数±标准差(mean±SD)形式表示,用t检验(Student’s t-test)进行平均数间的差异显著性分析。牙鲆经甘草和连翘处理后, 其蛋白浓度和ERND活性测定结果见表2。

表2 两种药物对牙鲆红霉素-N-脱甲基酶活性的影响Tab. 2 Effect of the two drugs on erythromycin N-demethylase activity in Paralichthys olivaceus(n=10)
3 讨论
3.1 氨苯砜色谱条件的优化
三乙胺可以较好地改善峰形, 防止脱尾, 经过反复实验, 三乙胺的加入量以0.2 mol/L为最好。在所选择流动相条件下, 保留时间适当, 峰形良好, 且与杂峰具有较好的分离度。
在血浆样品预处理方法的选择上, 对有机溶剂萃取法“加氯仿-离心-取有机相-氮气吹干-流动相溶解-进样”和“加乙腈-取上清-进样”进行比较。结果发现,单纯用乙腈时对血浆蛋白的清除更为彻底, 能获得非常清澈的无蛋白上清液。由于减少了氮气吹干浓缩、复溶等多个步骤, 该方法不仅极大地降低了工作强度,而且操作步骤少, 可直接应用外标法进行分析, 减轻了使用内标法定量分析对分辨率的要求。
流动相 pH和乙腈浓度对氨苯砜的分离均有一定影响, 为此进行了优化试验。对上述2因素各取5水平流动相pH值: 3.5, 4, 4.5, 5, 5.5; 乙腈含量: 45%,40%, 35%, 30%, 25%进行研究。结果表明, 影响峰形的是流动相 pH, 在 pH3.5时出的峰比较尖锐, 无托尾或前延现象。影响出峰时间主要是乙腈浓度, 在25%~45%乙腈浓度范围内, 乙腈比例提高 5%, 其保留时间可缩短0.826 min左右。因考虑到前5 min内有杂峰出现, 尽量保证在5 min后出峰, 因此选用最佳组合流动相pH3.5, 乙腈比例40%作为色谱条件。
3.2 甘草和连翘对牙鲆肝微粒体中 ERND活性的影响
目前, 国内外相关研究主要集中在环境污染物对鱼类CYP450的影响, 关于鱼类CYP450在药理学中的研究仅见于氟苯尼考、喹酸和氟甲喹等渔药口服给药后对鱼类 CYP450活性的影响[7,8], 但关于中药对鱼类 CYP450的研究在国内外尚属空白。近年来在人和鼠实验动物上有关中草药对 CYP450影响的报道逐渐增多, 如葛根(Pueraria lobata)、栀子(Gardenia jasminoides)、甘草(Glycyrrhiza uralensis)、人参(Panax notoginseng)、黄芩(Scutellaria baicalensis)等及其单体化合物黄芩苷、栀子苷、甘草甜素等都对P450酶有调控作用。
CYP3A是肝脏混合功能氧化酶系的主要成分,在内源性和外源性化合物的生物转化中起重要作用。鱼类的CYP450主要位于肝内质网膜, 也少量存在于鳃、肾、心等肝外组织[9], 相关研究已证实了鱼类 CYP3A基因的存在[10], 红霉素 N-脱甲基酶是反映CYP3A活性的标志酶。
本实验测得对照组的肝微粒体蛋白含量为7.076±0.47 mg/g肝质量, 与陈大健[7]报道的鲫鱼肝微粒体蛋白含量 5.238mg/g±0.397 mg/g肝质量基本相吻合。本实验检测到牙鲆的红霉素-N-脱甲基酶活性为 0.0567 nmol/(mg⋅min)±0.0038 nmol/(mg⋅min),和 Vaccaro等[11]在用作对照的未作任何处理的舌齿鲈(Dicentrarchus labrax)上测得的活性 1.162 nmol/(mg⋅min)±0.200 nmol/(mg⋅min)相比稍低, 但和哺乳动物的该酶活性相比都相对较低, 可能与哺乳动物CYP3A占 P450总量的比例最高相关。很多研究表明, CYP3A也是鱼类消化道和呼吸道表达的主要CYP450组分。而实际水产养殖中, 鱼类的用药方式亦几乎都是通过消化道途径。因此, 可以推测CYP3A也可能在鱼类口服药物的首过消除中起着主要作用。
由表2可以看出, 和对照组相比, 甘草组和连翘组 ERND活性明显升高, 分别提高了 1.79倍、4.87倍, 差异极显著, 说明甘草和连翘对 CYP3A的活性有极显著的诱导作用。与谭毓治等[12]报道的甘草主要活性成分甘草酸能诱导小鼠肝微粒体P450水平使其含量及活性增加的结果相符合。
3.3 探针药物法间接评价甘草和连翘对牙鲆CYP3A活性的影响
本实验特点是通过探针药物氨苯砜的代谢速率间接反映了受试药物对CYP3A活性的影响, 国内外均没有利用探针药物研究鱼类CYP3A活性的文献报道。目前哺乳动物上用于测定体内CYP3A活性的常用探针药物有: 氨苯砜[13]、咪达唑仑[14]和红霉素[15]。因红霉素与可的松的实验条件比较苛刻, 需避光操作, 所以选择氨苯砜作为检测CYP3A酶活性的探针药物。
研究结果表明: 对照组牙鲆氨苯砜的t1/2β为13.301 h, 而胡屹屹等[5]报道的在猪体内氨苯砜的t1/2β为 4.205 h, 可见鱼和哺乳动物的t1/2β差异很大,说明同种药物在不同物种中的消除时间存在较大差异。在哺乳动物内CYP3A占P450总量的比例最高,是参与口服药物首过效应的主要酶系, 在肝微粒体水平上实验结果也表明CYP3A标志性酶ERND活性比哺乳动物低得多, 所以哺乳动物代谢氨苯砜的速率相对来说比较快。
口灌甘草6 d后, 氨苯砜的t1/2β、CL和AUC分别为12.701 h、0.150 kg /(L⋅h)和16.121 mg/(L⋅h), 与对照组比较,t1/2β减小了4.51%, CL增加了5.63%, AUC减小了8.28%,与对照组比较差异不显著, 说明对牙鲆血浆中氨苯砜的代谢率没有显著影响, 这可能意味着甘草对CYP3A的诱导作用不强。而文献报道[12]的高剂量甘草(490 mg/kg)对小鼠肝药酶有显著诱导作用, 说明诱导作用强弱可能与剂量有关。高同银等[16]认为甘草甜素及水解后生成的葡萄糖醛酸具有保肝解毒和诱导药酶加工处理毒物之功能。据报道[17], 甘草还明显表现出对CYP1A2的诱导作用。说明同种药物可以影响多个CYP450亚酶活性, 提示其在与CYP酶代谢有关的药物合用时, 应充分考虑其对酶影响的差异, 以避免可能的毒性或不良反应。
连翘组氨苯砜的t1/2β、CL和AUC分别为8.401 h、0.283 kg /(L⋅h)和 11.900 mg/(L⋅h), 与对照组比较,t1/2β减小了 36.8%; CL增加了 99.3%; AUC减小了32.3%, 牙鲆的代谢和排泄加快, 表明连翘对牙鲆CYP3A活性具有显著的诱导作用。与闫淑莲[18]报道的用连翘对大鼠CYP3A有诱导作用的结论相符。据报道[19]给予连翘提取物可使大鼠 CYP3A的活性增加1倍,人体内也有相似的结果[20]。这与在肝微体水平上, 甘草和连翘对牙鲆CYP3A有诱导作用的结果基本是一致的。孕烷受体(pregnane X receptor, 简称PXR)是 CYP3A 基因表达的转录活化因子, 调节CYP3A和其他酶及转运体的表达, CYP3A诱导作用与 PXR结合有关[21,22]。CYP3A的种属差异与 PXR分子结构的不同有关, 在哺乳动物中, CYP3A的诱导机制由亲脂性的化学物包括激素等激活PXR参与的[23,24]。
为了增强治疗效果, 临床上中药常与抗菌药结合使用, 一些中药和西药之间的相互作用逐渐引起人们的关注。甘草是肝药酶诱导剂, 据张锦楠[25]报道,服用甘草的大鼠肝微粒体P450水平显著升高, 使丙咪嗪、氨茶碱、安替比林[26]合用时, 使后者代谢加速,半衰期缩短、药效减弱。还有诸多文献报道大剂量甘草及其制剂与四环素、红霉素、氯霉素等抗生素联用, 可降低这些药物的吸收率[27]。其诱导机制可能是多方面的, 确切机制尚需做大量甘草单体成分等研究工作据报道。
近年来, 抗生素、杀虫剂、激素等非营养性药物添加剂在配合饲料中长期使用, 导致养殖产品药物残留增加, 进而危害动物和人体的健康。中草药饲料添加剂药源丰富, 在动物体内毒副作用低, 集营养保健、预防疾病和促进生长于一体。中药就其物质基础而言是大量单体化合物的混合物, 起药理作用的是其主要的活性成分, 因而同样面临着肝 CYP对它的氧化代谢作用。由于甘草和连翘作为添加剂无形中和药物联合使用越来越普遍, 研究中草药对CYP450酶活动影响, 特别是代谢大多数药物的CYP3A家族的影响研究, 不但可以为合理使用中药提供理论依据, 还可为中药与中药间的相互作用及中西药物的合理配伍应用, 提供具体指导原则。
[1] Slaughter R L, Edwards D J. Recent advances: The cytochrome P450 enzymes[J]. Ann Pharmacother,1995, 29: 619.
[2] Rendic S, Di Carlo F J. Human cytochrome P450 enzymes: a status report summarizing their reactions,substrates inducers and inhibitors[J]. Drug Metab Rev,1997, 29(1-2): 413-580.
[3] 王文博, 方平, 林小涛. 甘草粗提取物对鲫的免疫调节作用[J]. 水生生物学报, 2007, 31(5): 655-660.
[4] 农业部“渔药手册”编撰委员会. 渔药手册[M]. 北京:中国农业出版社, 2005. 349.
[5] 胡屹屹, 杨海峰, 江善祥. Flunixin对猪肝微粒体细胞色素 P450酶系的影响[J]. 中国兽医科学, 2006,36(12): 992-995.
[6] 徐叔云, 卞如濂, 陈修. 药理实验方法学[M].第2版.北京: 人民卫生出版社, 1991.488-497.
[7] 陈大健, 冯秀娟. 江善祥. 探针药物动力学研究氟本尼考和乙醇对鲫 CYP2E1活性的影响[J]. 上海水产大学学报, 2008, 17(1): 34-39.
[8] Moutou K A, Burke M D, Houlihan D F. Hepatic P450 monooxygenase response in rainbow trout administered aquaculture antibiotics[J]. Fish Physiol Biochem, 1998,18(1): 97-106.
[9] Goksoyr A, Forlin L. The cytochrome P-450 system in fish: Aquatic toxicology and environmental monitoring[J]. Aquat Toxicol, 1992, 22: 287-312.
[10] Celander M, Stegeman J J. Isolation of a cytochrome P450 3A cDNA sequence (CYP3A30) from a marine teleost Fundulus heteroclitus and phylogenetic analyses of CYP3A genes [J]. Biochem Biophys Res Commun,1997, 236: 306-312.
[11] Vaccaro E, Giorgi M, Longo V, et al. Inhibition of cytochrome P450 enzymes by enrofloxacin in the sea bass (Dicentrarchus labrax) [J]. Aquatic Toxicology,2003, 62: 27-33.
[12] 谭毓治, 陈锦英, 兰小平, 等.甘草对小鼠肝药酶的影响[J].中药通报, 1986, 11(10): 55.
[13] Thummel K E, Shen D D, Podoll T D, et al.Use of midazolam as a human cytochrome P450 3A probe: in vivo and in vitro correlation in liver transplantation patients[J]. J Pharmaco Exper Ther, 1994, 271: 549.
[14] 程泽能, 张毕奎, 李菲, 等. 中药止咳橘红颗粒对CYP3A4和CYP1A2抑制作用的研究[J]. 中国临床药理学杂志, 2002, 18(3): 215-218.
[15] 陈景衡, 金念祖, 茅力, 等. 罗格列酮对大鼠肝细胞色素P450 3A活性的影响[J]. 药学进展, 2002, 5: 292-294.
[16] 高同银, 崔同淑, 孙国香.浅谈甘草解毒作用[J].河北中医, 1994, 16(3): 46.
[17] 何益军, 石苏英, 金科涛, 等.甘草与大戟甘遂芫花配伍对大鼠肝脏细胞色素P4501A2酶活性的影响[J].中国药物与临床, 2007, 7(4): 278-280.
[18] 闫淑莲, 扈金萍, 徐艳霞, 等. Cocktail探针药物同时评价连翘对肝细胞色素P450的影响[J]. 中国药学杂志, 2003, 38(10): 761-763.
[19] Bray B J, Perry N B, Menkes D B, et al. St. John’s wort extract induces CYP3A and CYP2E1 in the Swiss Webster mouse [J]. Toxicol Sci, 2002, 66: 27-33.
[20] Wang LS, Zhou G, Zhu B, et al. St John’swort induces both cytochrome P450 3A4-catalyzed sulfoxidation and 2C19-dependent hydroxylation of omep razole [J]. Clin Pharmacol Ther, 2004, 75: 191-197.
[21] Masuyama H, Hiramatsu Y, Mizutani Y, et al. The expression of pregnane X receptor and its target gene,cytochrome P4503A1, inperinatal mouse[J]. Mol Cell Endocrinol, 2001, 172(1-2): 47-56.
[22] Le Culyse E L. Pregnane X receptor: molecular basis for species differences in CYP3A induction by xenobiotics[J]. Chem Biol Interact, 2001, 134(3): 283-289.
[23] Kliewer S A, Goodwin B, Willson T M. The nuclear pregnane X receptor: a key regulator of xenobiotic metabolism. Endocr[J]. The Endocrine Reviews, 2002,23: 687-702.
[24] Masuyama H, Hiramatsu Y. Endocrine disrupting chemicals, phthalic acid and nonylphenol, activate Pregnane X receptor-mediated transcription[J]. Mol Endocrinol, 2000, 14: 421-428.
[25] 张锦楠, 李亚伟, 徐艳霞, 等. 甘草和五味子对大鼠肝微粒体 CYP450诱导作用的研究[J]. 中国药学杂志, 2002, 6(37): 424-426.
[26] 徐君辉, 李士敏. 甘草提取液与甘草酸对小鼠安替比林代谢影响的比较研究[J]. 中成药, 2007, 11: 1 673-1 675.
[27] 来庆霞, 吴清苏. 中药与抗生素的配伍禁忌[J]. 山东医药, 1998, 38(5): 56.
Received: Dec., 24, 2009
Key words:CYP3A activity; Glycyrrhiza uralensis; Forsythia suspensa; Dapsone; Paralichthys olivaceus
Abstract:The effects of Glycyrrhiza uralensis (GU) and Forsythia suspense (FS) on activities of cytochrome CYP3A in Paralichthys olivaceus were studied. Fishes were divided into three groups as follows: GU and FS group were administered orally for six days at 30mg/kg·bw and 100mg/kg·bw, respectively; fish in the control group were given an equal volume of normal saline (0.9%). Seven day after the injection, the activities of CYP3A were measured directly and indirectly. We found that on the level of liver microsomes, GU and FS both increased erythromycin N-demethylase activity significantly by 1.79 times and 4.87 times respectively. Compared with the normal saline-treated control group, metabolism of dapsone in FS and GU group were higher than that in the control group,the elimination half -lives were shortened by 4.51% (P>0.05) and 36.8% (P<0.01), respectively. Area under the concentration-time curve were shortened by 8.28% (P>0.05) and 32.3% (P<0.01), respectively; and the total body clearances were increased by 5.63% (P>0.05) and 99.3% (P<0.01), respectively. The results showed that GU and FS can significantly induced the activity of CYP3A; and the induction effect of FS is higher than GU. A drug’s efficacy and safety may be affected by other drugs used concomitantly.
(本文编辑:谭雪静)
Effects of Glycyrrhiza uralensis and Forsythia suspensa on cytochrome CYP3A in Paralichthys olivaceus
HAN Xian-qin1,2, LI Jian1,2, LI Ji-tao1
(1. Key Laboratory of Sustainable Utilization of Marine Fishery Resources of the Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Science, Qingdao 266071, China; 2. National Center for Quality Supervision and Test of Aquatic Products, Qingdao 266071, China)
S948
A
1000-3096(2010)12-0019-07
2009-12-24;
2010-01-13
公益性行业专项 (nyhyzx07-046); 国家自然科学基金资助项目(30700617)
韩现芹(1981-), 女, 硕士生, 主要从事鱼类药物代谢与残留检测研究, 电话: 13553086082, E-mail: xianqinhan@yahoo.com.cn; 李健, 通信作者: 电话: 0532-85830183, E-mail: Lijian@ysfri.ac.cn
