麻痹性贝毒对肝脏和肾脏氧化损伤的影响
2010-09-24程金平张鉴达宋玉玲王文华于金莲
陈 雪, 程金平 张鉴达 宋玉玲 王文华 于金莲
(1. 上海交通大学环境科学与工程学院, 上海200240; 2. 上海师范大学生命与环境科学学院, 上海 200234)
麻痹性贝毒对肝脏和肾脏氧化损伤的影响
陈 雪1,2, 程金平1, 张鉴达1, 宋玉玲1, 王文华1, 于金莲2
(1. 上海交通大学环境科学与工程学院, 上海200240; 2. 上海师范大学生命与环境科学学院, 上海 200234)
为了探讨麻痹性贝毒(PSP)对肝脏和肾脏损伤的机制, 采用膝沟藻毒素 GTX-1, 4对小鼠进行急性暴露, 剂量为1μg/kg, 时间分别为60、90、120min。结果发现, 与对照组相比, 肝脏染毒组中的还原型谷胱甘肽(GSH)含量没有显著变化; 在肾脏中, 60 min时染毒组GSH含量没有明显变化, 90、120 min时GSH含量降低 ; 两器官中抗氧化酶(GSH-Px、SOD)活性与对照组相比均无显著变化(P>0.05)。从而推断, GSH参与了PSP对肾脏损害的毒性过程; 肾中GSH含量有可能作为PSP早期检测的敏感指标。
麻痹性贝毒; 氧化损伤; 肝脏; 肾脏
麻痹性贝毒(paralytic shellfish poisoning, PSP)是一类阻断神经细胞钠离子通道, 对人体神经系统产生麻痹作用的海洋生物毒素, 主要来源于可导致赤潮的海洋甲藻[1]。在目前已知的海洋藻类毒素中,PSP被认为是发生频率最高、对人类影响最为严重的毒素, 因此成为海洋科学研究的重点之一。人们已对PSP的毒性特点、代谢途径和贝类水产品中PSP污染状况进行了大量的研究工作[2,3]。近年来, 利用有机毒物引起的机体生态效应的改变作为敏感的生物指标, 监测和评价微量有机毒物的危害[4], 已受到国内外普遍关注。
PSP毒素在体内代谢转化, 产生自由基, 自由基的过量生成会导致膜系统发生脂质过氧化, 进一步损害靶器官。根据研究发现[5]PSP对动物肝、肾功能损害相对比较严重, 造成这种情况的原因可能与PSP的代谢有关。PSP引起组织氧化损伤的实验研究,尤其是对肝肾形态学的观察, 国内尚无相关文献报道。因此本实验选择肝肾为研究对象, 探讨 PSP对小鼠的氧化损伤及其毒性影响, 旨在为进一步研究脂质过氧化发生的途径提供理论依据, 并为海洋PSP污染的早期预报及监测提供依据。
1 材料与方法
1.1 实验材料
动物取材为健康的 ICR品系成年小鼠, 体重25~30g, 由上海斯莱克实验动物有限责任公司提供;标准品为膝沟藻毒素 GTX-1, 4, 购于加拿大海洋生物研究所; 双硝基二硫代苯甲酸(DTNB, 99%)、还原型谷胱甘肽(GSH, 98%)均购于德国Merck公司。
1.2 实验方法
将实验小鼠分为6组, 每组5只。采用急性暴露方式, 将GTX-1, 4标准毒素稀释2500倍(质量浓度为0.02483μg/mL), 暴露组按照1μg/kg体重的剂量腹腔注射染毒, 对照组则注射等量的 HCl水溶液(pH=3), 暴露时间分别为60、90、120 min。处死后解剖小鼠内脏, 取出肝、肾组织块(0.2~1.0 g), 用生理缓冲液将组织制作成10 %匀浆液用于生化分析。测定肝肾组织中抗氧化指标以及抗氧化酶活性。
1.3 各指标测定[6~9]
GSH含量的测定采用 Beutler改良法; GSH-Px活力测定采用DTNB显色法; SOD活力测定采用改良Marklund方法。
1.4 统计分析
实验数据用统计学方法进行处理, 对实验组与空白对照组及实验组组间差异, 利用 SPSS11.0软件进行t检测和协方差分析。
2 结果
2.1 PSP对肝脏氧化损伤的影响
肝脏GSH、GSH-Px及SOD测定结果如表1所示。由表 1可以看出, 在各暴露时间点小鼠肝脏中GSH含量与对照组相比没有表现出显著变化(P>0.05); 抗氧化酶 GSH-Px、SOD活力与对照组比较均无显著差异(P>0.05)。协方差分析表明, 不同暴露时间下染毒组之间没有显著差别(P>0.05)。
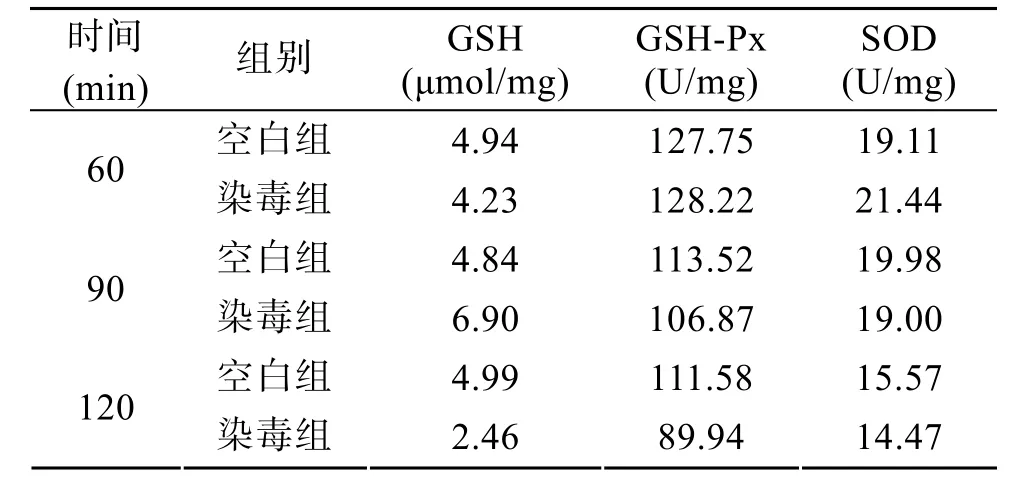
表 1 PSP对小鼠肝组织中 GSH水平及 GSH-Px、SOD活力的影响(n=5)Tab. 1 PSP affects GSH level and activities of GSH-Px and SOD in murine liver (n=5)
2.2 PSP对肾脏氧化损伤的影响
肾脏GSH、GSH-Px及SOD测定结果如表2所示。由表2可以看出, 暴露60 min时染毒组肾中GSH含量与对照组相比没有显著变化(P>0.05); 暴露90、120 min时肾中GSH含量明显降低(P<0.01)。协方差分析表明, 60、120 min染毒组相互之间不存在显著差别(P>0.05),但 120 min染毒组明显低于 90 min(P<0.01)。由此可知, 肾脏中GSH的含量在染毒后呈现降低趋势, 并且这种趋势具有持续性。暴露60、90、120 min染毒组肾脏中GSH-Px及SOD活力与空白组比较均无显著变化(P>0.05)。协方差分析表明, 染毒组三者之间没有显著差别(P>0.05)。
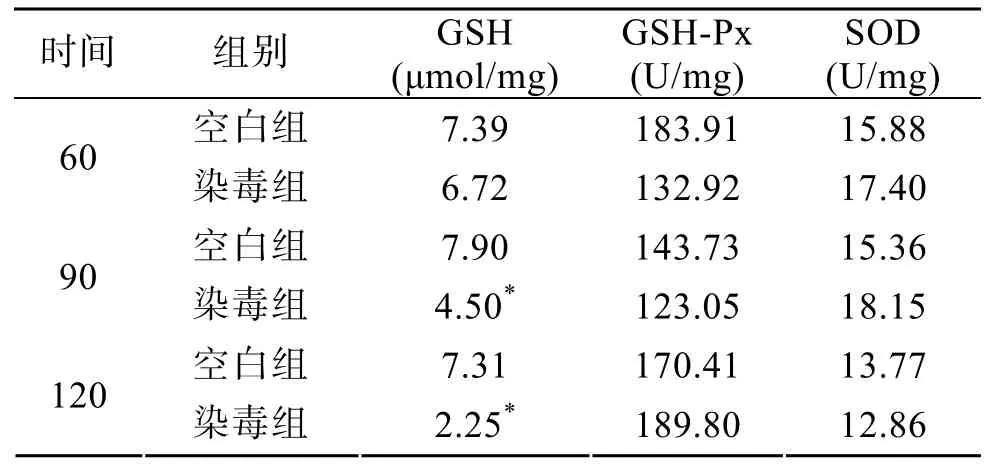
表 2 PSP对小鼠肾组织中 GSH水平及 GSH-Px、SOD活力的影响(n=5)Tab. 2 PSP affects GSH level and activities of GSH-Px and SOD in murine kidney(n=5)
3 讨论
生物体在长期的进化过程中, 形成了一套完整的保护体系——抗氧化系统来清除体内多余的活性氧。当 ROS的生成增加时, 机体会通过一定的调控系统增加抗氧化物质, 从而使机体增强对氧化损伤的抵抗能力[10]。
GSH是机体内抗氧化系统的重要组成部分, 它是一种低分子清除剂, 能够清除体内的超氧阴离子和其他氧自由基, 保护细胞完整性, 维持细胞正常代谢。细胞内GSH的水平对维持细胞抵抗氧化损伤的能力起着重要的作用, GSH的减少意味着体内氧化状态的加重, 因此GSH含量的多少是衡量生物体抗氧化能力大小的重要因素。本实验结果显示, 暴露90 min后小鼠肾中GSH含量发生显著变化(P<0.01)并且具有持续性, 说明肾脏的抗氧化能力减弱, PSP对肾脏的氧化损伤加重。可能原因是GTX-1, 4作用于靶器官肾, 改变了其中的氧化还原状态, 诱导了GSH清除自由氧的过程。当GSH消耗量过大时, 必将会引发酶失活、脂质过氧化等一系列氧化损伤。
SOD和GSH-Px是机体内清除ROS等自由基的特异酶类, 其活力的降低提示机体内自由基产生增加[11]。实验结果中两种酶类抗氧化剂SOD、GSH-Px活性均未观察到显著变化(P>0.05), 表明这两种指标的变化不敏感, 有可能是由于 PSP并不是直接作用于酶蛋白, 而是通过其他过程导致了体内活性氧升高, 从而导致抗氧化剂消耗量的增加。机体内GSH-Px的主要生物学作用是清除脂质氢过氧化物,在病理生理情况下活性氧可能导致脂质过氧化, 造成生物膜损伤甚至更广泛的组织损伤, 但是只要GSH-Px清除脂类氢过氧化物的效能不受到影响, 它对机体的损伤就可以得到减轻。实验中未观察到GSH-Px活力的显著变化, 由此推测在实验设计的时间内肝脏和肾脏尚未发生脂类过氧化物的显著升高,没有超过器官中GSH-Px清除能力[12]。
有研究证明, 肾脏对 PSP似乎更敏感, 一定剂量的 PSP可对肾功能造成损伤[5]。本实验结果表明,肾脏中GSH含量的变化具备了敏感性和持续性, 有作为 PSP早期预测指标的可能。本研究通过观察氧化损伤指标的变化, 在低剂量(1/10LD50i.p.)和短时间(120 min)时已观察到某些指标的显著变化, 并且个体在这种情况下并没有出现明显的行为反应, 体现了这种方法的早期预警效果, 而且从实验操作的难易程度、费用消耗方面都具有一定的优势。但是关于利用氧化损伤指标对海洋 PSP污染进行早期预警的可靠性, 仍需进一步研究证实。
[1] 江天久, 尹伊伟, 骆育敏, 等. 广东大亚湾和大鹏湾麻痹性贝类毒素研究[J]. 中国环境科学, 2000, 20(4):341-344.
[2] 邬建勇, 王金辉, 程祥圣. 上海市海产品市场的麻痹性贝毒检测和分析[J]. 毒理学杂志, 2006, 20(1):52-53.
[3] 江天久, 江涛. 中国沿海部分海域麻痹性贝毒研究[J]. 海洋与湖沼, 2007, 38(1): 36-41.
[4] 徐立红, 张甬元, 陈宜瑜. 分子生态毒理学研究进展及其在水环境保护中的意义[J]. 水生生物学报, 1995,19(2): 171-185.
[5] 刘洁生, 刘玉荣, 聂利华, 等. 大鼠低剂量长期摄入麻痹性贝毒的毒性研究[J]. 中国病理生理杂志, 2005,21(7): 1368-1373.
[6] Cheng J P, Yang Y C, Hu W X, et al. Effect of methylmercury on some neurotransmitters and oxidative damage of rats[J]. Journal of Environmental Science,2005, 17(3): 469-473.
[7] Cookson M R, Pentreath V W. Protective roles of glutathione in the toxicity of mercury and cadmium compounds to C6 glioma cells[J]. Toxicology in Vitro,1996, 10(3): 257-264.
[8] Cheng J P, Hu W X, Liu X J, et al. Expression of c-fos and oxidative stress on brain of rats reared on food from mercury-selenium coexisting mining area[J].Journal of Environmental Science, 2006, 18(4):788-792.
[9] JI X L, WANG W H, CHENG J P, et al. Free radicals and antioxidant status in rat liver after dietary exposure of environmental mercury[J]. Environmental Toxicology and Pharmacology, 2006, 22: 309-314.
[10] 方允中, 郑荣梁. 自由基生物学的理论与应用[M].合肥: 中国科技大学出版社, 2002.
[11] 胡卫萱, 王文华, 杨柳, 等. 腹腔注射甲基汞对大鼠脑中汞的积累及氧化性损伤[J]. 卫生毒理学杂志,2003, 17(3): 167-168.
[12] 刘景生. 细胞信息与调控[M]. 第2版. 北京: 中国协和大学出版社, 2004. 339-367.
Received: Dec., 9, 2008
Key words:paralytic shellfish poisoning (PSP); oxidative stress; liver; kidney
Abstract:Oxidative stress induced by paralytic shellfish poisoning (PSP) in liver and kidney was studied by comparing mice acutely exposed to GTX-1,4. The exposure dose was 1μg/kg with different durations of 60, 90 and 120 min. The results found that the contents of GSH in liver changed slightly; in kidney, the contents of GSH were significantly decreased at 90 and 120min. The activities of GSH-Px and SOD were changed slightly in both organs (P > 0.05). These data indicate that GSH is involved in kidney injury of PSP; GSH content in kidney may be a sensitive indicator for detecting PSP.
(本文编辑:张培新)
Effects of PSP-induced oxidative stress in liver and kidney
CHEN Xue1,2, CHENG Jin-pin1, ZHANG Jian-da1, SONG Yu-ling1, WANG Wen-hua1, YU Jin-lian2
(1. School of Environmental Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240,China; 2. Life and Environment Sciences College, Shanghai Normal University, Shanghai 200234, China)
Q179.1
A
1000-3096(2010)12-0093-03
2008-12-09;
2009-03-10
上海科委科技攻关项目(08dz1206302)
陈雪(1983-), 女, 安徽合肥人, 硕士, 主要从事海洋环境
领域的研究, 电话: 021-54742823; 通信作者, 程金平, 副教授, 电话:021-54742823, 13916873206, E-mail: jpcheng@sjtu.edu.cn
