小球藻的絮凝沉降及溶气气浮采收研究
2010-09-24高莉丽刘天中彭小伟陈晓琳
高莉丽, 刘天中, 张 维, 彭小伟, 陈晓琳
(1. 中国海洋大学 食品科学与工程学院, 山东 青岛 266003; 2. 中国科学院 青岛生物能源与过程研究所 生物燃料重点实验室, 山东 青岛 266101)
小球藻的絮凝沉降及溶气气浮采收研究
高莉丽1, 刘天中2, 张 维2, 彭小伟2, 陈晓琳2
(1. 中国海洋大学 食品科学与工程学院, 山东 青岛 266003; 2. 中国科学院 青岛生物能源与过程研究所 生物燃料重点实验室, 山东 青岛 266101)
研究了氢氧化钠对不同生长时期小球藻液的絮凝效果, 比较了絮凝沉降法和溶气气浮法的采收效果, 并初步优化了气浮操作参数。结果表明, 在小球藻液中添加氢氧化钠能够取得很好的絮凝效果,添加700 mg/L氢氧化钠, 沉降30 min即能达到90%的沉降采收率; 同等氢氧化钠添加量下, 溶气气浮法的采收效果要优于絮凝沉降法; 确定的气浮采收最佳操作参数: 指数生长期和稳定期藻液的最佳氢氧化钠添加量分别为350 mg/L和600 mg/L, 溶气水进水流速为60 L/h, 溶气水/藻液体积比为25%。絮凝沉降法中指数生长期和稳定期的小球藻液采收效果相差不大, 而溶气气浮法中同等采收条件下指数生长期的采收率高于稳定期, 其采收浓缩倍数也略高于稳定期。
小球藻; 氢氧化钠; 絮凝沉降; 溶气气浮; 生长时期
小球藻是具有多方面经济价值和科研价值的天然资源, 有着巨大的应用潜力[1~4]。随着小球藻的大规模养殖, 选择合适的方法来进行小球藻生物量的采收显得越来越重要。通常采用动力离心、过滤和絮凝沉淀等分离方法来采收小球藻[5], 离心分离法设备操作简单, 对产品无污染, 但设备投资高, 能耗大; 过滤法对微藻细胞的损害较小, 但滤膜极易被藻细胞堵塞, 且因为藻质较轻容易飘起, 滤饼较难形成, 过滤效率较低[6]; 絮凝沉淀法具有方便快捷的特点, 但使用的絮凝剂和藻细胞完全黏附, 必须在后续工艺加以去除, 增大了操作难度也加大了生产成本[7]。
气浮技术采用人为方式, 向水体导入气泡, 使其黏附于絮粒上, 从而大幅度地降低絮粒整体密度,并借气泡上升的速度, 强行使其上浮, 由此实现固液快速分离, 由于其良好的分离效能、相对低廉的投资和运营成本, 现已广泛地运用于化工、造纸、印染、食品、制药、废水及饮用水的处理上, 在微藻细胞的分离和采收领域也得到了成功应用[8]。当前, 利用气浮法采收小球藻已取得较好效果[9], 但是由于需要添加一定量的絮凝剂在体系中形成合适尺寸的絮粒,增加了后续处理的负担, 也不利于培养液的循环利用。
研究表明, 盐藻、螺旋藻气浮采收中可以通过调节藻液pH来使藻细胞产生自絮凝[10,11], 但在碱添加量对采收效果的影响方面研究较少。本文以两种培养时期的小球藻为研究对象, 探讨了添加氢氧化钠使小球藻产生絮凝的可行性, 考察了氢氧化钠添加量与藻液pH的关系, 建立了氢氧化钠添加量与絮凝沉降法和溶气气浮法采收效果的关联, 并初步优化了气浮操作条件, 以期对工业化生产起到一定的指导作用。
1 材料与方法
1.1 仪器
PHS-2F型pH计(上海精密科学仪器有限公司);WFJ7200型分光光度计(上海尤尼柯仪器有限公司);LZB-4玻璃转子流量计(江阴市科达仪表厂); HJ-1型磁力搅拌器(江苏省金坛市荣华仪器制造有限公司)。
1.2 藻种及其培养
小球藻藻种由中国海洋大学水产学院朱葆华老师提供, 原始藻种储存于中国海洋大学藻种库。用f/2培养基进行小球藻培养, 由于藻液中细胞具有特定的颜色, 对可见光产生一定的吸收, 所以测定藻液在540 nm处的吸光度值(A540), 以A540值来间接表示小球藻的生物量[12], 生长曲线如图 1所示, 其调整期较短, 2~18 d之间为对数生长期, 此后再延长培养时间, 生物量无明显变化。为考查不同生长时期对实验结果的影响, 分别选取培养时间为10 d处于指数生长期和培养时间为20 d处于稳定期的藻液进行实验。

图1 小球藻生长曲线Fig. 1 Growth curve of Chlorella
1.3 絮凝沉降实验
分别取对数生长期和稳定期的小球藻藻液200 mL置于 500 mL烧杯中, 再加入一定量的1 mol/L的氢氧化钠溶液, 先快速(100 r/min)搅拌2 min, 使氢氧化钠充分分散在溶液中, 再慢速(40 r/min)搅拌10 min后将其倒入250 mL量筒中静置沉降后, 测量絮状物沉降高度, 并于液面下 3 cm深处取上清液测定A540。
1.4 气浮分离装置与实验方法
气浮分离实验装置如图 2所示, 其主要由空气压缩机、贮气罐、饱和溶气罐、流量计和气浮分离塔等部分组成。其中, 由碳钢制成的空气贮罐有效容积为100 L, 操作压力为0~1.0 MPa; 由不锈钢制成的饱和溶气罐有效容积为 5 L, 操作压力为 0~1.0 MPa; 气浮分离塔由有机玻璃制成, 其内径为30 mm,高度为500 mm。
气浮实验流程为: 实验前, 先向饱和溶气罐中一次性通入大约4 L水, 打开空气压缩机向贮气罐内灌气, 保持一定的溶气压力和溶气时间以制备溶气水。将絮凝后的小球藻藻液从分离塔上部倒入, 然后从塔底迅速引入溶气水, 控制其进水流速和进水体积, 藻细胞开始气浮, 10 min后分别计量采收残余液和浓缩液的体积, 并测定残余液的A540。
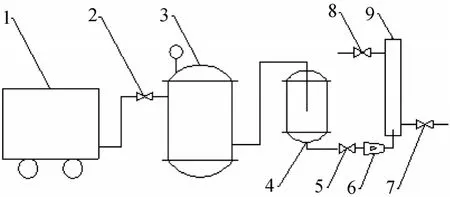
图2 气浮分离装置Fig. 2 The schematic of dissolved air flotation device
1.5 数据分析
采收率和浓缩倍数计算方法如下式所示:
其中cf—采收浓缩液的藻细胞浓度(以光密度值A表示),c0—原藻液藻细胞浓度,cr—采收残余液藻细胞浓度,Vf—浓缩液体积;V0—原藻液体积;Vr—采收残余液体积。
考虑到浓缩液中藻细胞易发生粘壁, 且其光密度值也过高, 测定误差较大, 因此采收浓缩液的藻细胞浓度cf是先测定采余残液的体积和藻细胞浓度(A值), 再通过物料衡算来确定的, 如下式所示。

2 结果与分析
2.1 氢氧化钠添加量对小球藻液pH的影响
在碱法絮凝气浮采收微藻细胞中, 多采用氢氧化钠调节藻液 pH, 因此实验考察了小球藻液 pH与氢氧化钠添加量的关系, 结果如图3所示, 在实验所用的氢氧化钠添加量150~900 mg/L下, 指数生长期藻液的 pH从 9.88增长到 10.18, 稳定期藻液的 pH从9.90增长到10.13, 两者均未有大幅度增长, 远低于理论计算值 11.57~13.35。这表明大部分氢氧化钠可能存在于絮粒中, 只有小部分的氢氧化钠残留于培养液中, 改变了培养液的 pH, 因此添加氢氧化钠絮凝小球藻对培养液的影响较小, 有利于培养液的循环利用。实验中还发现, 用稀酸可以很容易地对絮体进行解絮, 这对简化后续工艺, 降低生产成本有重要意义。

图3 氢氧化钠添加量对藻液pH的影响Fig. 3 Effect of NaOH dosage on the pH of algae culture media
2.2 氢氧化钠对小球藻的絮凝沉降效果
絮凝沉降法和溶气气浮法采收微藻细胞的前处理过程相似, 均需要在体系中形成一定数目和大小的絮粒体。通过絮凝沉降实验, 可以考察氢氧化钠对小球藻的絮凝效果, 确定氢氧化钠添加量的适宜范围。
2.2.1 沉降时间对沉降效果的影响
絮凝沉降法中絮粒体依靠重力作用自然沉降,反应速度较为缓慢, 为了确定最佳的反应时间, 实验首先考察了在氢氧化钠添加量为900 mg/L时, 小球藻絮凝沉降过程中上清液 OD540值和絮凝层体积随时间的变化。由图4可见, 在最初的10 min内, 随着时间的延长, 两种培养时期上清液A540值均有所降低, 超过10 min之后, 随着时间的延长, 两种培养时期上清液A540值变化幅度很小, 这可能是因为在最初的慢速搅拌过程中, 体系中的小球藻细胞相互吸附, 聚团, 之后大絮粒会迅速通过重力作用沉降,极少量的小絮粒存在于上清液中缓慢沉降, 所以使得沉降初期上清液的A540值稍高于沉降后期, 而上清液中残留的藻细胞则无法通过重力作用沉降到体系底部, 因此沉降后期上清液A540值趋于平稳。
图 5中两种培养时期的小球藻絮凝层体积随着沉降时间的延长均不断减少, 但是在最初的 30 min变化最为明显, 之后就趋于稳定, 由此可见, 对于添加氢氧化钠絮凝沉降采收小球藻来说, 沉降 30 min絮凝层体积即可达到稳定, 这与图 4中上清液A540稳定时间不相一致, 原因可能是在沉降 10 min时,虽然絮粒基本上都沉降到了体系底部, 上清液浓度不再发生明显变化, 但是此时的絮粒结构疏松, 絮凝层中存在大量水分, 随着时间的延长, 絮粒会在重力的作用下进一步结合, 析出水分, 絮凝层体积得以减少, 浓缩倍数随之增大, 综合考虑上清液A540和絮凝层体积, 本实验确定的沉降时间为30 min。

图4 沉降过程上清液光密度的变化Fig. 4 Effect of sedimentation time on concentration

图5 沉降过程絮凝层体积的变化Fig. 5 Effect of sedimentation time on the volume of precipitate
2.2.2 氢氧化钠添加量对小球藻采收效果的影响
为了确定氢氧化钠的适宜添加量, 实验考察了两种培养时期的小球藻细胞采收效果随氢氧化钠添加量的变化趋势, 结果如图6、图7所示, 氢氧化钠添加量为 700mg/L时即可达到 90%以上的采收率,当添加量增大到 900mg/L时, 指数生长期小球藻液的采收率能达到 99%, 稳定期小球藻液的采收率能达到 97.17%, 这说明在培养液中添加氢氧化钠能够起到很好的絮凝效果。
通过图6、图7比较发现, 随着氢氧化钠添加量的增多, 采收率呈增大趋势, 而浓缩倍数则逐渐降低, 这可能是因为在较高的氢氧化钠添加量下, 小球藻细胞形成絮粒的几率较大, 沉降到体系底部的藻细胞增多, 所以采收率较高; 但是大量的絮片会夹带更多的水分, 使得浓缩层体积变大, 浓缩倍数变小。
从图6和图7中还可以看出, 在相同的氢氧化钠添加量下, 指数生长期小球藻液的采收率要略高于稳定期, 浓缩倍数则相差不大。这说明对于絮凝沉降法采收小球藻细胞来说, 生长时期对采收效果的影响不大, 因为沉降作用仅需要絮粒比重高于水体,在重力作用下能沉降到体系底部, 而对絮粒的表面特性, 合适尺寸范围要求较宽, 所以两种培养时期能够取得相近的采收效果。

图6 氢氧化钠添加量对絮凝沉降的絮凝率的影响Fig. 6 Effect of NaOH dosage on the percentage recovery
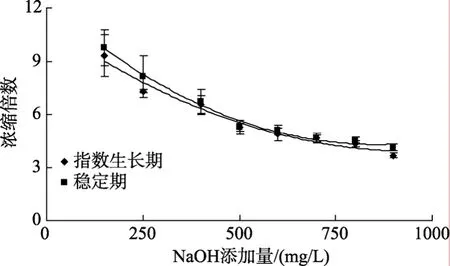
图7 氢氧化钠添加量对絮凝沉降的浓缩倍数的影响Fig. 7 Effect of NaOH dosage on the enrichment coefficient by precipitation
2.3 溶气气浮操作参数对小球藻采收效果的影响
溶气气浮法采收小球藻的效果主要取决于絮凝效果和气浮操作参数。本文在不同絮凝效果下进行了实验, 同时也考察了溶气水流速和溶气水/藻液体积比对气浮采收效果的影响, 确定了最佳操作条件。
2.3.1 氢氧化钠添加量对气浮效果的影响
图8、图9为不同氢氧化钠添加量下小球藻细胞的气浮采收效果, 由图8可见, 随着氢氧化钠添加量的增大, 两种培养时期的小球藻细胞采收率均呈增大趋势, 但是相同氢氧化钠添加量下指数生长期采收率要明显高于稳定期, 这可能是因为稳定期小球藻细胞分泌的胞外有机物质会影响细胞表面的化学性质, 阻碍絮粒形成[13,14]。氢氧化钠添加量为 350 mg/L时, 指数生长期小球藻细胞采收率能达到88.27%; 氢氧化钠添加量为600 mg/L时, 稳定期小球藻细胞采收率能达到 91.63%, 两者均明显高于同等氢氧化钠添加量下的絮凝沉降效果。这说明同等氢氧化钠添加量下, 溶气气浮法比絮凝沉降法采收效果好, 原因可能是溶气水进入采收塔后, 微小气泡与絮粒充分作用, 无法沉降的小絮粒在微小气泡的作用下相互结合形成絮团, 上浮至体系顶部, 使得溶气气浮法所需的氢氧化钠量远远低于絮凝沉降法。图9中在低氢氧化钠添加量下, 指数生长期的小球藻的浓缩倍数高于稳定期的浓缩倍数, 但是当氢氧化钠添加量超过200 mg/L后, 两种培养时期的浓缩倍数相差不显著, 均能达到 10倍以上, 高于絮凝沉降法的 4倍浓缩倍数, 这可能是因为在微小气泡的作用下, 溶气气浮法的浓缩层结合更紧致, 细胞间隙含水量少。

图8 氢氧化钠添加量对气浮采收率的影响Fig. 8 Effect of NaOH dosage on the percentage recovery

图9 氢氧化钠添加量对气浮采收的浓缩倍数的影响Fig. 9 Effect of NaOH doses on the enrichment coefficient of floatation
2.3.2 溶气水进水流速对气浮效果的影响
气浮过程的一个关键因素是微细气泡的产生,气浮效果的好坏与能否生成合适的微细气泡密切相关。同时为了增加絮粒与气泡碰撞的机会, 形成利于气泡和絮粒黏附的条件, 引入的溶气水流速必须符合气浮的需要。引入的溶气水流速过快, 动能增加,很容易使藻液产生循环流, 从而使泡絮结合体受到液体流动的扰动而因惯性作用改变方向, 停止上浮,甚至下沉(泡絮结合体因流体动压而压缩使密度增大,或扰动剪切致使气泡破裂而解体)[15]。为确定合适的溶气水流速, 本实验考察了溶气水进水流速分别为15、30、45、60、75、90 L/h下的气浮效果, 实验结果如图10所示。

图10 溶气水流速对气浮采收效果的影响Fig. 10 Effect of water flow rates on the percentage recovery and enrichment cofficient
可见, 小球藻的采收率和浓缩倍数均随着溶气水进水流速的增大先变大后减少, 这是因为在较低的溶气水流速时进水时间比较长, 气泡密度较小,即单位小球藻细胞所能捕捉到的气泡数目较少, 所以此时的R和E就比较小。随着溶气水流速的增大,气泡密度增大, 湍流程度加剧, 有利于增加释气气泡与藻絮体的碰撞, 使形成的泡絮结合体数量增多。但当达到一定流速后, 溶气水流速的进一步增大会使体系产生循环流, 反而带动泡絮结合体循环, 无法气浮, 从而降低了细胞采收率[16]。因此在本实验条件下合适的溶气水流速是60 L/h。
2.3.3 溶气水/藻液体积比对气浮效果的影响
图 11为小球藻的采收率和浓缩倍数随着溶气水-藻液体积比的变化曲线, 可以看出, 随着溶气水-藻液体积比α的增大,R和E先增大随后趋于平稳, 这是因为随着α的增大, 溶气水的体积增多, 所能释放的气泡数量增多, 泡絮结合体更多, 单位质量的细胞絮凝体可以捕获更多的气泡, 泡絮结合体密度更小, 其所受的浮力也就更大, 因而有利于更好的气浮, 采收效果更佳。但是当α超过藻细胞上浮所需的临界气泡数时, 其余气泡对藻细胞上浮的帮助就非常小, 所以本实验确定的溶气水/藻液体积比α为25%。

图11 水料比对气浮采收效果的影响Fig. 11 Effect of water/feed ratio on the percentage recovery and enrichment coefficient
3 结论
在小球藻液中添加氢氧化钠能够起到较好的絮凝作用, 絮凝效果与氢氧化钠添加量之间存在良好的对应关系, 确定最佳氢氧化钠添加量比确定最佳pH更为直观方便和准确。
达到同等采收效果, 溶气气浮法比絮凝沉降法所需的氢氧化钠添加量少, 确定的工艺条件为: 溶气气浮法中指数生长期和稳定期的最佳氢氧化钠添加量分别为350 mg/L和600 mg/L, 溶气水流速是60 L/h, 溶气水/藻液体积比α为25%。
絮凝沉降法中, 相同氢氧化钠添加量下两种培养时期的小球藻液浓缩倍数相差不大, 而指数生长期的采收率要略高于稳定期; 溶气气浮法中, 不同生长时期采收效果差异较大, 两者能够气浮的氢氧化钠添加量区间不同, 同等采收条件下, 指数生长期采收率明显高于稳定期, 其浓缩倍数也略高于稳定期。
[1] Shiro Nakano, Hideo Takekoshi, Masuo Nakano.Chlorella (Chlorella pyrenoidosa) supplementation decreases dioxin and increases immunoglobulin a concentrations in breast milk[J]. Medicinal Food, 2007,10(1): 134-142.
[2] Ewart H S, Bloch O, Girouard G S,et al. Stimulation of cytokine production in human peripheral blood mononuclear cells by an aqueous Chlorella extract[J]. Planta Med, 2007, 73(8): 762-768.
[3] 李师翁, 李虎乾.小球藻干粉的营养学与毒理学研究[J].食品科学, 1997, 18(7): 48-51.
[4] 韦进钟.小球藻的营养价值及开发利用简述[J].畜牧兽医科技信息, 2004, 8: 12-13.
[5] 张国权, 李琳.小球藻的絮凝沉降采收[J].粮油加工与食品机械, 2002, 12: 51-53.
[6] 陈峰, 姜悦.微藻生物技术[M].北京: 中国轻工业出版社, 1999.159-162.
[7] Chen J, Yeh H. Effect of ozone and permanganate on algae coagulation removal-Pilot and bench scale tests[J]. Chemosphere, 2009, 74: 840-846.
[8] Chen Y M, Liu J C, Yih-hsu Ju.Flotation removal of algae from water[J]. Colloids and Surfaces B: Biointrfaces, 1998, 12: 49-55.
[9] 郑必胜, 张国权, 蔡妙颜, 等.利用气浮法采收小球藻的生物量[J].海湖盐与化工, 1999, 28(6): 8-11.
[10] 崔景芹, 郑毅, 丛威, 等.溶气气浮法采收盐藻细胞[J].过程工程学报, 2003, 3 (20): 151-155.
[11] 曾文炉, 李浩然, 丛威, 等.微藻细胞的气浮法分离[J].海洋通报, 2002, 21(3): 55-61 .
[12] 李兴武, 李元广, 沈国敏, 等.普通小球藻异养-光自养串联培养的培养基[J].过程工程学报, 2006, 6(2):277-280.
[13] Jen-Jeng Chen, Hsuan-Hsien Yeh.The mechanisms of potassium permanganate on algae removal[J]. Water Research, 2005, 39: 4 420-4 428.
[14] Rita Henderson, Simon A. Parsons, Bruce Jefferson.The impact of algal properties and pre-oxidation on solid-liquid separation of algae[J]. Water Research,2008, 42: 1 827-1 845.
[15] Maens L., Lennart J. and Jan D. Experimental studies of the fluid dynamics in the separation zone in dissolved air flotation[J]. Water Research, 2000, 34(1):21-30.
[16] 王立新, 欧阳藩.溶气式泡载分离器内减压成泡过程[J].化工学报, 1995, 46(2): 167-173.
Received: Dec., 22, 2009
Key words:Chlorella; sodium hydroxide; sedimentation; dissolved air flotation; growth period
Abstract:Harvest of cell biomass is one of the key segments in large-scale microalgae culture. The type and dosage of coagulant, as well as the operating conditions, are key parameters for this operation. We compared sedimentation and dissolved air flotation (DAF) methods for harvestingChlorellacells by using sodium hydroxide as coagulant. We found that the recovery ofChorellacells by DAF was better than that of sedimentation with the same dosage of sodium hydroxide. The operation factors such as coagulant dosage, flow rate (V) of air dissolved water,and water-feed volume ratio (α) were also investigated. The optimal conditions were determined as exponential phase 350mg/L, stable phase 600mg/L,V 60L/h, andα25%. For either growth period, the recovery efficiency was not significantly different by sedimentation under the same conditions; however, for the DAF method, the recovery rate at the exponential phase was higher than that of stable phase.
(本文编辑:康亦兼)
Recovery of Chlorella cells by sedimentation and dissolved air flotation
GAO Li-li1, LIU Tian-zhong2, ZHANG Wei2, PENG Xiao-wei2, CHEN Xiao-lin2
(1. College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China; 2. Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China)
Q948
A
1000-3096(2010)12-0046-06
2009-12-22;
2010-04-22
国家支撑计划项目(2006BAD09A12); 中国科学院创新工程重要方向性项目(KGCX2-YW-374-4)
高莉丽(1985-), 女, 山东莱阳人, 硕士研究生, 研究方向:微藻采收技术, 电话: 80662737, Email: gll_115@163.com; 刘天中, 通信作者, 电话: 0532-80662735, Email: liutz@qibebt.ac.cn
