中国明对虾caspase基因的克隆与表达分析
2010-09-24宋光年金松君张继泉相建海
宋光年, 金松君, 张继泉, 相建海
(1. 中国科学院 海洋研究所, 山东 青岛266071; 2. 中国科学院 研究生院, 北京 100049)
中国明对虾caspase基因的克隆与表达分析
宋光年1,2, 金松君1, 张继泉1, 相建海1
(1. 中国科学院 海洋研究所, 山东 青岛266071; 2. 中国科学院 研究生院, 北京 100049)
利用细胞凋亡来清除多细胞器官受损伤或有害的细胞, 为动物发育过程中保持机体平衡起到关键作用。为了研究细胞凋亡在甲壳类动物应对病毒感染后所起到的作用, 作者利用同源克隆技术获得了中国明对虾(Fenneropenaeus chinensis) caspase基因(FcCasp)的cDNA序列, 并分析了该基因在对虾受到白斑综合症病毒(white spot syndrome virus,简称WSSV)刺激后的表达变化规律。结果表明, 该基因的cDNA含有954个核苷酸, 编码317个氨基酸, 具有caspase家族典型的QACRG五肽蛋白酶活性位点(190-194氨基酸)。对注射了WSSV的中国明对虾FcCasp的表达进行分析, 在5个时间点取其肝胰脏样本, 经real-time PCR检测发现, WSSV刺激3 h后, 对虾肝胰脏中FcCasp的表达呈现显著性上调,说明FcCasp的表达与WSSV感染密切相关, 提示FcCasp基因与细胞凋亡相关。
中国明对虾(Fenneropenaeus chinensis); 基因克隆; Caspase; WSSV攻毒; 实时定量PCR分析
对虾是目前世界上大规模养殖、效益好的水产品种类之一, 在中国水产养殖业中占据举足轻重的地位, 1988~1992年, 中国养殖对虾的年产量一直保持在 20 万 t左右, 占世界对虾年总产量的 1/3, 居世界第一位[1]。由于病害频发, 特别是 1993年以来开始爆发的 WSSV病毒性疾病, 使中国养殖对虾的产量由1992年的20万t减至1993~1994年的5万~6万t, 给对虾养殖业的发展造成了巨大损失[2]。迄今,尚未找到特效的病害防治方法来对付对虾WSSV病害的危害。研究对虾对病原感染的免疫应答机制, 可以为有效地进行对虾的病害防治提供重要的理论指导。
1972年, Kerr等[3]提出细胞凋亡的概念。细胞凋亡, 又称程序性细胞死亡(programmed cell death, 简称 PCD), 是多细胞生物调控机体发育、维护内环境稳定的一个重要的生理过程[4]。细胞凋亡是由基因控制的, 其核心的分子机制首先在秀丽隐杆线虫(Caenorhabditis elegans)中得到阐明。1992年, Cerretti等[5]发现哺乳动物的白细胞介素-1β转换酶(leukin 1-converting enzyme, 简称 ICE)与其他已知的哺乳动物蛋白几乎没有同源性, 但与秀丽隐杆线虫中促进细胞凋亡的 CED-3基因有很高的同源性, 这引起了人们对这类蛋白酶在细胞凋亡的作用的广泛研究。到1996年为止, 人们已经发现了10个ICE/CED-3的同源物[6,7], 生物体利用这种机制有效地清除了衰老细胞和畸形细胞, 它们都是结构相似的半胱氨酸蛋白酶, 并能特异地切割 Asp后的肽键, 所以人们将其统一命名为 caspase[8]。2000年,Sperandio等[9]发现一种与细胞凋亡现象不同而且不受凋亡因子调控的细胞自行死亡的形式, 称为“paraptosis”。2007 年, Overholtzer等[10]发现一种通过特殊的细胞吞噬细胞导致细胞死亡的方式, 他把这种全新的细胞死亡方式称为“entosis”。
caspase家族成员有相似的氨基酸序列、结构和底物特异性。caspase的分子量大约在30~50 kd, 通常以无活性的蛋白酶原形式在细胞内进行合成和分泌。结构上, caspase可以分成 3部分, N-端前肽(prodomain)、大亚基(p20, 20kD)和小亚基(p10,10kD)。Prodomain与 caspase分子的功能密切相关,功能性caspase分子的Prodomain长度小于30个氨基酸, 而与炎症相关的caspase分子的Prodomain长度则大于100个氨基酸。长的Prodomain往往含有明显的功能域, 如 caspase募集结构域(caspase recruitment domain,简称 CARD)、死亡效应结构域(death effector domain,简称DED)、死亡诱导结构域(death inducing domain,简称 DID)等[11,12]。这些功能域参与caspase分子之间的相互作用、caspase酶原的活化和 caspase分子的亚细胞定位等[12,13], 而短的Prodomain的功能可能是抑制 caspase的活化[14]。caspase在大亚基上均含有QACXG五肽保守序列(X代表R、Q)。在各种caspase酶原间, 大小亚基的同源性较高, 而 N-端前肽的同源性较低, 这是区别caspase家族各成员的主要指标。
作者以中国明对虾为研究对象, 利用同源克隆的方法获得了中国明对虾FcCasp基因的cDNA序列,利用real time PCR研究了WSSV刺激后对虾肝胰脏中该基因表达变化规律, 初步探讨了该基因与对虾免疫的关系, 为深入系统了解对虾的先天性免疫机制增添了新的认识。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
中国明对虾(体长14.5 cm± 0.6 cm)购于青岛市南山市场, 实验前在水族箱中充气暂养 10 d, 使其适应实验室内养殖环境。取健康对虾肝胰脏, 并分离胃、肠、神经节、淋巴器官、腮等组织, 提取总RNA用于cDNA合成。
1.1.2 实验所用引物

其中, 括号中的R代表(A、G), Y代表(T、C), D代表(G、A、T), K代表(G、T), S代表(C、G)。
1.2 WSSV感染实验
WSSV组织提取液的制备方法如下: 将于−80℃保存的感染WSSV的中国明对虾组织10 g(中国水产科学院黄海水产研究所黄 教授惠赠), 按 1∶1(W/W)比例加入含 2.4%氯化钠的 PBS, 在冰浴中匀浆10 s, 匀浆液在3 800 g, 4 ℃离心15 min, 沉淀加入同体积的PBS, 按上述方法匀浆和离心两次, 3次所得上清合并, 加入蔗糖至 30%浓度; 于 31 000g,4 ℃离心50 min, 弃上清, 沉淀用25 mL生理盐水悬浮, 备用。
选取健康对虾若干尾, 采用腹节注射法进行WSSV感染实验。用WSSV悬液从对虾最后腹节进行注射, 每只虾注射20 μL。感染实验的对照组, 每尾对虾注射20 μL无菌PBS 溶液。免疫注射后0、3、5、12、24、48、72 h 分别取虾8尾, 解剖取其肝胰脏组织, 用于总RNA 的提取。
用注射器从对虾第一腹节基部腹窦处取血淋巴,加入等体积的抗凝剂。8尾对虾的血淋巴混在一起,4ºC, 800 g离心10 min, 收集的血细胞用于总RNA的提取。同时, 解剖未处理对虾的各组织, 液氮中冻存, 用于后期的RNA提取。
1.3 RNA的提取和cDNA合成
利用Unizol试剂盒(上海博星公司)提取总RNA,方法参照使用说明书。用紫外分光光度计对RNA进行定量检测, 然后进行 MOPS琼脂糖凝胶电泳, 确认RNA无降解后, −80℃保存备用。在进行反转录之前, 使用 RQ1 RNase-Free DNase(Promega, USA)去除总RNA中残留的基因组DNA。cDNA合成体系如下: 在 25 μL的反应体系中加入 2 μg总 RNA,1×MMLV 缓冲液, 0.5 mmol/L dNTP, 0.4 mmol/L oligo-dT(或六聚体随机引物), 20 units RNase抑制剂(Promega)和 200 units MMLV 反转录酶(Promega),用于特异性基因片段克隆的cDNA, 用oligo-dT进行反转录; 用于基因表达定量分析的cDNA, 用随机引物六聚体进行反转录。
1.4 caspase基因cDNA(FcCasp)片段的克隆
根据NCBI上已经公布的部分caspase的氨基酸序列: 家蚕(Bombyx mori) (BAF74126)、疟蚊(Anopheles gambiae) (XP_308993)、墨吉明对虾(Fenneropenaeus merguiensis) (AY839873.1)、凡纳滨对虾(Litopenaeus vannamei) (EU421939.1)、日本囊对虾(Marsupenaeus japonicus) (EF079670.1)和斑节对虾(Penaeus monodon) (DQ846887.1), 设计简并引物CAS3-dF和 CAS3-dR, 以中国明对虾血细胞 cDNA为模板, 扩增中国明对虾caspase基因片段。PCR反应条件为94℃变性4 min; 94℃变性30 s, 62℃退火30 s, 72℃延伸1.5 min, 共35个循环; 72℃延伸10 min。扩增片段克隆到pMD19-T载体(大连宝生物公司)中, 重组质粒转化到大肠杆菌 TOP10菌株, 挑取克隆经PCR验证后进行测序。
1.5 生物信息学分析
将测序获得的序列利用 http://www.ncbi.nlm.nih.gov网站上的 BLAST工具进行数据库基因序列相似性及同源性的查找和比较。全长序列ORF分析等用 Bioedit软件进行。选取部分在 GenBank中与FcCasp相似的其他物种的caspase序列, 采用Clustal W软件进行多序列比对分析。将根据cDNA 序列推导的氨基酸序列利用 http://www.expasy.ch网站提供的蛋白质组和序列分析工具(Proteomics and sequence analysis tools)进行分析; 用 ProtParam 软件进行蛋白质基本物理化学参数分析。
1.6 FcCasp的表达分析
利用 real-time PCR检测中国明对虾肝胰脏中FcCasp在注射WSSV不同时间后转录水平的表达变化。取实验组和对照组不同时间点取样保存的肝胰脏样品, 按前述方法分别提取总 RNA并反转录成cDNA后用于定量 PCR检测。利用 RT-CASF/RTCASR进行转录表达检测。扩增片段大小为 129bp,同时利用中国明对虾 18S rRNA作为参考基因, 以18S-F/18S-R为引物对扩增产生136bp的PCR产物。real-time PCR 反应在 Eppendorf 公司 Mastercycler ep realplex 4S PCR 仪上进行, 采用Blend Taq-Plus-PCR 反应体系(TOYOBO), 所用染料为 SYBR Green。每个时间点的cDNA样品做两组PCR, 一组为内标基因 18S rRNA, 另一组为目的基因 FcCasp,每组反应进行3次重复。18S rRNA 基因的反应条件为: 94 ℃变性2 min, 1个循环; 94 ℃变性15 s, 55℃退火20 s, 72 ℃延伸20 s, 40个循环。FcCasp基因的反应条件为: 94 ℃变性2 min, 1 个循环; 94 ℃变性15 s, 59.1 ℃退火20s, 72 ℃延伸20 s, 40个循环。数据处理采用2-∆∆Ct 方法[15]。
2 结果
2.1 中国明对虾FcCasp的部分cDNA片段的克隆
通过PCR扩增获得了954bp的cDNA片段, 经过NCBI数据库BlastX比对(图1), 发现它与caspase家族基因具有很高的同源性, 该cDNA编码317个氨基酸。FcCasp蛋白的预测分子量为35592.8Da, 理论等电点为5.37。通过功能域分析发现FcCasp推导的氨基酸序列中含有1个caspase家族典型的QACRG五肽保守序列(定位在190-194位氨基酸)。P20大亚基定位在 67-196位氨基酸, P10小亚基定位在218-317位氨基酸。
2.2 FcCasp的组织分布
采用real-time PCR方法分析FcCasp在其不同组织中的表达情况(图 2)。从图 2中可以看出 FcCasp在各组织中均有表达, 其中在鳃、胃和肠等组织中表达量较低; 在血细胞、淋巴器官和肝胰脏等组织中表达量较高; 在血细胞中表达水平最高。
2.3 中国明对虾 FcCasp与已报道的其他物种caspase的比较
作者比对了来自不同物种的 26个caspase的氨基酸序列, 利用 MEGA4.1软件对这些 caspase进行了分子系统学分析, 在构建系统发生树的基础上研究了中国明对虾 FcCasp的分类归属以及 FcCasp和其他物种caspase之间的进化关系, 结果如图3所示。由图3可见, 系统进化树分叉为两个分支: 脊椎动物(人)的caspase与无脊椎动物(包括昆虫、海洋无脊椎动物)分别属于两个不同的类群, 这就体现了不同物种caspase的进化差异。所有关于人、鼠、非洲爪蟾(Xenopes laevis)和斑马鱼(Danio rerio)的caspase都聚在进化树的一分支。而中国明对虾的FcCasp则与疟蚊(Anopheles gambiae)、果蝇(Drosophila Virilis)、凡纳滨对虾, 以及其他“昆虫型(insect-type)”的 caspase共同聚类于进化树的另一分支, 这个分支上的蛋白全都由无脊椎动物的caspase组成。
2.4 注射 WSSV后 FcCasp在中国明对虾肝胰脏中的转录表达
WSSV感染后, 中国明对虾肝胰脏中FcCasp的表达变化如图4所示。在注射后12 h, 对虾肝胰脏中FcCasp明显上调表达, 并达到表达的最高值。而在注射后 48 h, 肝胰脏中 FcCasp的表达有明显下降,并低于0 h的表达量; 在注射后72 h, FcCasp的表达大致恢复到注射前的水平。
3 讨论

图1 中国明对虾FcCasp核苷酸和推导的氨基酸序列Fig. 1 cDNA and deduced amino acid sequences of FcCasp ofFenneropenaeus chinensis
有关caspase的基因克隆、表达已经在许多物种中得到研究。推测的蛋白质包含一个典型的保守蛋白酶活性结构域, 存在于大多数的caspase中。通常caspase以非活性状态存在, 由两个连续的蛋白水解激活, 首先位于caspase前体的N-端前肽和大亚基之间的特定位点被水解去除 N-端前肽, 然后在大小亚基之间切割释放大小亚基, 由大亚基和小亚基组成异源二聚体, 再由两个二聚体形成有活性的四聚体[16,17]。这些短的N-端前肽可能与哺乳动物的caspase-3和7相似, 起到效应 caspase的作用[18,19]。在本研究中,克隆得到的caspase cDNA的ORF、蛋白的推导分子量、典型蛋白酶切活性结构域、推导切割位点以及N-端前肽都与先前的已报道的研究相似[20]。这个结果清晰地表明本研究分离得到的caspase与其他甲壳类动物的caspase具有高度相似性。
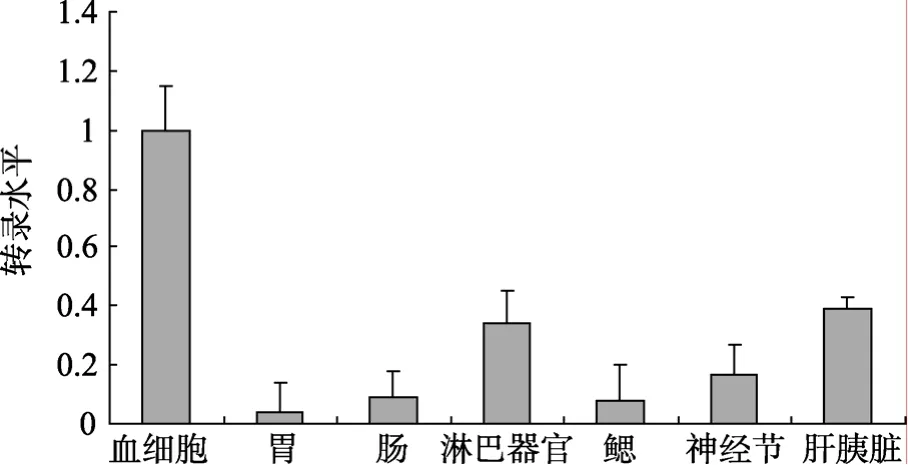
图2 FcCasp在中国明对虾中的组织分布Fig. 2 Tissue distributions of FcCasp inFenneropenaeus chinensis

图3 中国明对虾的FcCasp和其他物种caspase构建的系统进化树◆表示本研究中的物种Fig. 3 Phylogenetic analysis on the amino acid sequence of FcCasp and caspase family members of other species◆denotes the species in this study
多细胞器官广泛利用细胞凋亡来清除受损伤或有害的细胞, 为动物发育过程中保持机体平衡起到关键作用[21]。在脊椎动物中, 胸腺中的细胞凋亡是淋巴细胞死亡的主要机制。本研究通过使用 real-time PCR的方法, 发现FcCasp基因广泛分布在对虾组织中, 包括血细胞、肝胰脏、腮、淋巴器官、神经节等,但没有发现该基因在心脏中存在。
caspase蛋白酶家族在细胞凋亡过程中有重要作用, 它们接受外界信号, 使细胞发生细胞凋亡, 它们还是细胞凋亡过程中的具体执行者, 完成对特定蛋白底物的水解, 从而使细胞显示出一系列细胞凋亡的特征。作者利用real-time PCR分析研究的结果表明, 对虾肝胰脏FcCasp基因在WSSV[22]感染后出现明显的上调表达。FcCasp基因的表达与病毒刺激有相关性, 说明该基因可能参与了对虾抗病毒免疫过程, 推测该基因可能会通过细胞凋亡清除体内被病毒感染的细胞, 从而清除体内的病毒, 进而起到抗病毒的作用。目前已报道的有 4种对虾 caspase: 凡纳滨对虾、日本囊对虾[23]、斑节对虾[24]、墨吉明对虾[25], 但对对虾的 caspase具体功能目前尚不完全清楚, 还正在进一步研究之中。迄今, 对虾相关基因的研究还处于一个起步的阶段, 主要由于还没有一套成熟的系统可用于研究对虾基因的功能。相比哺乳动物而言, 由于没有对虾细胞系, 进行其基因功能研究, 显得十分困难。在接下来的工作中, 通过获得的FcCasp cDNA序列, 将采用RNAi技术用于对虾基因功能的研究。FcCasp基因特异的dsRNA推测可能特异地抑制该基因的转录表达, 由此来进一步研究该基因的作用, 为对虾免疫病害防治提供指导。
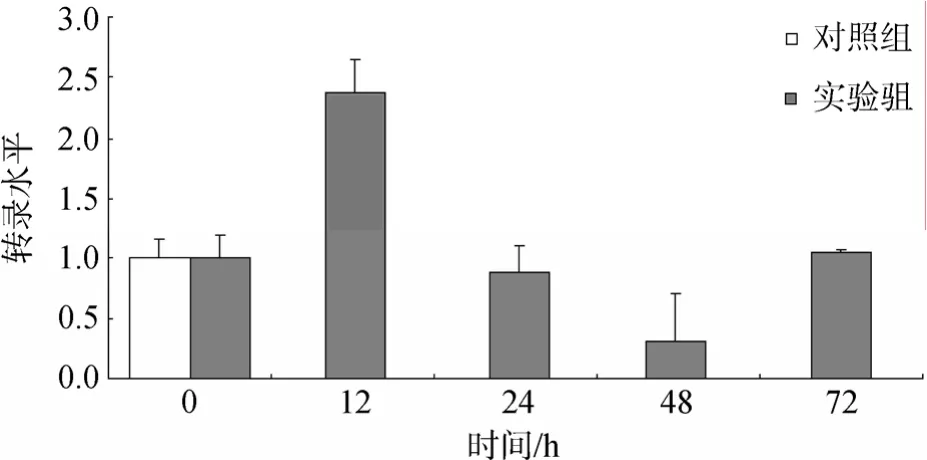
图4 对虾肝胰脏FcCasp基因在WSSV刺激后不同时间转录水平的变化Fig. 4 Profile of FcCasp expression in the hepatopancreas of shrimps challenged with WSSV
[1] 刘瑞玉, 胡超群, 曹登宫. 我国对虾养殖的现状、研究进展与存在的若干问题. 第四届世界华人虾类养殖研讨会论文集[C]. 青岛: 海洋出版社, 2004. 1-15.
[2] 相建海. 海水养殖生物病害发生与控制[M]. 北京:海洋出版社, 2001. 1-200.
[3] Kerr J F, Wyllie A H, Currie A R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics[J]. British Journal of Cancer, 1972,26: 239-257.
[4] Jacobson M D, Weil M, Raff M C. Programmed cell death in animal development[J]. Cell, 1997, 88(3):347-354.
[5] Cerretti D P, Kozlosky C J, Mosley B,et al. Molecular-cloning of the interleukin-1-Beta converting znzyme[J]. Science, 1992, 256: 97-100.
[6] Alnemri E S, Livingston D J, Nicholson D W,et al.Human ICE/CED-3 protease nomenclature[J]. Cell,1996, 87(2): 171.
[7] Nicholson D W, Ali A, Thornberry N A,et al. Identification and inhibition of the Ice/Ced-3 protease necessary for mammalian apoptosis[J]. Nature, 1995, 376:37-43.
[8] 李小明, 宋天保. “杀手”蛋白酶caspase[J]. 细胞生物学杂志, 2000, 22: 58-63.
[9] Sperandio S, Bredesen D E. An alternative, nonapoptotic form of programmed cell death[J]. Proceedings of the National Academy of Sciences, 2000, 97(26):14 376-14 381.
[10] Overholtzer M, Mailleux A A, Mouneimne G,et al. A nonapoptotic cell death process,entosis, that occurs by cell-in-cell invasion[J]. Cell, 2007, 131: 966-979.
[11] Hu S, Yang X. dFADD, a novel death domain-containing adapter protein for the Drosophila caspase DREDD[J]. Journal of Biological Chemistry,2000, 275(40): 30 761-30 764.
[12] Boldin M P, Varfolomeev E E, Pancer Z,et al. A novel protein that interacts with the death domain of Fas/Apol contains a sequence motif related to the death domain[J]. Journal of Biological Chemistry, 1995,270(14): 7 795-7 798.
[13] Fernandes-Alnemri T, Armstrong R C, Krebs J,et al. In vitro activation of CPP32 and Mch3 by Mch4, a novel human apoptotic cysteine protease containing two FADD-like domain[J]. Proceedings of the National Academy of Sciences, 1996, 93: 7 464-7 469.
[14] Meergans T, Hildebrandt A K, Horak D,et al. The short prodomain influences caspase3 activation in HeLa cells[J]. Journal of Biological Chemistry, 2000, 349:135-140.
[15] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(T)(-Delta Delta C) method[J]. Methods, 2001,25(4): 402-408.
[16] Cohen G M. Caspases: the executioners of apoptosis[J].Journal of Biological Chemistry, 1997, 326: 1-16.
[17] Wolf B B, Green D R. Suicidal tendencies: Apoptotic cell death by caspase family proteinases[J]. Journal of Biological Chemistry, 1999, 274(29): 20 049-20 052.
[18] Song Z W, McCall K, Steller H. DCP-1, aDrosophilacell death protease essential for development[J]. Science, 1997, 275: 536-540.
[19] Fraser A G, Evan G I. Identification of aDrosophilamelanogasterICE/CED-3-related protease, drICE[J].The EMBO Journal, 1997, 16(10): 2 805-2 813.
[20] Rijiravanich A, Browdy C L, Withyachumnarnkul B.Knocking down caspase-3 by RNAi reduces mortality in Pacific white shrimpPenaeus(Litopenaeus)vannameichallenged with a low dose of white-spot syndrome virus[J]. Fish & Shellfish Immunology, 2008,24(3): 308-313.
[21] Weinrauch Y, Zychlinsky A. The induction of apoptosis by bacterial pathogens[J]. Annual Review of Microbiology, 1999, 53: 155-187.
[22] Chang C C, Yeh M S, Lin H K,et al. The effect ofVibrio alginolyticusinfection on caspase-3 expression and activity in white shrimpLitopenaeus vannamei[J].Fish & Shellfish Immunology, 2008, 25(5): 672-678.
[23] Wang L, Zhi B, Wu W,et al. Requirement for shrimp caspase in apoptosis against virus infection[J]. Development and Comparative Immunology, 2008, 6:706-715.
[24] Leu J H, Kuo Y C, Kou G H,et al. Molecular cloning and characterization of an inhibitor of apoptosis protein(IAP) from the tiger shrimp,Penaeus monodon[J]. Development and Comparative Immunology, 2008,32(2): 121-133.
[25] Phongdara A, Wanna W, Chotigeat W. Molecular cloning and expression of caspase from white shrimpPenaeus merguiensis[J]. Aquaculture, 2006, 252 (2-4):114-120.
Received: Apr., 1, 2010
Key words:Fenneropenaeus chinensis; caspase gene cloning; WSSV challenge; real-time PCR
Abstract:Apoptosis eliminates unwanted cells, from an organism including damaged and virus-infected cells, being a fundamental cellular process that plays a critical role in normal development and tissue homeostasis. Here we studied a caspase homolog from Chinese shrimpFenneropenaeus chinensis,designated FcCasp. An open reading frame of 954 nucleotides encoding 317 amino acids (aa) contained a conserved motif, QACRG, of known caspases-3, and was located at aa 190–194. FcCasp expressions were measured in normal shrimp and in shrimp infected by white spot syndrome virus (WSSV) at five time-points post-injection (p.i.) with real-time PCR, revealng different expression profiles of FcCasp gene in hepatopancreas of shrimps after they were challenged by WSSV.The transcription of FcCasp in hepatopancreas showed up-regulation 12 h post-challenge, indicating the expression of FcCasp was closely related to WSSV challenge. Therefore, FcCasp might be involved in the apoptosis.
(本文编辑:谭雪静)
Cloning and expression of a caspase gene in Chinese shrimp Fenneropenaeus chinensis
SONG Guang-nian1,2, JIN Song-jun1, ZHANG Ji-quan1, XIANG Jian-hai1
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Graduate University, Chinese Academy of Sciences, Beijing 100049, China)
Q789
A
1000-3096(2010)12-0001-07
2010-04-01;
2010-10-10
国家 973资助项目(2006CB101804); 国家 863计划项目(2006AA10A401); 国家自然基金项目(30970422)
宋光年(1984-), 男, 山东省青岛人, 硕士研究生, 主要从事海洋生物分子生物学研究, 电话: 0532-82898570, E-mail: songpeter@163.com; 相建海, 通信作者, E-mail: jhxiang@qdio.ac.cn
