错配修复基因hMSH2IVS12-6T>C多态性与胃癌危险性的研究
2010-09-23肖献秋张国强周凤英龚伟达
陆 波, 肖献秋, 洪 岩, 高 兴, 张国强, 周凤英, 董 晓, 龚伟达
胃癌是全世界第4大常见肿瘤和第2位常见肿瘤死因,2002年新发胃癌病例达934 000,每年死亡人数达700 000[1]。大约2/3病例发生在发展中国家,其中中国占42%[1]。在我国,胃癌的发病率和死亡率均居恶性肿瘤之首,每年死于胃癌的患者多达 16 万人[2]。
胃癌的发生发展与其他许多恶性肿瘤一样,也是多基因、多因素参与的多步骤、多阶段的复杂过程。近年来研究表明,DNA损伤的碱基错配修复(mismatch repair,MMR)通路基因的突变也参与了肿瘤的发病机制,并且可能是肿瘤发生的早期分子事件。MMR通路中最常发生突变的基因是hMSH2和hMLH1。hMSH2基因IVS12-6T>C多态性位点位于第13外显子内含子剪接受体位点的上游第6位核苷酸。内含子位点的多态性可能影响RNA剪接,从而改变该基因蛋白的表达,导致携带不同该基因型的个体对疾病易感性的差异。研究报道[3-4],hMSH2IVS12-6T>C多态与许多肿瘤的发生有关,如肺癌、霍奇金淋巴瘤等,但尚未见该位点与胃癌遗传易感性的关联性研究报道。我们推测,hMSH2基因多态变异可能与胃癌遗传易感性存在关联。基于此,本研究采用TaqMan MGB探针对hMSH2基因IVS12-6T>C多态进行基因分型,以探讨其与胃癌发生风险的关系,该研究将对进一步揭示胃癌的遗传学机制具有重要的意义,也为今后实施胃癌的个体预防和治疗提供一定依据。
1 资料和方法
1.1 一般资料
随机收集自2006年3月至2010年2月宜兴市人民医院住院并经病理确诊的胃癌患者以及住院的非胃癌患者。病例组552例,其中男性377例,女性175例,平均年龄63.0岁( ±9.9岁);对照组592例(年龄、性别均相匹配),其中男性391例,女性201例,平均年龄63.4岁(±10.4岁)。中位年龄均为63.0岁。所有患者术前均未行化疗或放疗。病例组和对照组均完成问卷调查并愿意提供10 mL新鲜外周血,所有血样在6 h内保存于-20℃冰箱。吸烟者指每天至少1支,连续半年以上;饮酒者指每周至少1次,持续1年以上。胃癌临床病理学特征:组织学分型采用Lauren分型[5]。
1.2 实验方法
1.2.1 基因组DNA提取 采用酚-氯仿法提取基因组DNA,紫外分光光度计测定DNA的量,琼脂糖凝胶电泳法检测DNA的完整性。
1.2.2 基因分型 采用Taqman MGB探针方法对hMSH2基因IVS12-6T>C多态进行基因分型。分型原理:不同的等位基因对应不同的荧光,等位基因T对应FAM荧光,C对应HEX荧光,根据两种荧光的不同Ct值区分出不同的基因型(如图1所示)。对于分散的点,根据扩增曲线来判断基因型。同时抽取10%的样本采用聚合酶链反应限制性片段长度多态性(PCR-RFLP)方法进行验证,结果相一致。引物及探针均由南京骥骜生物技术有限公司设计及合成。上游引物为5'-GAA TAT ATG TTG ATT TAC CTC CCA TAT TG-3',下游引物为5'-CAA TCC ATT TAT TAG TAG CAG AAA GAA GTT-3';TaqMan探针1 为5'-FAM-CCT ACA AAA CAA ATT AP-3',探针2为5'-HEX-CCT ACA GAA CAA ATT AP-3'(其中P代表TaqMan-MGB基团)。10 μL PCR反应体系包括 ddH2O 2.8 μL,Realtime Probe qPCR Mix 5 μL,正反义引物各0.3 μL,TaqMan 探针1 及2 各0.2 μL,50 × Rox reference dye 0.2 μL,模板 DNA 1 μL。PCR反应程序包括预变性95℃ 10 min,变性95℃15 s,退火及延伸60℃ 1 min,共45个循环,仪器自动收集荧光信号,SDSV1.3.2软件分析给出基因分型结果。
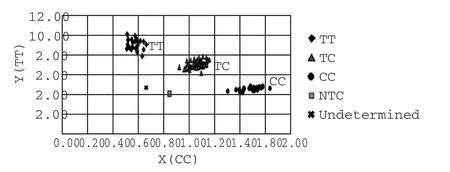
图1 等位基因分型图
1.3 统计学方法
以拟合优度 χ2检验分析hMSH2IVS12-6T>C多态各基因型在对照组中分布是否符合Hardy-Weinberg平衡定律,以确认研究样本的群体代表性。χ2检验比较研究人群年龄、性别、吸烟、饮酒等因素频数分布差异。单因素及多因素Logistic回归计算比值比(odds ratios,ORs)及其95%可信区间(confidence intervals,CIs),分析各基因型与胃癌发生风险的关联性,并对年龄、性别、吸烟及饮酒进行分层分析。采用SAS9.1统计软件(SAS Institute,Cary,NC),所有统计检验均为双侧概率检验,P<0.05为差异有统计学意义。
2 结果
2.1 研究群体的基本特征
病例组和对照组的基本信息如表1所示:病例组和对照组在性别与年龄频数分布上无统计学意义(P值分别为 0.456和 0.200)。病例组吸烟者(45.0%)和饮酒者(33.3%)高于对照组吸烟者(29.4%)和饮酒者(25.0%),差异有统计学意义,P值分别为<0.001和0.003。病例组肿瘤位于贲门211 例(41.9%),非贲门293 例(58.1%);组织学分型:弥漫型239 例(46.3%),肠型277 例(53.7%)。
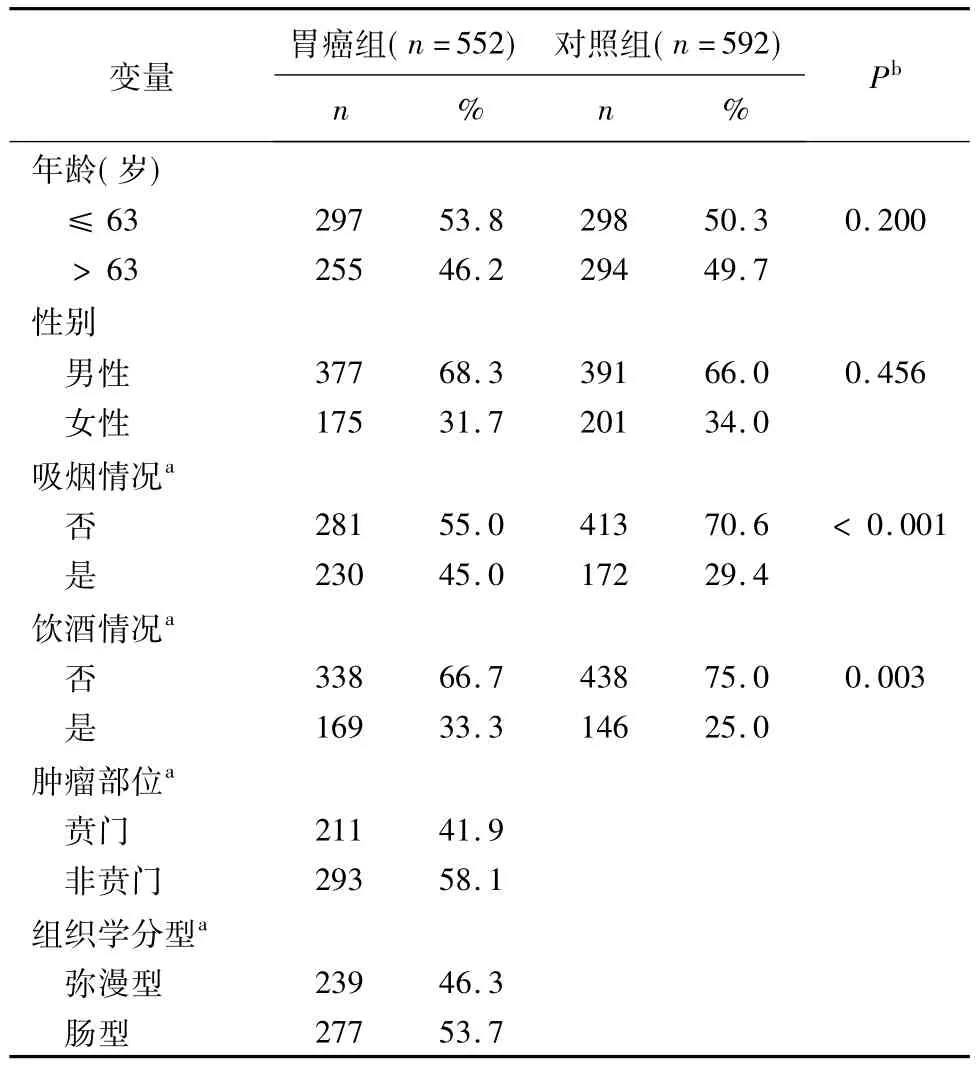
表1 胃癌组和对照组的基本信息
2.2 hMSH2IVS12-6T>C多态性和胃癌发生风险的关联性
hMSH2基因IVS12-6T>C各基因型在对照组中分布符合Hardy-Weinberg平衡定律(χ2=0.34,P=0.558)。分布频率为:TT,240 例(40.6%);TC,279 例(47.1%);CC,73(12.3%)例。在胃癌组中的分布频率为:TT,230例(41.7%);TC,258例(46.7%);CC,64 例(11.6%)。以野生基因型 TT为参照,携带突变T等位基因的基因型TC和CC在病例和对照组中频率分布差异无统计学意义(P值分别为0.882和0.569);合并突变基因型(TC+CC)与野生型TT相比与胃癌发生风险无明显关联(调整 OR=0.96,95%CI=0.75 ~ 1.23,P=0.756)。结果见表 2。
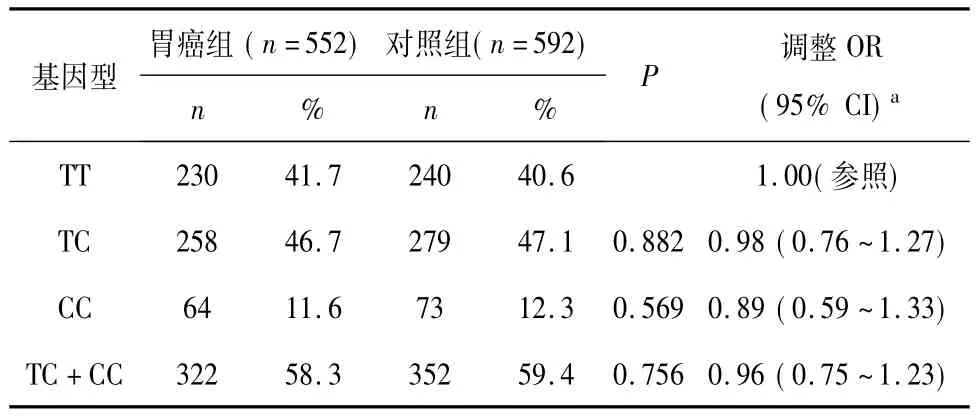
表2 hMSH2IVS12-6T>C基因型和胃癌发生风险的关联性
2.3 hMSH2IVS12-6T>C多态性和胃癌发生风险的分层分析
我们对年龄、性别、吸烟、饮酒等因素进行分层分析,发现hMSH2IVS12-6T>C合并突变基因型与年轻人群(年龄≤63岁)胃癌和年老人群胃癌(年龄 >63岁)的发生风险无显著关联性(调整OR=0.99,95%CI=0.70 ~ 1.30 和调整 OR=0.93,95%CI=0.64 ~1.33),同时也发现与性别、吸烟、饮酒等因素亦无显著关联性。结果见表3。
3 讨论
DNA错配修复(mismatch repair,MMR)通路广泛存在于生物体中,是进化保守的生化通路,首先在细菌中发现,主要功能是修复DNA复制过程中产生的错配,维护基因组完整性和稳定性[6]。人类MMR通路由 7 个基因组成:MSH2、MSH6、MSH3、MLH1、PMS2、PMS1 和 MLH3[7-8]。其中 hMSH2 基因是第一个被分离到的人类错配修复基因,于1993年Fishel等克隆。该基因与细菌MutS同源,位于人类染色体2p21-22,其基因组全长约73Kb(不包括启动子),含16个外显子,其中第7个外显子最长,有279bp,而第11个外显子最短为98bp,cDNA全长3 111bp,含2 727bp的开放阅读框架,编码蛋白含934个氨基酸残基[9]。hMSH2通过与hMSH6或hMSH3蛋白结合形成异源二聚体,可以识别并结合到错配的DNA序列,从而在错配修复中发挥作用。
hMSH2IVS12-6T>C多态与许多肿瘤的发生风险有关,Palicio等[10]对西班牙人群进行病例-对照研究,发现IVS12-6CC等位基因可使结直肠癌的发生危险性增高(调整 OR=2.48,95%CI=1.08~5.66)。但也有相反报道,Raptis等[11]报道该位点的多态性与加拿大人群结直肠癌的发生风险无关联性。在韩国人群,Jung等[3]的研究表明携带IVS12-6CC基因型的个体与IVS12-6TT基因型个体相比,发生肺癌的危险性增高(调整OR=1.52,95%CI=1.02 ~2.27,P=0.01)。Hishida 等[4]对 103 例日本非霍奇金淋巴瘤患者和487例对照者的研究中发现,IVS12-6CC基因型可增加非霍奇金淋巴瘤的发生风险(调整 OR=1.44,95%CI=0.94 ~2.23),但不具有显著性差异。
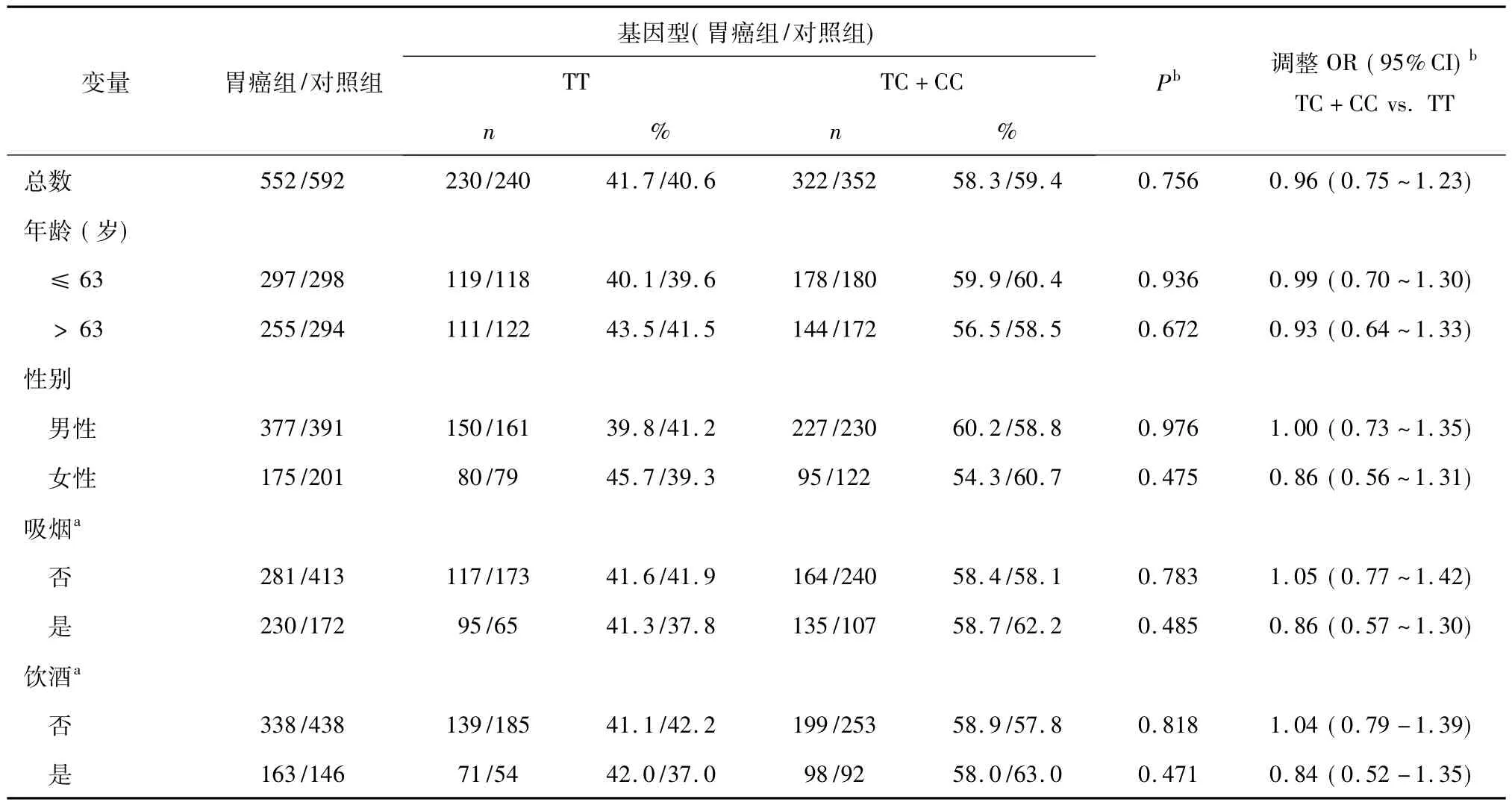
表3 hMSH2IVS12-6T>C基因型和胃癌发生风险的分层分析
我们采用TaqMan MGB探针,针对IVS12-6T>C位点进行基因分型。反应体系包括一对引物及2个分别检测不同等位基因的MGB探针,根据不同的等位基因对应不同的荧光,探针的5'端标记FAM(检测T等位基因)或HEX(检测C等位基因),3'端标记不发光的淬灭基团并连接一个MGB基团。连接MGB基团的探针可与互补的DNA形成高度稳定的双螺旋,大大增加配对与非配对模板间的Tm值差异,Johnson等[12]报道该方法错误率<1%。
本研究系病例-对照研究,对一些可能的混杂因素进行了调整,因此研究结果比较可信。但我们的研究结果未发现hMSH2基因IVS12-6T>C多态性位点与胃癌的发生风险有显著关联性,分层分析也未发现他们与研究人群的年龄、性别、吸烟、饮酒等因素有显著关联性,从表2中可以看出,CC基因型可降低胃癌的发生风险(OR<1),但不具有显著性差异(P>0.05),原因可能与种族差异或样本含量较少有关。
总之,本研究通过TaqMan MGB探针基因分型技术,对hMSH2 IVS12-6T>C多态位点进行基因分型,未发现hMSH2 IVS12-6T>C多态变异与中国江苏宜兴人群胃癌发生风险存在显著关联。本研究结果需在今后的大样本研究或其他功能学研究中进一步加以验证。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2] 周标,陈坤.胃癌主要危险因素研究进展[J].金华职业技术学院学报,2005,5(3):37-39.
[3] Jung CY,Choi JE,Park JM,et al.Polymorphisms in the hMSH2 gene and the risk of primary lung cancer[J].Cancer Epidemiol Biomarkers Prev,2006,15(4):762-768.
[4] Hishida A,Matsuo K,Hamajima N,et al.Polymorphism in the hMSH2 gene gIVS126T>C and risk of non-Hodgkin lymphoma in a Japanese population[J].Cancer Genet Cytogenet,2003,147(1):71-74.
[5] Hohenberger P,Gretschel S.Gastric cancer[J].Lancet,2003,362(9380):305-315.
[6] Koessler T,Oestergaard MZ,Song H,et al.Common variants in mismatch repair genes and risk of colorectal cancer[J].Gut,2008,57(8):1097-1101.
[7] Jascur T,Boland CR.Structure and function of the components of the human DNA mismatch repair system[J].Int J Cancer,2006,119(9):2030-2035.
[8] Jiricny J.The multifaceted mismatch-repair system[J].Nat Rev Mol Cell Biol,2006,7(5):335-346.
[9] Fishel R,Lescoe MK,Rao MR,et al.The human mutator gene homolog MSH2 and its association with hereditary nonpolyposis colon cancer[J].Cell,1993,75(5):1027-1038.
[10] Palicio M,Blanco I,Tortola S,et al.Intron splice acceptor site polymorphism in the hMSH2 gene in sporadic and familial colorectal cancer[J].Br J Cancer,2000,82(3):535-537.
[11] Raptis S,Mrkonjic M,Green RC,et al.MLH1-93G >A promoter polymorphism and the risk of microsatellite-unstable colorectal cancer[J].J Natl Cancer Inst,2007,99(6):463-474.
[12] Johnson VJ,Yucesoy B,Luster MI.Genotyping of single nucleotide polymorphisms in cytokine genes using real-time PCR allelic discrimination technology[J].Cytokine,2004,27(6):135-141.
