慢性肝病患者血中一氧化碳的测定及其临床意义
2010-09-21黄艳田江李丹
黄艳 田江 李丹 吴
目前慢性病毒性肝炎及其导致的肝硬化、肝衰竭及肝癌仍然是危害我国国民健康的常见疾患,其发病机制复杂,细机理还不完全清楚,治疗效果仍不令人满意。继一氧化氮(NO)之后,大量证据表明内源性一氧化碳(CO)也是体内广泛分布的多功能气体信号分子。与NO相似,CO也具有扩张血管和抑制血管平滑肌细胞增殖的作用。但CO不是自由基,它具有抗炎症、抗凋亡和免疫调节等细胞保护作用[1]。近来研究显示CO作为一种多效性信使分子,与肝硬化门脉高压(PH)、肝脏的炎症及应激、肝脏微循环等有着密切关系[2]。但其详细的作用机制仍不完全清楚。本研究旨在了解CO在慢性肝病中的变化,分析CO在慢性肝病发生发展中所起的作用。
1 资料与方法
1.1 病历来源 研究对象为2005年3月~12月期间在新疆医科大学一附院肝病中心住院的患者,其中55例慢性病毒性肝炎,66例肝硬化。诊断标准按照2000年西安肝病会议制定的慢性病毒性肝炎、肝硬化诊断标准。正常对照组来自肝病中心科室工作人员以及医科大学成教院学生。详细情况见表1。
1.2 排除标准
a)有吸烟史者:每日吸烟量>2支者,以及有相关职业接触史者,如炼刚工人;
b)有慢性肺部疾病,如慢支、肺心病、支气管哮喘病史;
c)有冠心病、高血压病史。
d)溶血性疾病患者。
1.3 检测方法
入选病人均于清晨8点左右抽取静脉血2ml存放于加有抗凝剂EDTA管中,具体操作步骤为:
1.3.1 取10ml具塞试管2支(一支为试剂空白管,另一支为测定管);各放入2粒玻璃珠并加满Tris液(约13~15ml,体积差异不影响测定准确度),空白管加入经Tris液2ml稀释的EDTA管液5μl,再加入40mg连二亚硫酸钠,颠倒混匀。
1.3.2 用移液器吸待检血标本5μl,放入测定管中,加连二亚硫酸钠40mg;补满Tris稀释液后盖塞(勿迸气泡),颠倒混匀,l0~l5min后比色。
1.3.3 将试剂空白管和测定管待测液分别倒入lcm比色皿中,以试剂空白液调零点,记录测定液420nm和432nm吸光度值(即A420、A432)。
1.3.4 为减少测定样品的误差,所有测定样品均在同一仪器重复测定两次以上,取均值。
1.4 饱和度计算
COHb饱和度按下列公式计算[3]:
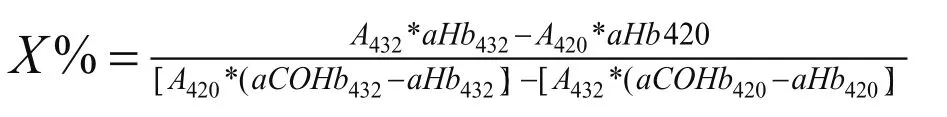
式中:
aHb420-为Hb在420nm波长的吸光度;
aHb432-为Hb在432nm波长的吸光度;
aCOHb420-为COHb在420nm波长的吸光度;
aCOHb432-为COHb在432nm波长的吸光度。
1.5 吸光系数的测定
1.6 统计处理
采用SPSS12.0软件,选用单因素方差分析、秩和检验进行统计分析a=0.05。
2 结果
2.1 慢性肝病组与对照组之间COHb水平的比较
慢性肝炎组、肝硬化组及对照组COHb水平比较结果显示差异有统计学意义,进一步经两两比较显示肝炎组、肝硬化组与对照组COHb水平差异均有统计学意义,见表2、3。
2.2 不同程度肝硬化患者COHb水平比较
入选的66例肝硬化患者按照Child-Pugh积分分为A、B、C三组,各组COHb水平采用秩和检验K-W法统计分析显示,虽然随着肝硬化损害程度加重各组的平均秩呈现出增加的趋势,但各组之间差异无统计学意义,见表4。

表1 各组临床资料比较
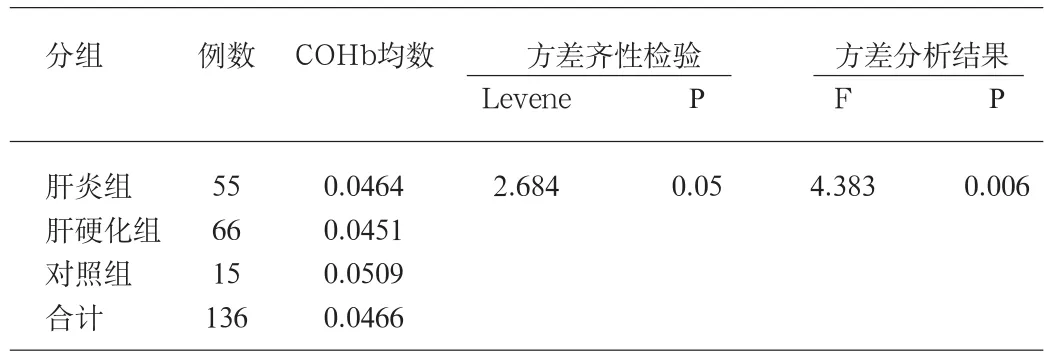
表2 三组COHb方差分析

表3 三组COHb两两比较

表4 肝硬化Child-Pugh积分A.B.C三组COHb水平比较
3 讨论
目前已证实哺乳动物体内的CO主要来源于血红素氧化酶(hemeoxygenase, HO)催化血红素氧化分解,形成等分子的胆绿素和CO。HO在体内广泛存在,已被证实几乎分布于所有的器官和组织,涉及整个生长发育过程,显示机体产生CO的部位相当广泛。HO是哺乳动物和啮齿动物组织细胞微粒体中的一种蛋白酶,它有3种异构型:HO-1、HO-2和HO-3[4]。HO-1为诱生型,HO-2和HO-3为原生型。HO-1主要分布在脾、肝、骨髓、单核-巨噬细胞系统、平滑肌,主要参与血红素的代谢,以脾脏中活性最高。HO-1可被各种诱导剂激活,如应激、饥饿、缺氧、热休克、内毒素、细胞因子(如白细胞介素-1、白细胞介素-6)、激素(胰岛素、肾上腺素、胰高血糖素等)、金属离子、氧化反应、氧自由基等等[5]。HO-1与目前所发现的任何基因相比,能对更多种类和形式的刺激产生反应。
本项结果表明,在病毒性肝炎、肝硬化等肝脏病理状态下,体内COHb水平发生变化,提示存在HO-1活性的改变。但本项结果与文献报道的结果有所不同,文献报道结果表明,在炎症等各种病理状态下释放的各种促炎细胞因子刺激HO-1的表达上调导致CO的生成增多[6]。而在本项研究中,各病例组COHb水平均低于对照组,分析出现该结果的原因有以下可能:有研究显示HO-1的表达高峰出现在炎症消退时[7],说明HO-1的表达在炎症的不同时期程度不同,而本项研究的病例组,大多在入院时病变活动期留取血标本,此时HO-1的活性有可能升高不明显,从而影响体内COHb水平。
关于HO-CO系统在氧化应激状态下提供的细胞保护作用的机制目前仍不完全清楚,现认为该作用的产生与促炎细胞因子(TNF-a,IL-1)的下调及伴有的抗炎细胞因子白细胞介素-10(IL-10)的增强有关[2]。
有证据提示HO-1的过度表达产生的保护性作用限制在一个相当有限的范围内。过高水平表达的HO-1通过释放活性铁甚至会增加细胞对氧化应激的敏感性,HO-1基因的转录激活是细胞对氧化应激反应整体中的一部分,它的诱导产生的作用似乎既不是绝对的细胞保护也不是绝对的细胞毒性[8]。
在肝硬化组按照Child-Pugh评分分A、B、C三组,三组的COHb平均秩随着肝硬化损害程度的加重呈现出上升的趋势,该现象和文献报道的研究结果相符[9],即呼出的CO和静脉COHb水平之间有密切的相互关系而且两者的水平与肝硬化Child-Pugh积分和血浆肾素活性相关。呼出的CO和静脉COHb水平在肝硬化组较对照组显著升高;且在肝硬化合并原发性细菌性腹膜炎时升高更明显。本研究A、B、C三组之间未显示出统计学差异考虑和样本例数不足有关,有待于扩大样本例数后进一步观察分析。已有的关于肝硬化的动物实验研究显示,肝硬化门静脉高压时,肝脏库弗细胞及肝实质细胞的HO-1被激活,过度表达导致CO产生增多,而在特发性门静脉高压,HO-1在库弗细胞的表达显示明显减少,提示在肝硬化门静脉高压时,局部血液动力循环的改变影响库弗细胞HO-1的表达[10]。另有报道显示严重肝硬化门静脉高压的患者,肝脏HO-1的活性有明显升高,HO-1通过产生CO参与门静脉高压的病理机制的调节[11]。
CO作为气体信号分子家系中的一员,由于其独特的作用方式和在体内的广泛分布,它在生物体内多个系统生理及病理状态下发挥的多方面的生物学效应日益受到关注。而肝脏作为机体内的重要代谢器官之一,CO在肝脏中的生理及病理作用也引起人们的关注。研究表明,CO在肝脏的血液循环、炎症、门静脉高压及胆汁分泌中发挥了一定作用,但是其详细的作用机制仍然不完全清楚。鉴于气体信号分子之间密切的相互调节关系,深入研究CO和其他气体信号分子之间的相互作用,采用更为先进的技术手段和更灵敏的观测指标进一步研究HO-CO系统的作用机制,对于揭示CO在慢性肝病发病机制中的作用具有重要意义。
[1]蒲丹,唐朝枢.关注生物活性小分子物质的研究[J].国外医学.生理,病理科学与临床分册,2004,24(5):397-398.
[2]Otterbein LE,Bach FH,Alam J,et al:Carbon monoxide has antiinflammatoryeffects involving the mitogen-activated protein kinase pathway[J].Nat Med,2000,6:422-428.
[3]乐宏元,宋小兴.一氧化碳血红蛋白双波长定量测量[J].临床检验杂志,1996,14(2):87-88.
[4]McCoubrey WK,Huang TJ,Maines MD:Isolation and characterization of a cDNAfrom the rat brain that encodes hemoprotein heme oxygenase-3[J].Eur J Biochem,1997,247:725-732.
[5]Zuckerbraun,B.S.,Billiar,T.R.(2003)Heme oxygenase-1:a cellular Hercules[J].Hepatology,2003,37:742-744.
[6]Michael C.Ott,Jeffrey R,Scott,et al.Otterbein,Inhalation of carbon monoxide prevents liver injury andinflammation following hind limb ischemia/reperfusionThe FASEB Journal express article10.1096/fj.04-2514fje.Published online October,28,2004.
[7]Ana Maria Vicente,Maria Isabel,Guillen,et al.Beneficial effects of heme oxygenase-1 up-regulation in the development of experimental inflammation induced by zymosan[J].The Journal of Pharmacology and Experimental Therapeutics,2003,307:1030-1037.
[8]Bauer M,Bauer I.Heme oxygenase-1:redox regulation and role in the hepatic response to oxidative stress[J].Antioxid Redox Signal,2002 Oct,4(5):749-58.
[9]De Las Heras D,Fernandez J,Gines P,Cardenas A,Ortega R,Navasa M,et al.Increased carbon monoxide production in patients with cirrhosis with and without spontaneous bacterial peritonitis 1[J].Hepatology,2003,38:452-459.
[10]Nobuya Makino 1,Makoto Suematsu 1,Altered expression of heme oxygenase-1 in the livers of patients with portal hypertensive diseases[J].J hepatology,2003,33:32-42.
[11]Erario Ma,Gonzales S.et al.Role of heme oxygenase/carbon monoxide pathway on the vascular response to noradrenaline in portal hypertensive rats[J].J Clin Exp Pharmacol Physiol.2005,32(3):196-201.