一株溶藻细菌对铜绿微囊藻生长的影响及其鉴定
2010-09-20刘兆普赵耕毛
晋 利,刘兆普,赵耕毛,汪 辉,陈 雷
(南京农业大学资源与环境科学学院,江苏省海洋生物学重点实验室,江苏 南京 210095)
一株溶藻细菌对铜绿微囊藻生长的影响及其鉴定
晋 利,刘兆普*,赵耕毛,汪 辉,陈 雷
(南京农业大学资源与环境科学学院,江苏省海洋生物学重点实验室,江苏 南京 210095)
从山东黄岛边某富营养化池塘中分离得到1株具有溶藻作用的菌株(J1),研究了其对铜绿微囊藻(Microcystis aeruginosa)的抑制效果、作用方式以及细菌培养基、菌株与铜绿微囊藻不同生长阶段等因素对溶藻效果的影响,并对该菌株进行了生理生化鉴定.结果表明,将牛肉膏蛋白胨培养基加入藻液,培养基与藻液的投放体积比为6%时,9d内对藻的生长无影响.将初始浓度为6×107cfu/mL的菌液加入藻液,共培养第9d,铜绿微囊藻的去除率达87%以上.对数期的J1细菌具有较好的溶藻效果,作用于稳定期铜绿微囊藻的实验组,藻的去除率较低.J1通过分泌溶藻物质的间接作用方式抑制铜绿微囊藻的生长,且溶藻活性物质具有一定的热稳定性.根据生理生化及16S rDNA序列分析鉴定,菌株J1属于芽胞杆菌属(Bacillus).
溶藻细菌;铜绿微囊藻;溶藻作用;16S rDNA;芽胞杆菌
Abstract:An algae-lysing bacterium strain named J1 was isolated from an eutrophic pond around Huangdao. The lytic efficiency and performing mode of bacterial lysing of Microcystis aeruginosa were studied. Influences of the bacterial culture medium and the growth phases of bacterium and algae on the antialgal effect were also studied, and then the bacterium strain was physiologically and biochemically identified. The results showed that algae growth was relatively stable with adding beef-protein medium without bacterium strain when the volume ratio of medium to algae solution was 6%. However, more than 87% of Microcystis aeruginosa had been removed by 9 days after adding the beef-protein medium with initial bacterium concentration of 6×107cfu/mL under the same volume ratio. The antialgal efficiency was different to the various growth phages of bacterium and algae. J1 in log growth phase showed the best algae-lysing performance. The removal rate of algae in stable phrase was the lowest under the treatment with J1 in log growth phase. J1 excreted algae-lysing substance to inhibit the algae growth indirectly, and this active inhibitors were heat-stable. According to the morphological and physiological-biochemical characteristics, bacterium J1 was identified as Bacillus.
Key words:algae-lysing bacterium;Microcystis aeruginosa;algae-lytic effect;16S rDNA;Bacillus
富营养化已成为众多水体普遍存在的环境问题.利用溶藻细菌作为水华和赤潮防治的生物,已经引起越来越多人的关注[1].部分研究者认为水华和赤潮的突然消亡可能与溶藻细菌的感染有关[2].Doucette等[3]曾报道在水华和赤潮的发生、发展和消亡过程中,细菌以及细菌与藻类的相互作用是影响藻类生长的关键性的调控因素.由于自然界水体中溶藻细菌比率较低[4],分离较困难,目前国内的研究也多处于起步阶段.本实验室从山东黄岛边某富营养化池塘分离出一株具有溶藻作用的菌株 J1,首先研究了细菌液体培养基自身对铜绿微囊藻的抑制效应,并在排除培养基影响的合理体积投入量范围内,进一步研究了细菌培养液对铜绿微囊藻的抑制效应,同时利用16S rDNA序列分析方法进行鉴定,为更深入地探讨藻菌关系、研究溶藻细菌提供参考.
1 材料与方法
1.1 藻种来源及其培养、计量
实验藻种为铜绿微囊藻(Microcystis aeruginosa) FACHB469,取自中国科学院水生生物研究所藻种保藏中心.藻种经活化后,采用BG11改良培养基[5],在温度为25℃,光照强度为2500lx,光暗比为12h:12h的条件下培养.通过测量叶绿素a(Chl.a)的含量及显微观察了解铜绿微囊藻的生长情况,叶绿素a的测量采用丙酮法[6].藻的去除率R定义为:R=(C0-Ce)/C0,式中:C0为对照样铜绿微囊藻叶绿素a的含量,μg/L;Ce为处理样铜绿微囊藻叶绿素a的含量,μg/L.
1.2 细菌的分离及其培养、计量
实验菌种分离自黄岛边某富营养化池塘.从该池塘中采集水样,按 10%的比例接入培养 14d的铜绿微囊藻藻液中,25℃共培养 7d.取黄化藻液按不同浓度梯度稀释,采用平板涂布和划线的方法分离细菌.细菌的培养采用牛肉膏蛋白胨培养基,置于 30℃,170r/min,摇床培养.将各菌株培养液等量加入到铜绿微囊藻藻液中,得到能够使藻液发生黄化现象的菌株 J1.细菌的计量采用稀释平板测数法[7].
1.3 细菌培养基对藻生长的影响
培养铜绿微囊藻至对数生长期,分别取不加入细菌的牛肉膏蛋白胨液体培养基 0,2,4,6,8, 10mL加入100mL处于对数期的藻液中,每组各设3个平行实验,每隔2d测1次叶绿素a的含量.
1.4 细菌投入量对溶藻效果的影响
将 J1菌株液体培养至对数生长期(107cfu/mL),分别取菌液0,2,4,6,8,10mL加入100mL处于生长对数期的藻液中,各设3个平行实验,每隔2d测1次叶绿素a的含量.
1.5 J1细菌生长阶段对铜绿微囊藻溶藻效果的影响
将J1菌株液体培养至对数期、稳定期、衰亡期,分别取处于不同生长阶段的菌液6mL加入100mL处于生长对数期的藻液中,菌株的每个生长阶段各设3个平行实验及空白对照,每隔2d测 1次叶绿素a的含量.
1.6 铜绿微囊藻的生长阶段对溶藻效果的影响
将铜绿微囊藻液体培养至适应期、对数期、稳定期,分别在处于不同生长阶段的100mL藻液中加入6mL处于生长对数期的J1菌液,藻液的每个生长阶段各设 3个平行实验及空白对照,每隔2d测1次叶绿素a的含量.
1.7 J1菌株溶解铜绿微囊藻的作用方式
培养细菌至生长对数期,分别取6mL菌体浸提液(细菌培养液经8000r/min,4℃离心10min,弃上清,重复洗涤2~3次,置于70℃,水浴20h)、菌体(细菌培养液经8000r/min,4℃离心10min,弃上清)、高热处理的菌液上清(菌液经8000r/min,4℃离心10min,取上清液在121℃下处理30min)、离心滤过的菌液上清(离心得上清液再经 0.22μm滤膜过滤)、菌液加入100mL处于生长对数期的藻液中,各设 3个平行实验及空白对照,每隔 2d测1次叶绿素a的含量.
1.8 细菌生长曲线测定
生长曲线的测定采用比浊法,具体操作参照文献[7].
1.9 细菌生理及分子鉴定
生理生化鉴定参照文献[8];16SrDNA序列分析:按Pitcher法提取细菌的基因组总DNA;以提取的 DNA 为模板,采用通用引物进行16SrDNA基因扩增,上游引物为 5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物为5′-TACCTTGTTACGACTT-3′.PCR反应体系为50μL,包括10×PCR缓冲液 5μL,dNTP(20mmol/L)4μL,引物(25pmol/μL)各2μL,Mg2+(25mmol/L)4μL,菌体DNA (约 50ng/μL)1μL,TaqDNA聚合酶(5U/μL)0.5μL,加水至50μL,反应条件:94℃变性2min;94℃1min,个循环;72℃延伸20min.PCR产物经检测纯化后,送由上海英骏生物技术有限公司完成测序工作.
2 结果
2.1 牛肉膏蛋白胨培养基对铜绿微囊藻生长的影响
牛肉膏蛋白胨培养基的不同投入量对铜绿微囊藻生长影响的情况如图1所示,与对照(投入量为0)相比,直至实验第3d,各瓶藻液叶绿素a含量基本相当.从实验第6d开始,加入8,10mL培养基的处理组叶绿素 a含量低于对照,观察加入2,4,6mL培养基的处理组, 9d后才出现这一现象.说明牛肉膏蛋白胨培养基与藻液的的投放体积比小于 6%时,短期内(9~10d)对照组与实验组无显著性差异(P>0.05),即培养基对铜绿微囊藻的生长无显著影响.
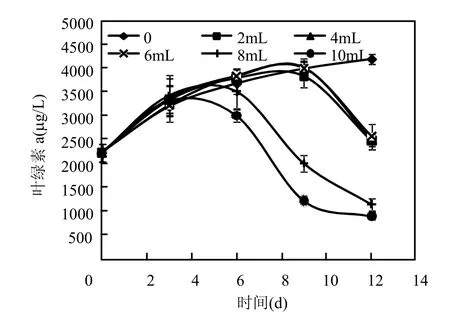
图1 细菌培养基投入量对铜绿微囊藻叶绿素a的影响Fig.1 The effects of bacterial culture medium volume on Chl.a of Microcystis aeruginosa
2.2 细菌培养液投入量对铜绿微囊藻生长的影响
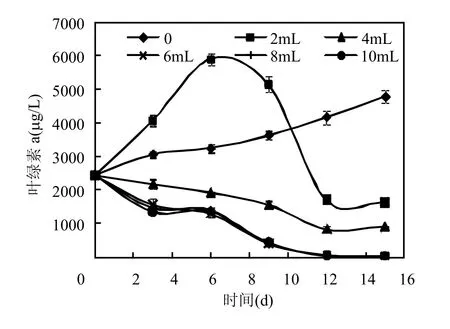
图2 细菌培养液投入量对铜绿微囊藻叶绿素a的影响Fig.2 The effects of bacterial culture liquid volume on Chl.a of Microcystis aeruginosa
由图2可见,细菌培养液投入量为 2mL时,直至实验第9d,藻液叶绿素a的含量仍高于对照,从第 10d开始,细菌培养液处理的藻液中叶绿素a的含量开始显著下降,表现出对铜绿微囊藻生长的抑制.细菌培养液投入量为4,6,8,10mL的处理组藻液中叶绿素 a的含量在整个共培养期始终低于对照,在实验第9d时,叶绿素a的含量分别为对照的63.8%、17.0%、16.6%、18.4%,实验第12d至第15d,叶绿素a的含量继续降低,特别是投入量为6,8,10mL菌液的处理组叶绿素a含量几乎为0.对比图1、图2,排除培养基自身对藻生长的影响,本实验菌液最适投入量为6mL,浓度约为6×107cfu/mL.
2.3 J1细菌和铜绿微囊藻所处生长阶段对溶藻效果的影响

图3 菌株J1和铜绿微囊藻所处生长阶段对溶藻效果的影响Fig.3 The effects of the growth phases of bacterium J1 and Microcystis aeruginosa on algicidal effect
实验表明,处于生长对数期的 J1细菌对铜绿微囊藻溶解效果较好,处于稳定期与衰亡期的 J1细菌溶藻效果相当.如图 3a所示,实验第9d,J1对数期、稳定期、衰亡期处理组藻的去除率分别为87.4%、74.7%、73.2%.同时,处于不同生长阶段的铜绿微囊藻,在相同 J1细菌处理下,溶藻效果亦有差异,处于稳定期的藻的实验组,其去除率低于处于适应期与对数期的实验组.由图3b可见,实验第9d,铜绿微囊藻适应期、对数期、稳定期处理组藻的去除率分别为92.3%、89.4%、78.6%.
2.4 J1菌株溶藻的作用方式
由图4可见,相比于对照,J1菌体浸提液、菌体处理组几乎无溶藻效果,即细菌不是通过与藻细胞直接接触的方式抑制藻生长.在铜绿微囊藻藻液初始叶绿素 a浓度为 1940μg/L时,第9d,对照组藻液叶绿素 a上升至 3660μg/L,而高热处理的上清液、离心滤过的上清液、细菌培养液处理组叶绿素 a的含量分别为 620,480, 380μg/L,溶藻效果显著,即细菌通过分泌到胞外的活性物质间接溶藻,且活性物质具有一定的热稳定性.
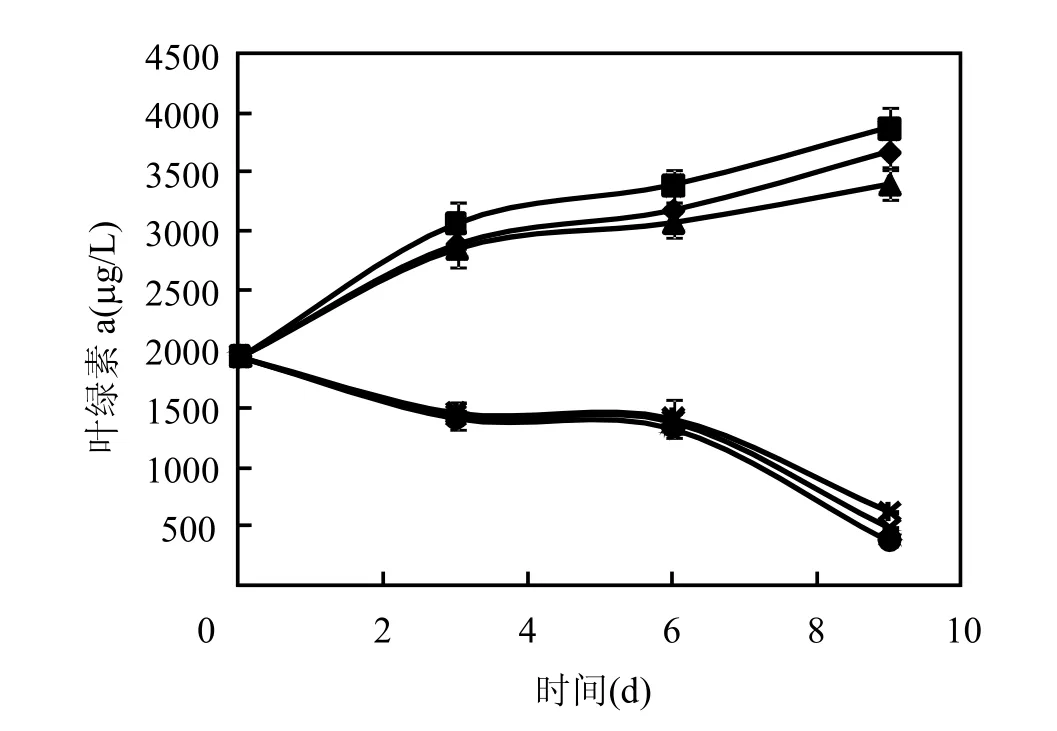
图4 细菌培养液不同处理方式对铜绿微囊藻叶绿素a的影响Fig.4 The effects of bacterial culture liquid treated with different methods on Chl.a of Microcystis aeruginosa—◆—对照 —■—菌体浸提液 —●—细菌培养液—×—菌液上清 —+—高热处理的菌液上清 —▲—菌体
2.5 J1细菌生长曲线的测定
由图5可见,细菌的停滞期在2h左右,2h后进入对数生长期,至 34h左右达生长稳定期,第49h左右进入衰亡期.

图5 菌株J1的生长曲线Fig.5 The growth curve of bacteria J1
2.6 J1细菌生理及分子鉴定
J1菌株在固体牛肉膏蛋白胨培养基上的菌落呈圆形,表面较为干燥、不透明,边缘略呈锯齿状,革兰氏阳性菌,能够水解淀粉、油脂和明胶,柠檬酸盐、甲基红、伏-普试验呈阳性,吲哚反应呈阴性.
PCR扩增产物的长度为 1.5kb,其电泳图谱见图6.获得的16SrDNA序列已在GenBank注册,注册号为 FJ815201,用 Blast程序对 J1的16SrDNA序列和GenBank中已登陆的16SrDNA序列进行核苷酸序列同源性比较,结果发现,与多株芽孢杆菌的同源性极高,再结合生理生化指标可以推断出,实验菌株属于芽孢杆菌属,J1菌株的系统发育树见图7.
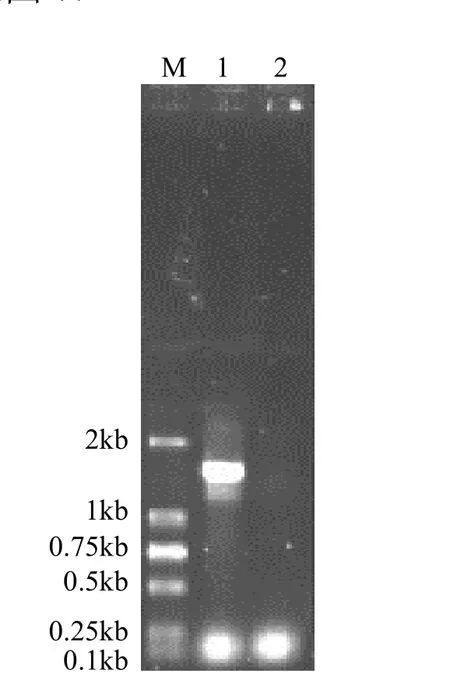
图6 J1PCR扩增产物电泳图谱Fig.6 The amplification of J1 16SrDNA 1为J1菌株,2为阴性对照
3 讨论
铜绿微囊藻是引起水华现象的优势藻种之一.溶解铜绿微囊藻的细菌以前也曾有报道.Yamamoto等[9-10]指出,存在于富营养化湖泊中的假单胞菌是湖泊中能够溶解蓝藻的主要菌株,并从湖泊底泥中分离出一株可抑制铜绿微囊藻的链霉菌.汪辉等[11]自池塘中分离出一株无色杆菌属的细菌亦具有良好的溶藻效果.彭超、裴海燕等[12]曾报道芽胞杆菌对铜绿微囊藻有抑制作用.本研究所筛选到的溶藻细菌亦属于芽胞杆菌属,对铜绿微囊藻的溶解作用表现为藻液变黄,有少许沉淀,显微镜下观察,藻细胞破碎.
牛肉膏蛋白胨培养基属细菌常用培养基,研究表明,在其与藻液投放比为6%时,从实验第9d之后,才出现此培养基对藻生长的抑制.对比实验第 12d,培养基处理组与菌液处理组分别为38.8%和95.3%的藻的去除率,说明后者对藻的抑制占主导地位,且直至第 15d,这一抑制优势有增无减,说明菌液对铜绿微囊藻的抑制作用具有很强的持续性.除菌液投放比为 2%的处理外,其它菌液处理组在实验初期即表现出较强的抑藻效果,说明溶藻活性物质需要一定的作用浓度.另菌液投放比为6%、8%、10%的处理组,溶藻效果无明显区别,说明对于定量藻液,溶藻活性物质有一定的作用饱和浓度.
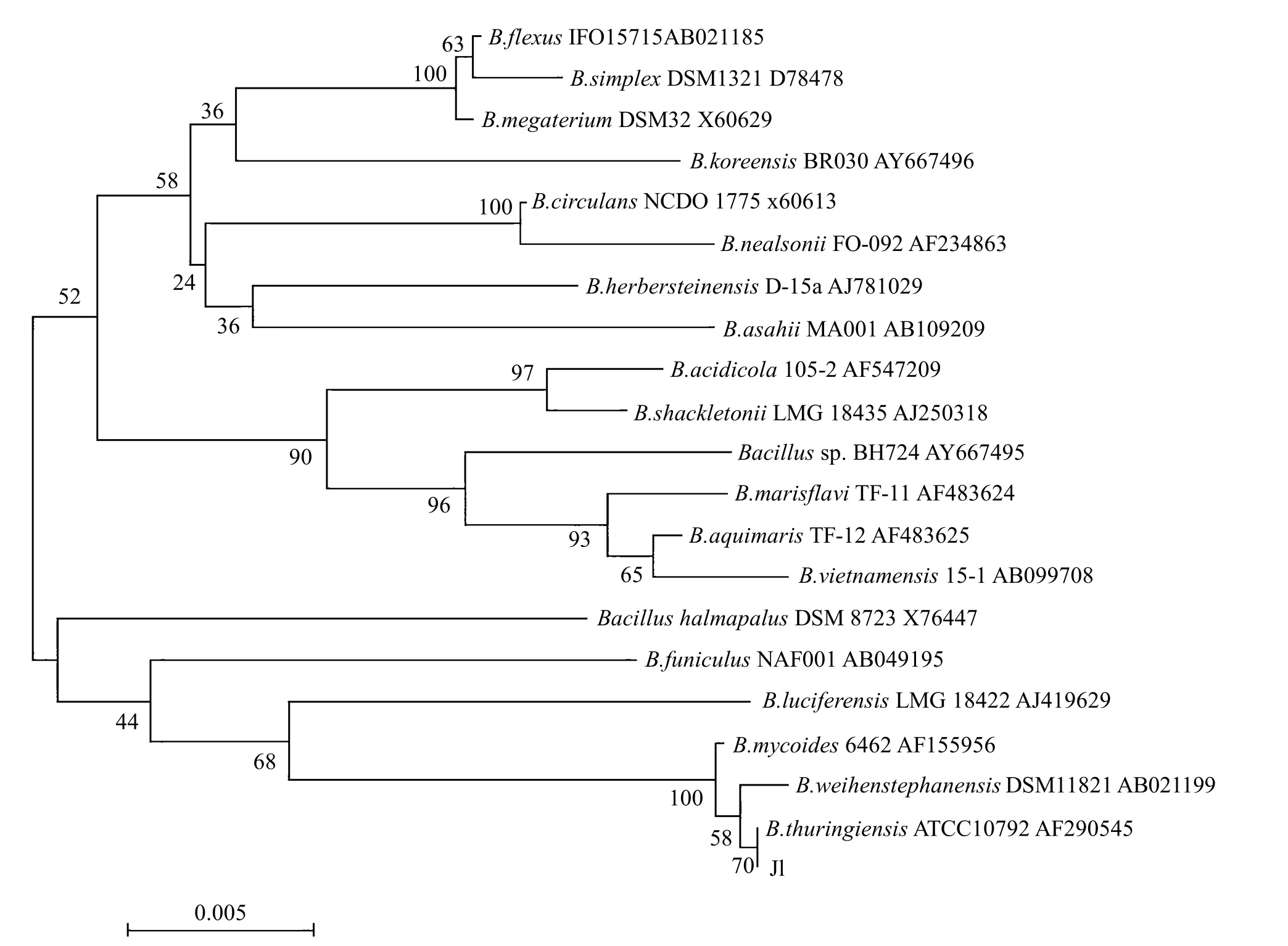
图7 菌株J1的系统发育树Fig.7 The phylogenetic tree of strain J1
J1菌株对铜绿微囊藻的溶解效果受到菌株及铜绿微囊藻所处生长阶段的影响,实验结果表明,处于生长对数期的细菌具有较好的溶藻效果,处于稳定期、衰亡期的细菌,其溶藻效果低于前者,可能是由于细菌对数期生长旺盛,酶活高,分泌胞外溶藻活性物质较多,而这些活性物质在营养物质较少的生长后期作为二次营养物被再次利用,没有在稳定期及衰亡期得到充分的积累;而对处于生长稳定期的铜绿微囊藻,该细菌溶藻效果较差,可能因为处于稳定期的铜绿微囊藻,相较于适应期和对数期而言,营养物质减少,胞外分泌物增加,对藻起到了一定的保护作用,从而藻的去除率下降,有报道[13]称,胞外分泌物能够起到抵抗抗生素、原生动物捕食的保护屏障作用.
溶藻细菌作用方式,一般分为下列 2种情况[14]:直接溶藻,需要细菌与藻细胞直接接触;间接溶藻,主要包括细菌同藻竞争有限营养或细菌分泌胞外物质溶藻.本实验通过对细菌及其培养液进行离心,过滤、浸提、高热处理,得知J1菌株间接溶藻,且分泌到胞外的溶藻活性物质具有一定的热稳定性.目前已报道的细菌胞外杀藻物质主要有以下几类:蛋白质[15];多肽[16];氨基酸[17];抗生素[5];含氮化合物[18];其他未鉴定的杀菌物质[11].本实验所涉及的溶藻活性物质有待进一步研究.
4 结论
4.1 J1菌株对铜绿微囊藻有较好的溶解效果,按6%的体积比向藻液中加入菌液,实验第9d,藻的去除率达 87%以上.J1作用初始浓度应大于2×107cfu/mL,且在一定的菌液浓度范围内,初始浓度越大,溶藻效果越好.
4.2 J1菌株的生长阶段与铜绿微囊藻的生长阶段对溶藻效果均有影响,但作用趋势基本相同.该菌株属间接溶藻,胞外溶藻活性物质具有一定的热稳定性.
4.3 J1菌株革兰氏染色阳性,与多株芽胞杆菌的16SrDNA核苷酸序列的同源性极高,属于芽胞杆菌属.
[1] 吴 刚,席 宇,赵以军.溶藻细菌研究的最新进展 [J]. 环境科学研究, 2002,15(5):43-46.
[2] Lee S, Kato J, Takiguchi N, et al. Involvement of an extracellular protease in Algicidal activity of the marine bacterium Pseudoalteromonas sp. strain A28 [J]. Applied Environmental Microbiology, 2000,66(1):4334-4339.
[3] Doucette G. J, Kodama M, France S, et al. Bacterial interactions with harmful algal bloom species: bloom ecology, toxigenesis and cytology [J]. NATO ASI Series, Series G Ecological Sciences, 1998,41: 619-647
[4] Imamura N, Motoike I, Shimada N, et al. An efficient screening approach for anti-Microcystis compounds based on knowledge of aquatimicrobial ecosystem [J]. Antibiotics, 2001,54(6):582-587.
[5] 裴海燕,胡文容,曲音波.一株溶藻细菌的分离鉴定极其溶藻特性 [J]. 环境科学学报, 2005,25(6):796-802.
[6] 李合生.植物生理生化实验原理和技术 [M]. 北京:高等教育出版社, 2000:134-136.
[7] 赵 斌,何绍江.微生物学实验 [M]. 北京:科学出版社, 2002.
[8] 东秀珠,蔡妙英.常见细菌系统鉴定手册 [M]. 北京:科学出版社, 2001.
[9] Yamamoto Y, Niizuma S, Kuroda N, et al. Occurrence of heterotrophic bacteria causing lysis of cyanobacteria in a eutrophic lake [J]. Japanese Journal of Phycology, 1993,41:215-220.
[10] Yamamoto Y, Kouchiwa T, Hodoki Y, et al. Distribution and identification of actinomycetes lysing cyanobacteria in a eutrophic lake [J]. Journal of Applied Phycology, 1998,10:391-397.
[11] 汪 辉,刘兆普,魏 微,等.一株溶藻菌的分离、鉴定及其溶藻物质的研究 [J]. 中国环境科学, 2008,28(5):461-465.
[12] 彭 超,吴 刚,席 宇,等.3株溶藻细菌的分离鉴定及其溶藻效应 [J]. 环境科学研究, 2003,16(1)37-40.
[13] Costerton J W, Cheng K J, Geesey G G, et al. Bacterial biofilms in nature and disease [J]. Annual Review Microbiology, 1987,41: 435-464.
[14] 赵以军,刘永定.有害藻类及其微生物防治的基础— —藻菌关系的研究动态 [J]. 水生生物学报, 1996,20(2):173-181.
[15] Jeong S Y, Ishida K, Ito Y, et al. Bacillamide,a novel algicide from the marine bacterium, Bacillus sp.SY-1,against the harmful dinoflagellate, Cochlodinium polykrikoides [J]. Tetrahedron Letters, 2003,44(43):8005-8007.
[16] 刘 晶,潘伟斌,秦玉洁,等.两株溶藻细菌的分离鉴定及其溶藻特性 [J]. 环境科学与技术, 2007,30(2):17-22.
[17] 张 勇,席 宇,吴 刚.溶藻细菌杀藻物质的研究进展 [J]. 微生物学通报, 2004,31(1):127-131.
[18] Kim J D, Kim B, Lee C G. Alga-lytic activity of pseudomonas fluorescens against the red tide causing marine alga Heterosigma akashiwo (Raphidophyceae) [J]. Bio. Control, 2007,41(3):296-303.
Effects of an algae-lysing bacterium on the growth of Microcystis aeruginos and its identification.
JIN Li, LIU Zhao-pu*, ZHAO Geng-mao, WANG Hui, CHEN Lei
(Key Laboratory of Marine Biology of Jiangsu Province, College of Resources and Environmental Science, Nanjing Agricultural University, Nanjing 210095, China). China Environmental Science, 2010,30(2):222~227
X172
A
1000-6923(2010)02-0222-06
2009-06-30
国家自然科学基金资助项目(30600086)
∗ 责任作者, 教授, sea@njau.edu
晋 利(1983-),女,河北张家口人,南京农业大学环境与科学学院硕士研究生,主要从事环境微生物方面的研究.
