干扰素诱导蛋白16在结直肠癌中的表达及其与K-ras基因突变的相关性研究
2010-09-20邹云莲唐慧撒亚莲杨慧王林坪郭强严新民
邹云莲 唐慧 撒亚莲 杨慧 王林坪 郭强 严新民
云南省第一人民医院,昆明医学院附属昆华医院,云南 昆明 650032
干扰素诱导蛋白16(interferon induced 16,IFI16)属于干扰素诱导的人HIN 200家族成员。它是一种核蛋白,包含多个调节区,如DNA结合区、转录区和DAPIN/PAAD区(domain in apoptosis and interferon response/pyrin AIM ASC and death domain-like)。IFI16在造血细胞、成纤维细胞和上皮细胞核中均有不同程度的表达,在体内作为一种转录调节子参与细胞周期、分化调节以及炎症反应。最近的研究资料显示,IFI16表达减弱或消失与前列腺癌及乳腺癌的发生密切相关[1-2]。本实验室曾利用基因微阵列技术(microarray)初步分析了结直肠腺癌组织中相对于结直肠腺瘤与正常肠黏膜之异常活化的基因,其中表达倍数差异最高的基因之一为IFI16[3]。为验证芯片结果,本研究采用免疫组化SP法检测结直肠腺瘤组织中IFI16的异常表达状况,并探讨其与结直肠癌发生的早期基因事件——K-ras基因突变间的相关性。
1 资料和方法
1.1 材料
收集云南省第一人民医院病理科2008—2009年门诊及手术获得的结直肠癌石蜡标本61例,其中男性27例,女性34例,平均年龄62.2岁;结直肠腺瘤石蜡组织标本28例,其中男性13例,女性15例,平均年龄60.5岁;健康人群结直肠黏膜为本院消化科门诊内镜室显微结肠镜嵌取经石蜡包埋组织,并经病理证实为正常组织,共18例,其中男性8例,女性10例,平均年龄55.4岁。所有病例在采集标本时均未接受放化学治疗,健康对照及病例均知情并同意提供组织标本,最后经病理检查证实。
IFI16单克隆抗体购自Abcam公司,即用型免疫组化超敏SP试剂盒及DAB显色剂均购自福州迈新公司。K-ras基因引物参照文献[4]由上海生物工程有限公司合成。扩增所需的Taq酶及dNTP购自大连宝生物公司,MvaI内切酶购自Fermentas公司。
1.2 方法
1.2.1 石蜡组织标本免疫组化及结果判定 石蜡切片经常规二甲苯脱蜡,95%、80%、75%及50%梯度酒精水化后,经pH=6.0的柠檬酸盐缓冲溶液微波修复15 min,取出自然冷却。采用SP染色法,一抗工作浓度为1∶50,实验步骤按照试剂盒说明书进行。以PBS代替一抗做阴性对照。经显色剂显色后,光镜下观察染色结果,胞核着色为阳性,评分由2位病理医师独立打分,评分标准由染色强度和染色细胞百分比综合评定。首先按阳性细胞所占百分比评分:阴性为0分,阳性细胞数≤10%为1分,>10%~50%为2分,>50%~75%为3分,>75%为4分;再按染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;最后按两者乘积分数分为4个等级,“-”:0~2分,“+”:3~4分,“++”:6~8分,“+++”:9~12分。我们将分数≥3定为阳性,<3为阴性。
1.2.2 PCR及电泳 采用常规二甲苯脱蜡提取石蜡包埋组织DNA,梯度酒精并水化,应用PCR-RFLP法检测K-ras基因12密码子突变。实验方法参照文献[4]进行。产物经连续2次PCR扩增后,经MvaI酶切37 ℃消化过夜,4%琼脂糖凝胶电泳判定结果。野生型由于保留酶切位点,PCR产物切割为106 bp电泳条带;而突变型标本由于密码子的变异导致酶切位点的消失,PCR产物不能切割,获得的电泳条带为135 bp。随机抽取K-ras突变型和野生型标本各5例进行测序,测序结果与酶切结果比对,以评判实验结果的可靠性。
1.3 统计学处理
应用SPSS 13.0统计学软件,比较IFI16在不同组间阳性率的表达,不同结直肠病理类型与各临床、病理因素的相关性分析采用χ2检验或精确概率检验,相关性检验采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 IFI16在结直肠正常组织、腺瘤及腺癌中的表达情况
检测组织标本共计107例,其中肠腺癌标本61例(IFI16阳性标本30例,阳性率为49.2%),腺瘤标本28例(IFI16阳性标本共7例,阳性率为25%);健康人群结直肠黏膜标本18例(全为阴性表达,图1)。腺癌与腺瘤之间,腺瘤与正常结直肠黏膜组织中IFI16表达差异均有统计学意义(χ2=4.056,P=0.044;χ2=5.308,P=0.021)。IFI16的表达随着结直肠腺瘤癌变这一病理进程逐步升高。IFI16表达与患者病理组织分级(χ2=0.181,P=0.674)、Duke’s分期(χ2=2.083,P=0.149)、年龄(χ2=0.049,P=0.712)和性别(χ2=1.032,P=0.310)无相关性。
2.2 K-ras基因第12密码子变异分析
本研究共提取了54例石蜡包埋组织的DNA,有扩增结果的47例。标本经AvaI切割,47例检测标本中野生型29例(占61.7%),突变型18例(占38.3%)。为评判酶切结果的可靠性,随机抽取10例进行基因测序,10例标本测序结果与酶切结果完全吻合(图2、3)。K-ras基因的变异与患者的性别(χ2=0.154,P=0.697),年龄(χ2=0.692,P=0.813),Duke’s分期(χ2=0.068,P=0.685),病理组织分级(χ2=0.071,P=0.636)差异均无统计意义。
2.3 结直肠癌组织中IFI16表达与K-ras基因突变之间的相关性
在47例扩增阳性的标本中,29例K-ras野生型标本中有16例IFI16阳性表达(占55.2%);突变型标本18例中有8例IFI16阳性表达(占44.4%),K-ras基因变异与IFI16表达差异无统计学意义(χ2=1.178,P=0.278>0.05)。值得关注的是,在18例突变型患者中,有13例结直肠腺癌组织细胞质中检测到IFI16阳性表达(图1D),而在29例K-ras野生型患者中,仅4例有IFI16的胞质异位表达,K-ras基因变异与IFI16异位表达差异有统计学意义(χ2=18.939,P=0.000,表1)。经Pearson等级相关分析,两者之间呈显著相关性(r=0.635)。IFI16异位与病理组织分级(χ2=1.423,P=0.233)及Duke’s分期(χ2=1.466,P=0.224)差异均无统计学意义。
3 讨 论
IFI16属干扰素诱导的人蛋白家族HIN200成员之一。其结构具有该家族共有的结构基序,如N端的DAPIN/PAAD区、DNA结合区、核定位区及C端200氨基酸重复区域,它能介导蛋白与蛋白及蛋白与DNA之间的相互作用。IFI16首先在造血干细胞中被发现,后来被发现在淋巴细胞、二倍体成纤维细胞、血管内皮细胞及上皮细胞胞核中均有不同程度的表达,其生理功能主要在胞核中进行。在快速增殖的人皮肤鳞状上皮基底层中IFI16高表达,表明其在组织的正常分化与增殖中具有重要的生理功能[5]。
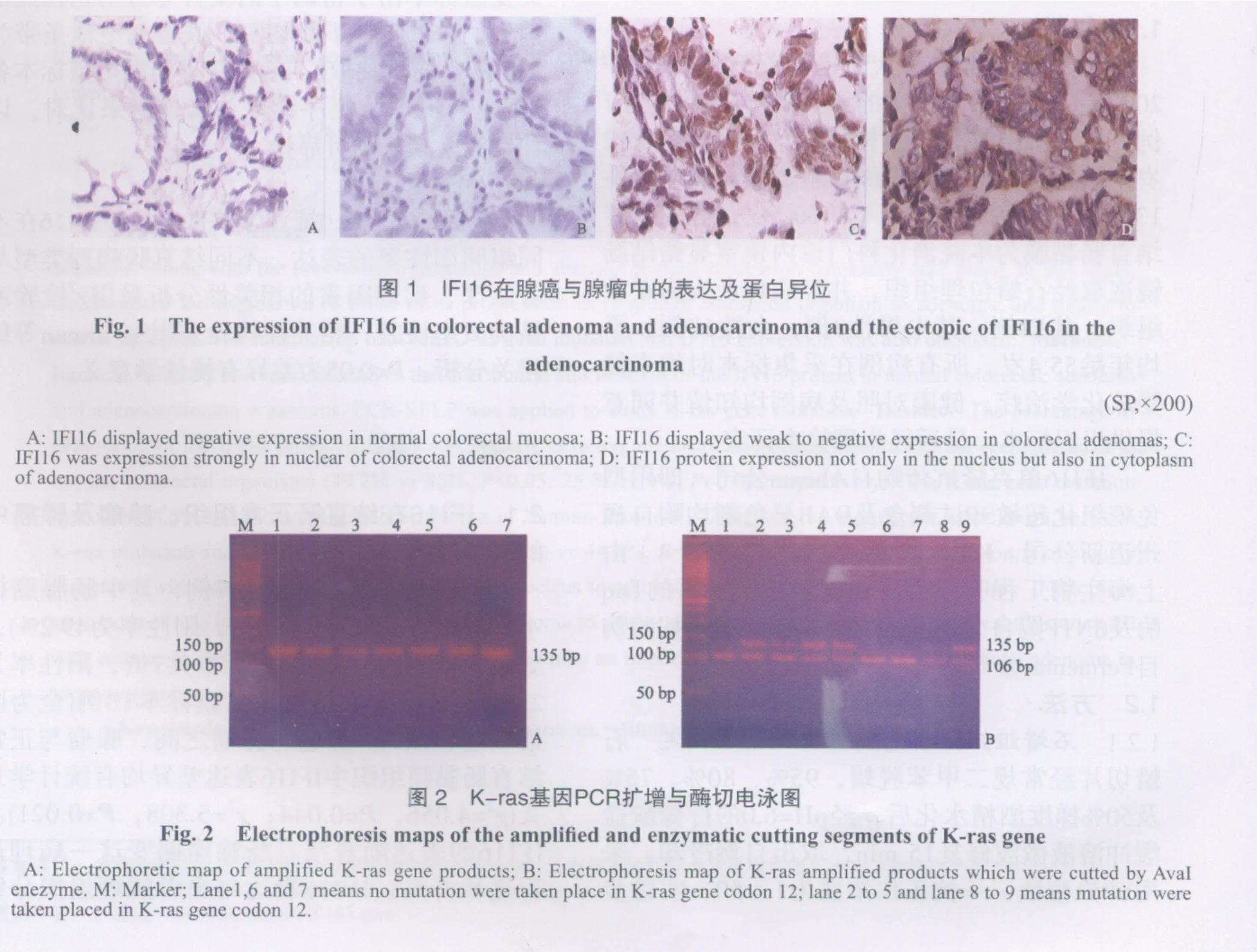


表1 IFI16表达及IFI16定位与K-ras基因相关性分析Tab.1 Expression rate of IFI16 in adenocinoma cells and the correlation of the IFI16 location and K-ras gene statusn(%)
目前愈来愈多的证据表明,IFI16作为肿瘤抑制因子,与多种蛋白或基因如pRb、p53及BRCA1相互作用,参与细胞增殖、凋亡和分化的调控,而蛋白的表达或消失与肿瘤的发生密切相关[6-8],因此恢复该基因的表达能促进肿瘤细胞的凋亡,抑制新生血管生成,并通过释放趋化因子招募循环中的巨噬细胞起到抗肿瘤活性的作用[1-2,9]。然而,IFI16对肿瘤的抑制作用并不是绝对的。Yu等[10]发现在肝癌发病机制中,IFI16可能作为癌基因的下游靶基因参与了肝癌的发病过程,它通过降低P21waf1/ciP1来促进细胞周期进展,为诱导细胞增殖所必须。在睾丸精原细胞原位癌中IFI16的表达均较正常睾丸显著升高[11]。IFI16表达水平的升高促进B细胞恶性肿瘤的形成和发展[12],缺失了Rb蛋白结合基序的干扰素诱导鼠蛋白p204显示出癌基因的行为特征[13]。IFI16在机体中可能作为一把双刃剑扮演不同角色,即IFI16的持续表达导致细胞生长抑制,而在合适环境可改变自身,或与不同的结合子结合来激活细胞,使其免于凋亡而获得重生。
结直肠癌近年在中国呈快速上升的趋势,目前普遍认为结直肠腺瘤是腺癌的癌前病变。我们应用基因微阵列技术筛查发生、发展过程中的早期基因事件,结果发现IFI16在腺瘤向腺癌转化过程中mRNA显著增加[3]。这提示IFI16可能作为促进因子参与腺瘤向腺癌的转化。本研究我们应用免疫组化技术对正常结直肠黏膜组织、腺瘤和腺癌组织进行了IFI16表达分析,结果表明,正常结直肠黏膜组织向结直肠腺瘤最后发展为腺癌过程中IFI16表达逐步增加,IFI16表达率为49.2%,腺瘤蛋白表达率为25%,正常为0%,三者两两相比,差异有统计学意义(P<0.05)。这从蛋白水平上进一步证实,结直肠腺瘤向腺癌转化过程中,IFI16作为促进因子而非肿瘤抑制因子参与结直肠癌的发生。IFI16的抑癌或促癌作用确实存在着显著差异,而这种差异是由于其本身的基因结构发生了改变,还是与不同结合子或基因结合所导致尚需大量的后续研究加以解释和验证。
我们在结直肠腺癌组织中除观察到典型的胞核表达外,还发现胞质中有IFI16表达。2004年,Nobuko等[1]首先在乳腺癌组织中观察到IFI16的胞质异位。Ding等[14]在探讨p204蛋白(该蛋白与IFI16同一家族,但在鼠体内表达)与K-ras基因关系时提出p204蛋白作为K-ras蛋白激活的负性反馈抑制子参与机体的生理调控。K-ras基因突变与结直肠癌的发生、发展密切相关。在结直肠癌发展进程中IFI16是否与K-ras基因存在同样的反馈抑制机制?因此,本研究对收集的病例进行了K-ras基因突变研究,并探讨其与IFI16表达的相关性。在有扩增结果的47例标本中,K-ras基因突变率为38.3%,该结果与国内报道的基本一致[15]。IFI16在K-ras野生型较突变型组织中表达有所下调,但差异无统计学意义。而IFI16胞核至胞质的异位表达与K-ras基因变异差异有统计学意义,两者显著相关。这在一定程度上提示IFI16的胞质异位与结直肠癌的发生密切相关,突变的K-ras基因通过募集IFI16胞核转移至胞质并与之结合,调控K-ras基因活性及下游信号传递。但由于本研究的样本数量有限,且对K-ras基因突变仅限于12密码子,尚需加大样本数量及对K-ras基因多个位点研究以完善研究结果。
总之,本研究应用免疫组化方法对组织中IFI16检测的结果,进一步证实了我们之前利用基因微阵列技术所得的结果。变异的K-ras基因通过募集IFI16胞核至胞质的异位表达,并与之相互作用,在结直肠癌发生、发展中起着重要作用。
[1] Fujiuchi N, Aglipay JA, Ohtsuka T, et al.Requirement of IFI16 for the maximal activation of p53 induced by ionizing radiation[J].J Biol Chem, 2004,279(19):20339-20344.
[2] Alimirah F, Chen J, Davis FJ, et al.IFI16 in human prostate cancer[J].Mol Cancer Res, 2007,5(3):251-259.
[3] 唐慧,邹云莲,朱军,等.应用基因芯片技术筛选大肠腺瘤-癌序列相关基因的初步研究[J].中华消化内镜杂志,2009,26(10): 80-82.
[4] Levi S, Urbano-Ispizua A, Gill R, et al.Multiple K-ras codon 12 mutations in cholangiocarcinomas demonstrated with a sensitive polymerase chain reaction technique[J].Cancer Res, 1991, 51(13):3497-3502.
[5] Wei W, Clarke CJ, Somers GR , et al.Expression of IFI 16 in epithelial cells and lymphoid tissues[J].Histochem Cell Biol, 2003, 119(1):45-54.
[6] Caposio P, Gugliesi F, Zannetti C, et al.A novel role of the interferon-inducible protein IFI16 as inducer of proinflammatory moleculars in endothelial cells[J].J Biol Chem, 2007, 282(46):33515-33529.
[7] Kim EJ, Park JI, Nelkin BD.IFI16 is an essential mediator of growth inhibition , but not differentiation, induced by the leukemia inhibitory factor/JAK/STAT pathway in medullary thyroid carcinoma cells[J].J Bio Chem, 2005,280(6):4913-4920.
[8] Choubey D, Deka R, Ho SM.Interferon-inducible IFI16 protein in human cancers and autoimmune diseases[J].Front Biosci, 2008,13:598-608.
[9] Mazibrada J, De Andrea M, Rittà M, et al.In vivo growth inhibition of head and neck squamous cell carcinoma by the interferon inducible gene IFI16[J].Cancer Lett, 2010,287(1):33-43.
[10] Yu F, Hao X, Zhao H, et al.Delta-like 1 contributes to cell growth by increasing the interferon-inducible protein 16 expression hepatocellular carcinoma[J].Liver Int, 2010,30(5):703-714.
[11] Almstrup K, Leffers H, Lothe RA, et al.Improved gene expression signature of testicular carcinoma in situ[J].Int J Androl, 2007, 30(4):292-302.
[12] Veeranki S, Choubey D.Systemic lupus erythematosus and increased risk to develop B cell malignancies: role of the p200-family proteins[J].Immunol Lett, 2010, 133(1):1-5.[13] De Andrea M, Ravotto M, Noris E, et al.The interferoninducible gene, Ifi204, acquires malignant transformation capability upon mutation at the Rb-binding sites[J].FEEBS Lett, 2002,515(1-3):51-57.
[14] Ding B, Lengyel P.P204 protein is a novel modulator of ras activity[J].J Biol Chem, 2008, 283(9):5831-5848.
[15] 高枫,唐卫中,李卫.中国人散发性大肠癌K-ras基因突变的研究[J].中华实验外科杂志,2005,1(22):65-67.
