GATA3在乳腺癌中的表达及其与预后的关系
2010-09-20谢轶群裔海鹰施俊义李曦洲隋金珂
谢轶群 裔海鹰 施俊义 李曦洲 隋金珂
1.第二军医大学附属长海医院普外科,上海 200433;2.上海市黄浦区中心医院乳腺外科,上海 200002
GATA3属于GATA转录因子家族[1],能调节多种细胞类型的遗传分化方向(lineage determination)。其中包括自主神经系统的神经元、T辅助细胞、毛囊的毛根内鞘、脂肪细胞、肾病肾管(nephritic ducts of the kidney)、耳蜗及乳腺导管上皮细胞[2-4]。近期国外研究表明GATA3作为转录因子 与正常乳腺组织以及乳腺癌的发生、发展相关,同时与乳腺癌的预后也可能相关。目前,国内相关研究未见报道,而国外相关研究尚存争议。为探讨GATA3与乳腺癌预后的关系,本研究采用免疫组织化学方法,检测乳腺癌组织中GATA3的表达,分析其与其他临床病理指标以及预后的关系。
1 资料和方法
1.1 标本及主要试剂
1.1.1 一般资料及组织标本 所有标本均系抽取上海市黄浦区中心医院 乳腺外科2004—2005年间手术切 除的乳腺癌组织标本,共100例,并经病理HE染色和本院2位以上病理科医师确诊。各组织 标本均有完整术后病理资料:其中导管原位癌13例,浸润性导管癌56例,浸润性小叶癌22例,浸润性神经内分泌癌2例,黏液腺癌4例,派杰氏病3例;其中ER(+)70例,2 4例伴有腋窝淋巴结转移(淋巴结转移情况以术后病理检查为准)。乳腺癌 患者手术前均未经过抗癌治疗(包括放疗、化疗及内分泌治疗等)。乳腺癌患者均为女性,年龄26~83岁(平均55岁)。
1.1.2 主要试剂 GATA3多克隆兔抗人抗体购自上海亿欣生物科技有限公司;EnVision试剂购自上海蓝创生物科技发展有限公司;对二甲胺基偶氮苯(DAB)显色试剂盒购自福州迈新生物技术有限公司。
1.2 方法
免疫组化染色:所有标本均经10%中性甲醛固定,经常规脱水透明石蜡包埋,做4 μm厚连续切片,备常规HE染色及免疫组织化学染色,免疫组织化学染色采用EnVision法。根据一抗说明书要求进行前处理。石蜡切片常规脱蜡至水后,以3%H2O2室温下温育10 min以阻断内源性过氧化物酶的活性。石蜡切片浸入0.05 mol/L EDTA pH=8.0的缓冲液微波(98 ℃)加炉热10 min,重复2次,自然冷却20 min,进行热诱导抗原修复。滴加一抗兔抗GATA3多克隆抗体(1∶100),4 ℃温育过夜。滴加酶标记的二抗(EnVision试剂),室温湿盒中温育60 min。DAB显色3 min,苏木精衬染,常规酒精梯度脱水,二甲苯透明,中性树胶封片,光镜观察实验结果。实验中以PBS代替一抗作阴性对照,以已知阳性片作阳性对照,以确保实验的特异度和灵敏度。
1.3 结果判定
GATA3染色阳性结果的判定标准:乳腺癌细胞胞核中出现棕褐色颗粒染色为GATA3阳性表达细胞。每张切片随机选择5个高倍视野,按阳性细胞数占同类细胞的百分比分类,阳性细胞数≥20%为GATA3表达阳性切片[5]。ER、PR、Her-2均记为(+)和(-)。ER(+)为原术后病理资料ER(+~+++);ER(-)为原术后病理资料ER(-)。PR(+)为原术后病理资料PR(+~+++);PR(-)为原术后病理资料PR(-)。Her-2(+)为原术后病理资料Her-2(+++);Her-2(-)为原术后病理资料Her-2(-~++)。乳腺癌组织病理类型、肿瘤组织学分级、肿瘤大小、淋巴结转移状态均以原术后病理资料为判定标准。
1.4 随访
本组全部100例乳腺癌均从病理确诊时开始计算生存时间,随访截止时间为2010年3月。失访8例,随访率92%,中位随访时间约5.3年。
1.5 统计处理
采用SPSS 11.5 统计学软件进行数据分析。GATA3在乳腺癌中的表达与其他临床病理指标、预后的关系,均采用χ2检验进行分析,其中相关性采用Spearman相关 系数r表示;GATA3在ER阳性并接受他莫昔芬治疗的患者中的表达与预后的关系,采用Fish确切概率法进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 乳腺癌中GATA3的表达与其他临床病理指标的关系
乳腺癌中可见有GATA3的阳性表达,为深棕色及棕黄色颗粒,细胞核着色。GATA3的低表达与肿瘤高组织分级、淋巴结阳性、ER阴性状态、PR阴性、Her-2/neu过度表达等表示预后较差的指标相关(P<0.05),但与确诊年龄、肿瘤大小无关(P>0.05,表1)。
2.2 所有乳腺癌患者中GATA3的表达与预后的关 系
本组100例乳腺癌患者中,获得随访92例,失访8例。GATA3阳性组55例,死亡9例,5年总生存率为83.6%;GATA3阴性组37例,死亡14例,5年总生存率为62.2%。经χ2检验分析,本组乳腺癌患者中GATA3的表达水平与预后相关(P=0.02),提示在乳腺癌患者中GATA3表达阳性者预后较好(表2)。
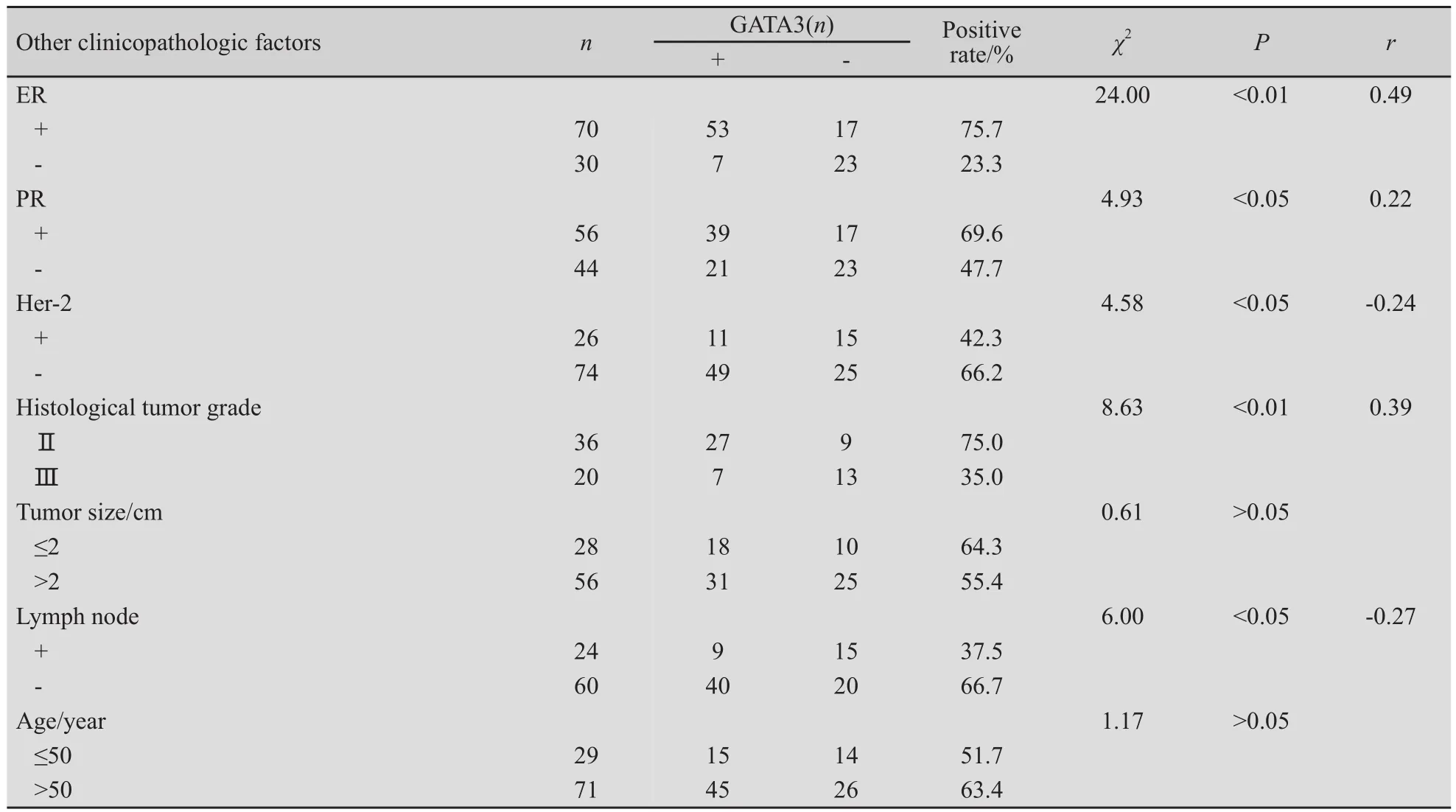
表1 乳腺癌中GATA3的表达与其他临床病理指标的关系Tab.1 T he relationship between GATA3 expression and other clinicopathologic factors
2.3 ER阳性并接受他莫昔芬治疗的乳腺癌患者中GATA3的表达与预后的关系
本组全部病例中,ER阳性70例(均接受他莫昔芬治疗5年),获得随访64例,失访6例。GATA3阳性组49例,死亡6例,5年总生存率为87.8%;GATA3阴性组15例,死亡6例,5年总生存率为60.0%。经Fish确切概率法分析,本组ER阳性乳腺癌患者中GATA3的表达水平与预后相关(P=0.03),提示在ER阳性并接受他莫昔芬治疗的乳腺癌患者中GATA3表达阳性者,预后较好(表3)。

表2 GATA3与乳腺癌预后的关系Tab.2 The relationship between GATA3 and the prognosis in breast carcinoma

表3 ER阳性并接受他莫昔芬治疗的乳腺癌患者中GATA3与预后的关系Tab.3 The relationship between GATA3 and the prognosis in ER-positive breast carcinoma with tamoxifen therapy
3 讨 论
GATA3属于GATA转录因子家族(成员包括GATA1至GATA6),它们以高亲和力结合于共同序列(A/T)GATA(A/G),共有一个类固醇激素受体超家族的C4锌指结构DNA结合基序[1],定位于染色体10p15[6]。GATA家族依据结构特征和表达模式被分为两大类:第一类GATA1、GATA2和GATA3主要在造血细胞中表达,而第二类GATA4、GATA5和GATA6则主要在心血管系统及包括肝、肺、胰腺和肠道在内的内胚层来源的组织中表达[7]。研究证实,GATA3促成了多种组织的正常发育[2-4]。
本研究显示在56例浸润性导管癌中肿瘤组织学分级与GATA3的阳性表达显著相关(P<0.01,r=0.39),提示肿瘤组织学分级越高,GATA3表达率越低。这说明GATA3是重要的分化调节因子,不仅能促进乳腺细胞的分化,同样能促进乳腺癌细胞的分化。本研究还显示在84例浸润性乳腺癌中,淋巴结转移24例。浸润性乳腺癌中淋巴结转移状态与GATA3阳性表达相关(P=0.01,r=-0.27),提示在浸润性乳腺癌中淋巴结转移者GATA3表达率低。可见,GATA3在乳腺癌中的表达与乳腺癌的分化水平、转移能力相关。在分化好、转移性低的乳腺癌细胞中,GATA3往往呈阳性表达。
本研究显示GATA3的低表达与肿瘤高组织分级、淋巴结阳性、ER阴性状态、PR阴性状态、Her-2/neu过度表达等表示预后较差的指标相关,但与确诊年龄、肿瘤大小无关,与国外研究相符[5,8-9]。此外,本研究显示GATA3与ER密切相关(r=0.49,P<0.01)。
故我们先后对GATA3在全部乳腺癌患者中以及在ER阳性并接受他莫昔芬治疗的乳腺癌患者中判断预后的作用进行了研究。本研究显示乳腺癌患者中GATA3的表达水平与预后相关(P=0.02),提示在乳腺癌患者中GATA3表达阳性者,预后较好。本研究还显示在ER阳性并接受他莫昔芬治疗的乳腺癌患者中GATA3的表达水平与预后相关(P=0.03),提示在ER阳性并接受他莫昔芬治疗的乳腺癌患者中GATA3表达阳性者,预后较好。
GATA3在乳腺癌预后分析中的作用是当前研究的热点之一,相关研究结果也存在分歧。Mehra等[8]发现,在预后很差的浸润性癌中GATA3为主要的低表达基因之一,GATA3低表达的肿瘤较高表达的肿瘤生存期明显缩短。但Voduc等[9]对3 119例浸润性乳腺癌病例的研究发现,虽然单因素分析中GATA3的表达是预后较好的标志,但多因素(包括患者年龄、肿瘤大小、组织学分级、淋巴结状态、ER状态、Her-2状态等)分析中,GATA3并不是独立的预后因子。同时在ER阳性的患者中,无论是否接收他莫昔芬治疗,GATA3均不是独立的预后因子。Ciocca等[10]在一项10年随访研究中发现,GATA3阳性和阴性的肿瘤之间复发率和生存率差异无统计学意义(P>0.05)。而在ER阳性并接受内分泌治疗的患者中,GATA3的表达具有中强度预后价值。Jacquemier等[11]发现,在240例接受激素治疗的ER阳性乳腺癌患者中,多因素分析显示GATA3、血管癌旁浸润(vascular peritumoral invasion,VPI)、Ki67、P53 的预
后价值有显著的统计学意义。可见,GATA3在判断预后中是否具有价值存在争议。本研究显示其表达与ER表达高度相关,而ER在乳腺癌中具有重要的指导内分泌治疗及判断预后的作用。因此,结合国外学者相关研究,我们认为在分析GATA3判断乳腺癌预后中的作用时应充分考虑ER作用的影响,否则GATA3的作用与ER的作用将难以区分。我们建议首先在ER阳性的患者中进行GATA3判断预后价值的研究。综上所述,GATA3在判断预后中的作用仍有争议,本研究显示GATA3在乳腺癌患者以及ER阳性并接受他莫昔芬治疗的乳腺癌患者中GATA3表达阳性者,预后均较好。
[1] Merika M, Orkin SH.DNA-binding specificity of GATA family transcription factors[J].Mol Cell Biol, 1993, 13(7):3999-4010.
[2] Pai SY, Truitt ML, Ho IC.GATA-3 deficiency abrogates the development and maintenance of T helper type 2 cells[J].Proc Natl Acad Sci USA, 2004, 101(7): 1993-1998.
[3] Kaufman CK, Zhou P, Pasolli HA, et al.GATA-3: an unexpected regulator of cell lineage determination in skin[J].Genes Dev, 2003, 17(17): 2108-2122.
[4] Kouros-Mehr H, Slorach EM, Sternlicht MD, et al.GATA-3 maintains the differentiation of the luminal cell fate in the mammary gland[J].Cell, 2006, 127(5): 1041-1055.
[5] Sorlie T, Tibshirani R, Parker J, et al.Repeated observation of breast tumor subtypes in independent gene expression data sets[J].Proc Natl Acad Sci USA, 2003, 100(14): 8418-8423.
[6] Joulin V, Bories D, Eléouet JF, et al.A T-cell specific TCR delta DNA binding protein is a member of the human GATA family[J].EMBO J, 1991, 10(7): 1809-1816.
[7] Patient RK, McGhee JD.The GATA family (vertebrates and invertebrates) [R].Curr Opin Genet Dev, 2002, 12(4):416-422.
[8] Mehra R, Varambally S, Ding L, et al.Identification of GATA3 as a breast cancer prognostic marker by global gene expression meta-analysis[J].Cancer Res, 2005, 65(24): 11259-11264.
[9] Voduc D, Cheang M, Nielsen T.GATA-3 expression in breast cancer has a strong association with estrogen receptor but lacks independent prognostic value[J].Cancer Epidemiol Biomarkers Prev, 2008, 17(2): 365-373.
[10] Ciocca V, Daskalakis C, Ciocca RM, et al.The significance of GATA3 expression in breast cancer: a 10-year follow-up study[J].Hum Pathol, 2009, 40(4): 489-495.
[11] Jacquemier J, Charafe-Jauffret E, Monville F, et al.Association of GATA3, P53, Ki67 status and vascular peritumoral invasion are strongly prognostic in luminal breast cancer[J].Breast Cancer Res, 2009, 11(2): R23.
