Survivin mRNA在胃癌外周血中的表达及临床意义
2010-09-20邓建忠金建华陆文斌王芳
邓建忠 金建华 陆文斌 王芳
江苏大学附属武进医院肿瘤内科,江苏 常州 213002
Survivin于1997年由Ambrosini等[1]利用效应细胞蛋白酶受体-1(effector cell protease receptor-1,EPR-1)的cDNA在人类基因组库中筛选克隆,具有抑制细胞凋亡、调控细胞周期及参与血管形成的作用。胃癌因其早期症状不明显,大多数患者被确诊时病程已至进展期。检测外周血中Survivin的表达,有可能成为检测肿瘤转移及判断预后的参考指标之一。本研究旨在探讨外周血Survivin mRNA 的表达水平与胃癌发生、发展的作用及临床意义。
1 资料和方法
1.1 临床资料
选择2007年10月—2009年6月到江苏大学附属武进医院肿瘤科、消化内科和外科就诊并经胃镜活检及术后病理确诊为胃癌的患者50例(转移28例,未转移22例),同时平行选择年龄性别相匹配的门诊慢性胃炎患者50例,所有患者均知情同意。
实验组病例为胃癌患者,共50例,其中男性28例(转移16例,未转移12例),女性22例(转移12例,未转移10例)。年龄34~72岁(中位年龄58岁)。TNM分期:Ⅰ期3例,Ⅱ期8例,Ⅲ期11例,Ⅳ期28例。采用2002年第6版AJCC胃癌TNM分期标准进行分期。对照组病例为胃炎患者,共50例,其中男性30例,女性20例。年龄30~68岁(中位年龄54岁)。
1.2 方法
1.2.1 外周血总RNA的提取、完整性和纯度检测 根据试剂盒操作说明,应用TRIzol Reagant行提取RNA,所提取的总RNA用紫外分光光度计定量并检测其纯度。A260/A280≥1.8为合格。所提取的总RNA完整性经琼脂糖电泳鉴定。-70 ℃保存待用。
1.2.2 cDNA合成 20 μL反应体系中含:总RNA 1 μg,10×缓冲液2 μL,dNTPs(10 mmol/L)2 μL,随机引物100 ng,M-MLV(10 U/μL)2 μL,加DEPC液至20 μL。逆转录反应条件为:37 ℃ 60 min,95 ℃ 5 min,-70 ℃保存待用。
1.2.3 实时荧光定量PCR(RT-PCR)检测 利用DNAman软件设计RT-PCR Survivin和管家基因GAPDH的引物:GAPDH上游引物为5’-GAAGGTGAAGGTCGGAGTC-3’,下游引物为5’-GAAGATGGTGATGGGATTTC-3’,探针序列为5’-CAAGCTTCCCGTTCTCAGCC-3’;Survivin上游引物为5’-TGCCCCGACGTTGCC-3’,下游引物为5’-CAGTTCTTGAATGTAGAGATGCGGT-3’,探针序列为5’-CCTGGCAGCCCTTTCTCAAGGACC-3’。用RT-PCR法检测患者外周血中Survivin mRNA的表达水平,GAPDH为内参照,PCR试剂盒、引物及探针合成由中山医科大学达安基因有限公司提供。50 μL RT-PCR反应体系中含:1×定量缓冲液,200 μm dNTPs,5 UampliTaq Gold,Survivin上、下游引物各600 nmol/L,荧光探针200 nmol/L,100 ng cDNA,反应条件为:50 ℃10 s,95 ℃ 10 min,然后95 ℃ 30 s,60 ℃1 min,共40个循环。PCR反应结束后,根据
标准曲线仪器自动进行分析,对每份标本均设副孔,采用GAPDH为内参基因,以Survivin/GAPDH的比值计算出待测样品的拷贝数。
1.2.4 统计学处理 应用SPSS 13.0统计软件包进行统计学处理,计数资料采用χ2检验,生存曲线用Kaplan-Meier法建立,与生存时间的关系用Log-rank检验。用Cox比例风险模型评估影响预后生存的各变量。采用双侧检验进行处理,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 Survivin mRNA检测结果
正常对照组(胃炎患者)外周血中未检测到Survivin mRNA表达。胃癌组患者Survivin表达检测率为86%(43例)。其中28例转移患者的阳性率为100%,22例未转移的为68.2%(P<0.05)。
2.2 胃癌患者Survivin表达与临床病理因素之间关系
与未转移者相比较,有脏器转移者Survivin mRNA表达明显增高。Survivin mRNA表达与年龄、性别及淋巴结转移均无相关性(P>0.05,表1)。
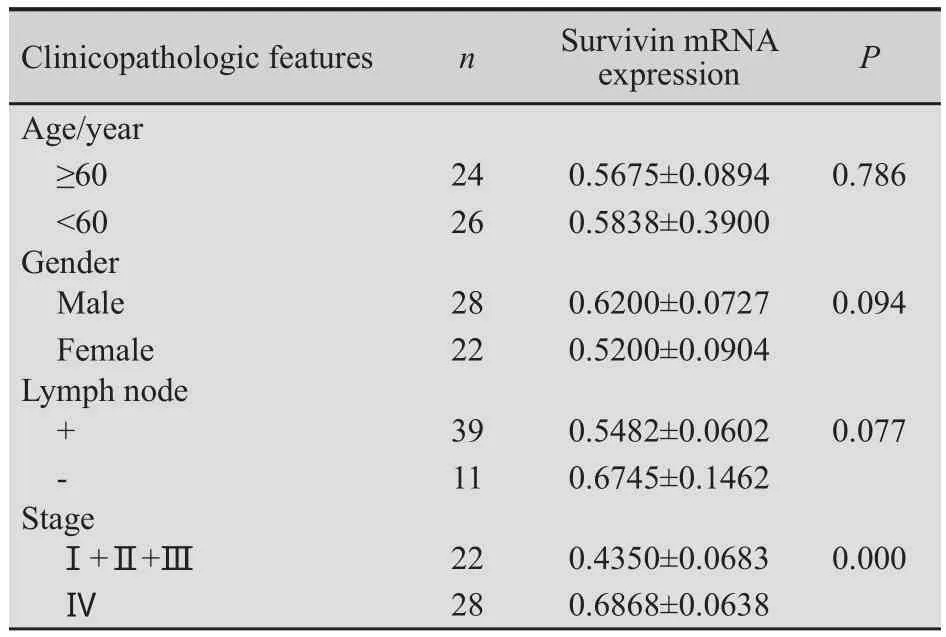
表1 Survivin表达与胃癌临床病理学因素之间的关系Tab.1 The relationship between Survivin expression level and clinicopathologic features
2.3 预后因素分析
运用COX回归模型对可能影响胃癌患者预后的各种因素,包括年龄、性别、淋巴结转移、Survivin表达及病理分期等进行回归分析。分析结果显示:病理分期、Survivin mRNA的表达水平是影响胃癌预后的独立预测因素(表2)。
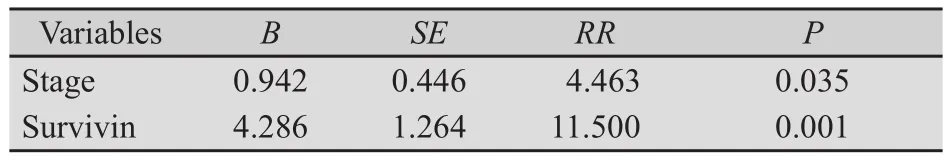
表2 COX模型筛选的胃癌危险因素及其参数Tab.2 Multivariate analysis of prognostic factors by COX model
3 讨 论
Survivin基因定位于染色体17q25,是凋亡抑制蛋白(inhibitor of apoptotic protein,IAP)家族中的新成员,IAP家族的所有成员都具有一个共同的特征,即含有一个有1~3个拷贝的包括70个氨基酸残基的杆状病毒IAP重复序列(baculovims IAP repeat,BIR),BIR功能区是发挥功能的主要结构,IAP具有显著的抑制细胞凋亡的效应。体外实验表明,Survivin可以与效应细胞死亡蛋白酶caspase-3和caspase-7结合,抑制细胞凋亡,并抑制由Fas、Bax、抗癌药物诱导的细胞凋亡[2]。胃癌是化疗相对敏感的肿瘤,多种抗癌药物治疗肿瘤的原理是通过凋亡途径导致肿瘤细胞死亡,这提示凋亡抑制基因Survivin可作为胃癌患者对于化疗是否敏感的指标之一,从而指导肿瘤的个体化治疗。Survivin基因在肿瘤研究领域备受关注:Survivin表达于胚胎和发育的胎儿组织,但较少表达于正常成人的终末分化组织。Survivin选择性地在肿瘤中表达,目前已发现结肠癌、胃癌、食管癌、非小细胞肺癌等肿瘤中有Survivin的表达[3-6]。有研究表明Survivin在胃癌组织中100%表达。而在胃癌周围正常组织中几乎不表达[7]。但姚学权等[8]利用免疫组化SP法检测Survivin在胃腺癌中的表达,结果显示:胃癌原发灶、淋巴结转移癌细胞及正常腺体基底生发层细胞的Survivin的阳性表达率分别为49.2%、64.0%和17.5%。
目前国内检测Survivin常采用的是肿瘤组织及免疫组化的方法,而要对胃癌不同治疗阶段进行监测,了解化疗时药物对肿瘤细胞诱导凋亡作用,仅仅检测胃癌组织中Survivin的表达是不够的,需要采用新的途径和更好的检测方法。寻找敏感和特异的无创性方法监测胃癌是当前的研究热点,外周血作为肿瘤细胞转移的载体,是血行转移的必要条件;实时荧光定量RT-PCR技术可以较准确地检测肿瘤患者外周血中肿瘤细胞的存在水平。
本研究显示,正常对照组外周血未检测到Survivin mRNA的表达。我们认为可能是由于患者外周血中肿瘤细胞的数量不足以促使Survivin表达,就被机体正常的免疫系统所抑制或消灭。而我们发现所有有远处转移的胃癌患者Survivin均表达,能更好说明Survivin对抑制癌细胞凋亡的作用;在胃癌组患者中Survivin表达检测率为86.0%,而那些早期或局部晚期的胃癌患者Survivin的表达率为68.2%,较Bertazza等[4]报道的98.6%低;两者相比,有远处转移胃癌患者的Survivin表达率明显增高(P<0.05)。我们还对Survivin mRNA表达与年龄、性别及淋巴结转移相关性作了研究,结果发现Survivin mRNA表达与这些临床病理特征均无相关性(P>0.05)。以上结果表明随着肿瘤病期的增加,Survivin表达水平升高,提示Survivin的表达在肿瘤的侵袭和血行转移过程中起一定作用。本研究结果与Song等[9]的研究结果基本相似,仅肿块大小的临床病理特征与Survivin 表达有关,而与年龄、性别、淋巴结转移无相关性;但与Yie等[10]报道的浸润深度、淋巴结转移状态及疾病分期与Survivin mRNA表达有关的研究结果不同。我们认为这也可能是由于彼此所使用的检测方法及入组的个体差异有关。
COX回归模型对可能影响胃癌患者预后的因素进行回归分析,结果发现:肿瘤分期、Survivin mRNA的表达水平是影响胃癌预后的独立因素,表明Survivin对胃癌的发生、发展影响显著,且外周血Survivin的检测可作为临床评估胃癌患者预后的客观指标。
总之,实时荧光定量RT-PCR技术检测肿瘤患者外周血中肿瘤细胞的水平是一种敏感而又特异的无创伤方法。Survivin作为新的凋亡抑制蛋白,对胃癌的发生、发展的影响重大。采用实时荧光定量RT-PCR法检测胃癌外周血中Survivin mRNA表达水平,对胃癌复发、转移的检测和预后判断具有一定价值。
[1] Ambrosini G, Adida C, Altieri DC.A novel anti-apoptosis gene, Survivin, expressed in cancer and lymphoma[J].Nature Med, 1997, 3(8): 917-921.
[2] Tamm I, Wang Y, Sausville E, et al.IAP-family protein Survivin inhibits caspase activity and apoptosis induced by Fas(CD95), Bax, caspases, and anticancerdrugs[J].Cancer Res, 1998, 58(23): 5315-5320.
[3] Liang QL, Wang BR, Li GH.DcR3 and survivin are highly expressed in colorectal carcinoma and closely correlated to its clinicopathologic parameters[J].J Zhejiang Univ Sci B,2009, 10(9): 675-682.
[4] Bertazza L, Mocellin S, Marchet A, et al.Survivin gene levels in the peripheral blood of patients with gastric cancer independently predict survival[J].J Transl Med, 2009, 22,7: 111.
[5] Hoffmann AC, Vallböhmer D, Grimminger P, et al.Preoperative survivin mRNA detection in peripheral blood is an independent predictor of outcome in esophageal carcinoma[J].Pharmacogenomics, 2010, 11(3): 341-347.
[6] Krepela E, Dankova P, Moravcikova E, et al.Increased expression of inhibitor of apoptosis proteins, survivin and XIAP, in non-small cell lung carcinoma[J].Int J Oncol,2009, 35(6): 1449-1462.
[7] Meng H, Lu C, Mabuchi H, et al.Prognostic significance and different properties of Survivin splicing variants in gastric cancer[J].Cancer Lett, 2004, 216(2): 147-155.
[8] 姚学权, 刘福坤, 祁晓萍,等.胃腺癌组织survivin基因的表达与细胞增殖及凋亡的相关性研究[J].中华外科杂志, 2004, 42(3): 145-148.
[9] Song KY, Jung CK, Park WS, et al.Expression of the antiapoptosis gene Survivin predicts poor prognosis of stage Ⅲgastric adenocarcinoma[J].Jpn J Clin Oncol, 2009, 39(5):290-296.
[10] Yie SM, Lou B, Ye SR, et al.Detection of survivin-expressing circulating cancer cells (CCCs) in peripheral blood of patients with gastric and colorectal cancer reveals high risks of relapse[J].Ann Surg Oncol, 2008, 15(11): 3073-3082.
