肺癌组织CD31、CD34及CD105标记的微血管密度的临床意义
2010-09-20程继荣徐虓王淑琴祖木热提穆沙江
程继荣 徐虓 王淑琴 祖木热提·穆沙江
新疆医科大学第五附属医院肿瘤中心,新疆 乌鲁木齐 830011
肿瘤的生长与转移依赖于肿瘤新生血管形成[1],肿瘤组织的微血管密度(microvessel density,MVD)不仅可定量地反映肿瘤血管生长情况,还能预示肿瘤生长、转移和复发趋势[2]。不同微血管标记物在肺癌组织中的表达情况报道不一致,本研究采用免疫组织化学方法检测3种微血管标记物即CD31、CD34及CD105在65例肺癌组织和30例癌旁组织的表达,比较它们标记的MVD的差异及其与临床指标之间的关系,以寻找较合适的肺癌组织微血管标记物。
1 资料和方法
1.1 研究对象及标本来源 收集我院1995年1月—2003年12月因肺癌行手术切除的原发性肺癌患者65例,其中男性58例,女性7例,年龄38~77岁,平均年龄(62.5±5.3)岁,所有病例术前均未接受放疗或化疗。组织类型:鳞癌34例,腺癌14例,细支气管肺泡癌17例。分化程度:高分化23例,中分化18例,低分化24例。有淋巴结转移40例,无淋巴结转移25例。TNM分期:Ⅰ期23例,Ⅱ期20例,Ⅲ期22例。对照组为30例癌旁组织。所有标本用10%中性甲醛溶液固定4~8 h,然后常规石蜡包埋,切片厚3 μm。
1.2 试剂 鼠抗人CD31单克隆抗体购自美国Millipore公司,鼠抗人CD34单克隆抗体、鼠抗人CD105单克隆抗体及免疫组化SABC试剂盒均购自北京中杉金桥公司。
1.3 CD31、CD34及CD105免疫组化染色 免疫组化染色步骤按说明书进行。CD31工作液浓度为1∶100,CD34和CD105均为即用型抗体。PBS代替一抗作阴性对照,阳性对照为已知阳性的乳腺癌组织。
1.4 结果判断 CD31、CD34及CD105的阳性染色均为棕(黄)色,均在血管内皮细胞胞质中表达,MVD计数法参照Weidner校正方法[3]。任何被抗体染色的单个内皮细胞或细胞团,不管是否形成管腔,只要与周围的微血管、肿瘤细胞和其他连接组织有清楚界限,都认为是一个可计数的微血管。肿瘤内硬化区及肿瘤交界处软组织内的微血管不计数,有平滑肌壁及管腔直径大于8个红细胞直径的血管也排除在外。每一个标本先低倍镜(×10)下选3个微血管数最多的区域即“热点”,在每一个区域中计数一个高倍镜(×40)下的微血管数,取其平均值为MVD值。
1.5 统计处理 用SPSS 12.0软件包进行统计学分析,各组数据以±s 表示,进行t检验或单因素方差分析,相关分析采用Spearman等级相关,检验水准α=0.05。
2 结 果
2.1 CD31、CD34及CD105的表达 CD34和CD105在肺癌及癌旁组织均有表达,肺癌组织CD34表达丰富,标记的血管数量多、血管结构大多数较完整,可呈圆形、类圆形、长条形等;CD105标记的血管稀疏,血管结构不甚完整,管腔不规则,甚至呈条索状或点状。CD31在肺癌及癌旁组织均不表达(图1~3)。
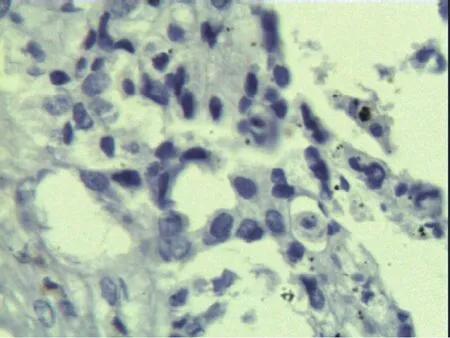
图1 CD31在肺癌组织的阴性表达Fig.1 Negative expression of CD31 in tissue of lung cancer(IHC, ×400)
2.2 CD34-MVD及CD105-MVD的比较 肺癌组织(n=65)的CD34-MVD和CD105-MVD均高于癌旁组织(n=30),分别为24.5±6.5 vs 9.6±5.2和8.2±3.0 vs 2.1±0.9(t分别为10.89和10.88,P均<0.05)。肺癌组织CD34-MVD(24.5±6.5)高于CD105-MVD(8.2±3.0),差异有统计学意义(t=18.19,P<0.05)。因CD31无表达,故在后续的结果中不再记录及分析CD31-MVD。

图2 CD34在肺癌组织的表达Fig.2 Positive expression of CD34 in tissue of lung cancer(IHC, ×400)
2.3 CD34-MVD及CD105-MVD与临床指标的关系 CD34-MVD及CD105-MVD在肿瘤大小、不同组织学类型、不同分化程度之间的差别均无统计学意义(P>0.05);它们均随TNM分期的逐渐增高而升高(F值分别为17.07和9.85,P均<0.05)。有淋巴结转移组CD34-MVD及CD105-MVD高于无淋巴结转移组(t值分别为4.57和4.70,P均<0.05)(表1)。相关分析结果显示,CD34-MVD及CD105-MVD与TNM分期的相关系数分别为0.32和0.54,与淋巴结转移的相关系数分别为0.30和0.58。

图3 CD105在肺癌组织的表达Fig.3 Positive expression of CD105 in tissue of lung cancer(IHC, ×400)
3 讨 论
大量实验证据支持MVD可作为乳腺癌、结肠癌、非小细胞肺癌等多种肿瘤生物学行为的重要指标,与淋巴结转移、远处转移、分化程度及分期有关[4-6]。本试验选择CD31,CD34和CD105标记肺癌组织微血管,发现CD31在肺癌及癌旁组织无表达,而CD34和CD105在肺癌及癌旁组织均有表达。
CD31即血小板内皮细胞黏附分子(又称PECAM-1),被认为参与介导肿瘤细胞黏附于内皮细胞。当肿瘤细胞与血小板结合后,血小板可通过CD31与内皮细胞的连接来促使肿瘤细胞对内皮细胞的接触,稳定肿瘤细胞对内皮细胞的黏附[7]。本试验显示肺癌及癌旁组织CD31表达阴性,由此推测由血小板介导的肿瘤细胞黏附作用在肺癌的发生、发展中作用较小,或由于CD31在肺癌组织中表达不稳定所致,也可能由实验误差引起。Wang等[8]用CD31和CD105单抗对乳腺癌组织作免疫组化染色时发现,肿瘤组织内的血管与CD105反应十分强烈,而CD31却仅有微弱表达甚至不表达。但国内有关于CD31表达强度随肺癌TNM分期增高而增高[9]及与淋巴结转移有关[10]的报道。
表1 65例肺癌组织CD34-MVD及CD105- MVD与临床指标的关系Tab.1 Relationship between CD34-MVD/CD105-MVD and clinical indices in lung cancer tissue(±s)
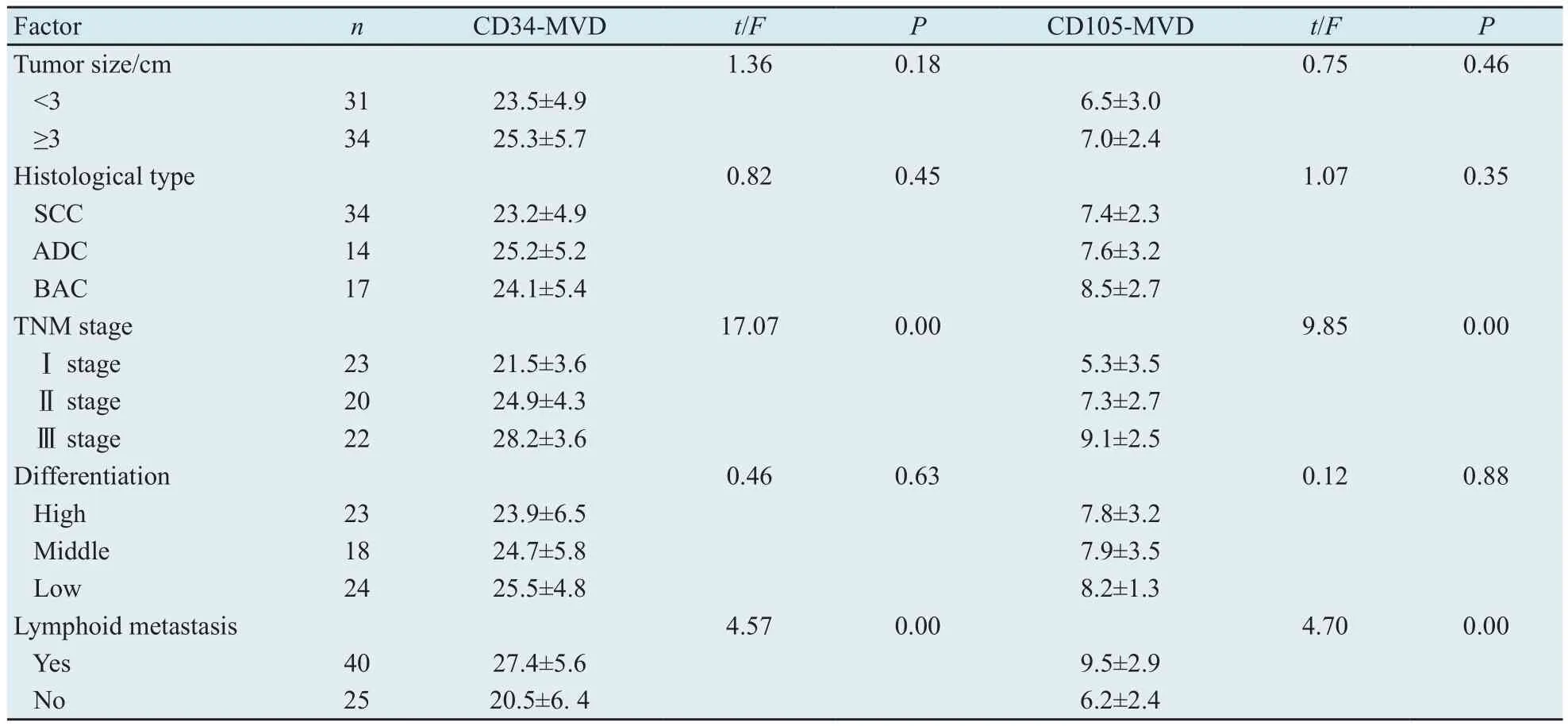
表1 65例肺癌组织CD34-MVD及CD105- MVD与临床指标的关系Tab.1 Relationship between CD34-MVD/CD105-MVD and clinical indices in lung cancer tissue(±s)
SCC: Squamous cell carcinoma; ADC: Adenocarcinoma; BAC: Bronchialalveolar carcinoma.
Factor n CD34-MVD t/F P CD105-MVD t/F P Tumor size/cm 1.36 0.18 0.75 0.46<3 31 23.5±4.9 6.5±3.0≥3 34 25.3±5.7 7.0±2.4 Histological type 0.82 0.45 1.07 0.35 SCC 34 23.2±4.9 7.4±2.3 ADC 14 25.2±5.2 7.6±3.2 BAC 17 24.1±5.4 8.5±2.7 TNM stage 17.07 0.00 9.85 0.00Ⅰ stage 23 21.5±3.6 5.3±3.5Ⅱ stage 20 24.9±4.3 7.3±2.7Ⅲ stage 22 28.2±3.6 9.1±2.5 Differentiation 0.46 0.63 0.12 0.88 High 23 23.9±6.5 7.8±3.2 Middle 18 24.7±5.8 7.9±3.5 Low 24 25.5±4.8 8.2±1.3 Lymphoid metastasis 4.57 0.00 4.70 0.00 Yes 40 27.4±5.6 9.5±2.9 No 25 20.5±6.4 6.2±2.4
CD34是泛血管内皮标记物之一,应用广泛,被认为是重复性好、稳定性高、较成熟的血管内皮标记物,作为常规指标应用于多种恶性肿瘤的免疫组化检测。CD105是一种新生血管内皮细胞标记物,仅在处于增殖状态的新生血管内皮细胞中强表达[11],如肿瘤组织、愈合中的伤口、胚胎组织等,而在正常组织的血管中则很少表达。本试验研究结果显示肺癌组织CD34-MVD和CD105-MVD高于癌旁组织,且CD34-MVD高于CD105-MVD,说明肺癌组织的血管供应比癌旁组织丰富,且用CD34比用CD105标记肿瘤血管更敏感。本试验还显示CD34-MVD和CD105-MVD随TNM分期进展而增高,有淋巴结转移组CD34-MVD及CD105-MVD高于无淋巴结转移组,说明TNM分期、局部淋巴结转移与肿瘤组织的血供关系密切,符合肿瘤生长与转移依赖于肿瘤新生血管形成的学说[1]。相关分析显示CD34-MVD及CD105-MVD与TNM分期、淋巴结转移呈正相关,且CD105的相关系数大于CD34,提示CD105与TNM分期和淋巴结转移的关系更密切。关于CD105与肿瘤分期、淋巴结转移及预后密切相关的证据已有大量实验证实。
综上所述,CD34和CD105都可作为肺癌微血管标记物,CD34比CD105敏感,但CD105与TNM分期和淋巴结转移的关系更密切,而CD31不适合作为肺癌微血管标记物。
[1] Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[2] Cox G,Walker RA,Andi A,et al.Prognostic significance of platelet and microvessel counts in operable non-small cell lung cancer[J].Lung cancer,2000,29(3):169-177.
[3] Weidner N,Folkman J,Pozza F,et al.Tumor angiogenesis:a new significant and independent prognostic indicator in early-stage breast carcinoma[J].J Natl Cancer Inst,1992,84(24):1875-1887.
[4] Tsutsui S,Matsuyama A, Yamamoto M,et al.The Akt expression correlates with the VEGF-A and -C expression as well as the microvessel and lymphatic vessel density in breast cancer[J].Oncol Rep,2010,23(3):621-630.
[5] Gulubova M,Vlaykova T.Prognostic significance of mast cell number and microvascular density for the survival of patients with primary colorectal cancer[J].J Gastroenterol Hepatol,2009,24(7):1265-1275.
[6] Kreuter M, Kropff M,Fischaleck A,et al.Prognostic relevance of angiogenesis in stage Ⅲ NSCLC receiving multimodality treatment[J].Eur Respir J,2009,33(6)1383-1388.
[7] 张培彤,裴迎霞,朴炳奎,等.肿瘤患者与正常人血小板表面粘附蛋白表达异同的临床观察及意义[J].中华肿瘤杂志,1998,20(3):207-209.
[8] Wang JM,Kumar S,Pye D,et al.Breast carcinoma: comparative study of tumor vasculature using two endothelial cell markers[J].J Natl Cancer Inst,1994,86(5):386-388.
[9] 郑玲,王晓毓,张鸿彬,等.肺癌患者血小板粘附分子CD31和CD62的检测[J].中国肿瘤临床,2003,30(8):596-597.
[10] 熊正文,徐昌富,李宏伟,等.非小细胞肺癌中血管内皮标记物显示微血管密度的对比研究[J].中华胸心血管外科杂志,2003,19(4):223-225.
[11] Akagi K,Ikeda Y,Sumiyoshi Y,et al.Estimation of angiogenesis with anti-CD105 immunostaining in the process of colorectal cancer development[J].Surgery,2002,131(1 Suppl):109-113.
