SAHA与顺铂联用对口腔鳞癌细胞生长抑制作用的研究
2010-09-20申俊顾亚军柏景坪
申俊 顾亚军# 柏景坪
1.杭州口腔医院黏膜科,#颌面外科,浙江 杭州 310006;2.首都医科大学黏膜科,北京 100069
以顺铂为代表的铂类化合物由于其显著的抗瘤效应,是治疗口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)最常用的一类化疗药物。为克服临床上越来越多的患者对顺铂产生的耐药性及减轻由于用药剂量所导致的不良反应,以顺铂为核心的联合用药方案成为目前口腔肿瘤防治领域的研究热点和难点[1-2]。辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA )是目前最具有代表性的组蛋白去乙酰化酶抑制剂之一,作为一类新兴的抗肿瘤药物,具有低毒高效的特点[3]。同时,许多研究发现SAHA除自身具有抗瘤活性外,还与一些传统的化疗药物展现出良好的协同治疗效果[4]。因此本研究尝试将SAHA与顺铂联用,初步探讨两者联合治疗口腔鳞癌治疗的可能性。
1 材料和方法
1.1 细胞株 口腔鳞癌细胞株Tca8113及KB购自四川大学卫生部移植工程和移植免疫重点实验室。
1.2 药物及试剂 SAHA购自Alexis公司,用DMSO配置成10 mmol/L储存液,-20 ℃保存。顺铂购自辽宁锦泰药业公司,用生理盐水配置成1 mg/mL储存液,-4 ℃保存。MTS试剂购自Promega公司。抗乙酰化组蛋白H3抗体购自Upstate公司。
1.3 药物处理 分别以不同浓度的SAHA(0.5、1、2、4、8、10 μmol/L)及顺铂(2、4、6、8、10 μg/mL)分别处理Tca8113及KB细胞,作用24 h后,换用含10%FBS的DMEM培养基继续培养24 h,进行MTS检测。其后,根据细胞对单独使用这2种药物的剂量反应,选择将低剂量的2种药物进行联合应用,SAHA(2 μmol/L)与顺铂(4 μg/mL)先后或同时处理细胞4 h后,换用含10%FBS的DMEM培养基继续培养24 h,进行细胞毒性(MTS及克隆形成实验)检测。
1.4 组蛋白的提取及其乙酰化水平的检测经药物处理后,以组蛋白裂解液裂解细胞,提取核内组蛋白,用Western blot法分别检测2种口腔鳞癌细胞在经过SAHA处理前后其组蛋白乙酰化水平的变化,以未经过药物处理的细胞作为空白对照,曝光显色后用凝胶成像扫描分析仪扫描蛋白条带。等量提取的组蛋白条带通过考马斯兰亮染色显示于12%的SDS-PAGE胶上。
1.5 细胞毒性检测(MTS法) 收集生长良好的Tca8113及KB细胞,制成单细胞悬液后调节细胞密度,以1×104个/孔接种于96孔板,待其融合度达到60%左右加入不同浓度的药物,每组每浓度设立3个平行孔,调节每孔液体量为100 μL。药物处理结束后,每孔加入MTS 20 μL,37 ℃,CO2体积分数为5%的环境下温育1 h,测590 nm波长的吸光度(A),细胞存活率=A药物组平均/A对照组平均×100%。
1.6 细胞毒性检测(克隆形成实验) 收集生长良好的Tca8113及KB细胞,制成单细胞悬液后调节细胞密度,以3×102个/板的密度接种于平板之中(平板直径为60 mm)。待细胞生长稳定后,加入药物进行处理。在药物处理结束后,换用含10%FBS的DMEM培养基继续培养细胞5~7 d,纯甲醇固定细胞,以Giemsa染色计数细胞集落,集落形成率=集落形成数目/接种细胞数×100%。
1.7 统计处理 所得数据均用SPSS 11.0软件包进行统计分析。各组均数的比较采用单因素方差分析及两两比较法,以P<0.05为差异具有统计学意义,P<0.01为差异具有显著统计学意义。
2 结 果
2.1 2种口腔鳞癌细胞都对SAHA及顺铂呈现出较好的敏感性 单独使用SAHA或顺铂处理细胞,2种口腔鳞癌细胞都呈现出较好的剂量与效应关系。由于目前尚未有SAHA单独作用于口腔鳞癌细胞的有关报道,本实验中,在进行药物的联合应用前,我们首先检测了该药物单独使用对细胞的毒性作用。结果显示,随着用药剂量的增加,特别在4 μmol/L浓度之上,随SAHA浓度的加大,2种细胞的生长相应都受到了显著的抑制,说明口腔鳞癌细胞对SAHA具有敏感性(图1)。此外,我们还观察了单独使用顺铂对2株口腔鳞癌细胞生长增殖的影响,结果发现,本实验中所使用的2种细胞都对顺铂具有较好的敏感性,药物毒性作用的增强与使用的药物剂量的增加相一致(图2)。

图1 不同剂量的SAHA单独作用于口腔鳞癌细胞对其生长增殖的影响Fig.1 The effect of various concentrations of SAHA on the proliferation ability of OSCC cell lines
2.2 经由SAHA处理后,2种细胞内组蛋白乙酰化的水平迅速提高 本实验中,我们尝试采用低剂量的SAHA处理细胞4 h,然后提取细胞核内的组蛋白,检测其乙酰化的表达水平,结果发现,与未加药物处理的对照组相比,低剂量的SAHA短时间内即可导致组蛋白乙酰化水平显著提高,顺铂的同时加入,对该组蛋白乙酰化水平未产生明显的影响(图3)。
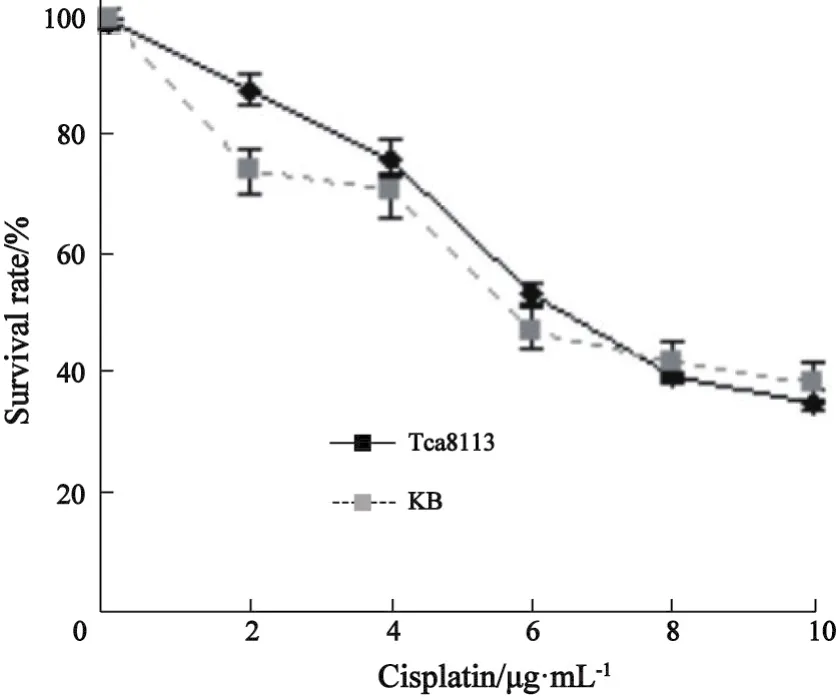
图2 不同剂量的顺铂单独作用于口腔鳞癌细胞对其生长增殖的影响Fig.2 The effect of various concentrations of Cisplatin on the proliferation ability of OSCC cell lines
2.3 低剂量的SAHA和顺铂联合应用能显著增强对口腔鳞癌细胞的毒性作用 在进一步有关联合用药的研究中,我们选择了低剂量的SAHA(2 μmol/L)及顺铂(4 μg/mL)联合使用来处理细胞。MTS结果发现,Tca8113细胞各组间及KB细胞各组间差异具有显著统计学意义(F=136.254,P<0.01;F=134.794,P<0.01)。2 μmol/L的SAHA处理口腔鳞癌细胞4 h时,对大部分细胞的生长增殖未产生明显的影响(图4);与之相对照,再联合了低剂量的顺铂以后,药物的细胞毒性得到了显著增强,大部分细胞生长受到了抑制(图4),不同细胞2个联合用药组分别与单独使用顺铂组比较,差异均具有显著的统计学意义(P<0.01)。不同细胞2个联合用药组分别与单独使用SAHA组相比较,差异均具有显著的统计学意义(P<0.01)。在联合用药中,我们还尝试了不同的用药方式,即先后和同时给药。结果发现,这2种用药方式都具有较好的协同作用(图4),2种用药方式相比较,差异无统计学意义(P>0.05)。为进一步验证联合2种药物的使用对口腔鳞癌细胞的毒性作用,我们还同时应用了克隆形成实验,结果发现Tca8113细胞各组间及KB细胞各组间差异具有统计学意义(F=124.377,P<0.01;F=123.296,P<0.01)。当2种低剂量的药物联合应用后,细胞所形成的集落数明显减少,不同细胞联合用药组集落形成率与单独使用顺铂组相比较,差异均具有显著的统计学意义(P<0.01),不同细胞联合用药组与单独使用SAHA组相比较,差异均具有显著的统计学意义(P<0.01) (表1)。

图3 Western blot检测细胞核内组蛋白乙酰化水平的变化Fig.3 Examination of acetylated histone after drug treatment by Western blot

图4 单独及联合应用低剂量的SAHA和顺铂对口腔鳞癌细胞的毒性比较Fig.4 The comparison of cytotoxicity in OSCC cell lines of either treatment of subtoxic SAHA and Cisplatin alone,or the combinative treatment of both drugs
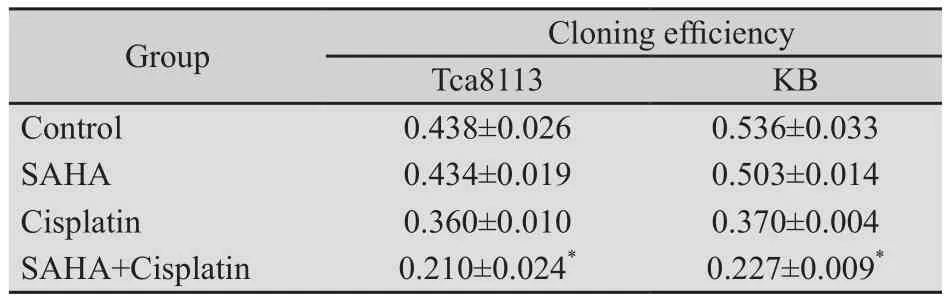
表1 克隆形成实验检测SAHA和顺铂单独或联合处理细胞后对细胞远期增殖影响Tab.1 Long-time OSCC cancer cell survival examined by colony formation assay
3 讨 论
顺铂作为美国FDA 批准上市的第一个铂配合物抗癌药,由于其良好的抗癌效应和经济效应,目前已成为临床上治疗口腔鳞癌最常用的药物之一。该药物可以通过与DNA形成交叉联结,抑制DNA的复制过程,发挥细胞毒性作用。但是,随着顺铂在临床上的广泛应用,一方面,越来越多的患者对顺铂出现了耐药现象,另一方面,在以顺铂为核心的联合化疗方案中,由其用药剂量所导致的不良反应仍然不可避免[1]。这两方面的突出问题严重限制了该类药物的使用,同时也促使学者不断地寻找新的低毒高效的化疗方案。SAHA是最具代表性的组蛋白去乙酰化酶抑制剂之一,该类药物的研发是基于有关组蛋白乙酰化的异常状态与染色质重塑与肿瘤关系的研究。SAHA能通过组蛋白的乙酰化使染色质重塑为促进基因转录的疏松结构,重新激活肿瘤细胞中由于异常的组蛋白去乙酰化而表达受阻的基因,诱导肿瘤细胞凋亡[3]。虽然顺铂和SAHA作用的靶向不同,由于在肿瘤发生、发展的过程中,DNA和染色质的变化往往作为一个整体紧密联系在一起,提示我们:顺铂和SAHA的联用有可能通过DNA和染色质的桥梁作用发挥更强的抗瘤效果。因此在本实验中,我们选择在口腔鳞癌的治疗领域将SAHA与低剂量顺铂进行联合应用,以期达到减毒增效的目的。
本实验在联合用药的剂量上,最终只选择了低剂量SAHA与顺铂进行配伍组合,这是基于2个方面的考虑:一方面,单独使用顺铂对2种口腔鳞癌细胞都具有很好的敏感性,因此,在尚未建立对顺铂耐药的口腔鳞癌细胞株的情况下,为了尽量减少这种配伍组合的毒副作用,我们仅选择了低剂量顺铂进行联用,同时,SAHA作为一类新的抗肿瘤药物,与传统的化疗药物相比,目前价格仍较为昂贵,从经济的角度出发,在保证减毒增效的前提下,我们也希望能尽量采用低剂量的SAHA来发挥增效的作用;另一方面,我们对SAHA处理后细胞组蛋白内的乙酰化水平进行了检测,证实了低剂量的SAHA即可迅速导致组蛋白乙酰化水平的增高。组蛋白乙酰化的水平与染色质的重塑存在着直接的关系,高乙酰化的组蛋白通过瓦解氨基酸末端的二级机构并中和组蛋白所带的正电荷,以及疏水的乙酰基团产生的空间阻力,可降低组蛋白与DNA的亲和力,使核小体松解,染色质变得疏松[3]。国外有学者曾报道,低剂量的SAHA处理细胞4 h以内就能够引起组蛋白的乙酰化水平的提高,导致染色质构型的松散,但同时不伴有基因组的不稳定或凋亡的诱导现象[5],我们在口腔鳞癌细胞中首次证实了该结论。综合考虑上述2方面的原因,我们尝试了低剂量的SAHA与顺铂联合用药,结果发现亚毒剂量的SAHA与顺铂进行联合应用,在抑制肿瘤细胞生长方面能取得显著的协同作用。我们推测其原因可能是由于:低剂量的SAHA短时间内虽然不能导致明显的杀细胞作用,但是可迅速引起组蛋白乙酰化水平提高,使染色质的结构变得疏松,后者可导致染色质上的DNA得到充分的暴露,有效促进顺铂与DNA的交联作用,从而增强顺铂的杀伤细胞作用。
本研究同时选择采用MTS法及克隆形成实验对联合用药的细胞毒性进行检测。相对于其他检测方法,克隆形成实验所耗费的周期较长,但是由于克隆形成实验直接反应了肿瘤细胞的远期增殖能力,弥补了MTS等即时检验的不足[6],因此我们同时采用了克隆形成实验进一步验证MTS检测结果。上述2种检测方法互为补充,也使我们的实验结果更具有说服力。
综上,通过初步的体外实验,我们发现SAHA能增加口腔鳞癌细胞对传统化疗药物顺铂的敏感性,值得我们进行进一步的研究。
[1] Caponigro F, Rosati G, De Rosa P, et al.Cisplatin, raltitrexed,levofolinic acid and 5-fluorouracil in locally advanced or metastatic squamous cell carcinoma of the head and neck: a phase Ⅱ randomized study [J].Oncology, 2002, 63(3):232-238.
[2] Gedlicka C, Formanek M, Selzer E, et al.Phase Ⅱ study with docetaxel and Cisplatin in the treatment of recurrent and/or metastatic squamous cell carcinoma of the head and neck[J].Oncology, 2002, 63(2): 145-150.
[3] Kelly WK, Marks PA.Drug insight: Histone deacetylase inhibitors-development of the new targeted anticancer agent suberoylanilide hydroxamic acid [J].Nat Clin Pract Oncol,2005, 2(3):150-157.
[4] Whang YM, Choi EJ, Seo JH, et al.Hyperacetylation enhances the growth-inhibitory effect of all-trans retinoic acid by the restoration of retinoic acid receptor beta expression in head and neck squamous carcinoma (HNSCC) cells [J].Cancer Chemother Pharmacol, 2005, 56(5): 543-555.
[5] Zhu WG, Lakshmanan RR, Beal MD, et al.DNA methyltransferase inhibition enhances apoptosis induced by histone deacetylase inhibitors [J].Cancer Res, 2001,61(4):1327-1333.
[6] Franken NA, Rodemond HM, Stap J, et al.Clonogenic assay of cells in vitro [J].Nat Protoc, 2006, 1(5): 2315-2319.
