Ikaros抑制垂体瘤生长激素基因表达的机制
2010-09-20于顺江陈力陈怡东王京
于顺江 陈力 陈怡东 王京
北京世纪坛医院(暨北京大学第九临床医学院)肿瘤放疗科,*病理科,北京 100038
垂体瘤是一种常见的神经内分泌肿瘤。其中,功能性垂体腺瘤约占70%,临床表现为垂体生长激素(growth hormone,GH)、泌乳素(prolactin,PRL)以及促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)等激素过度分泌所导致的多种内分泌失调如身体发育异常、不孕不育及严重心血管疾病等。目前垂体瘤的发生机制仍不清楚。在垂体组织中,已鉴别出几个公认的转录调节蛋白在激素分泌调节过程中起至关重要的作用[1-2]。本研究旨在探讨Ikaros(Ik-1)调节GH分泌的作用机制,为功能性垂体腺瘤今后的临床靶向治疗提供重要的参考依据。
1 材料和方法
1.1 细胞培养 鼠垂体GH4细胞株购于美国ATCC生物制品公司(Manassas,VA)。GH4细胞常规培养于含100 U/mL青霉素,100 μg/mL链霉素,2 mmol/L 谷氨酰胺和含10%胎牛血清的DMEM(Life Technologies)培养液中,在37 ℃、CO2体积分数为5%的培养箱中进行培养,常规8~10代传代培养后细胞处于良好的指数生长状态,然后接种于直径100 mm培养皿中贴壁生长,取指数生长期细胞进行实验。稳定转染Ik-1或其蛋白同型Ik-6的细胞克隆株以G418进行维持培养。
1.2 总RNA提取和Northern blot分析 用TRIzol kit(Life Technologies)提取GH4细胞总RNA,提取步骤参照厂家产品说明书,总RNA提取后测定浓度并储存于-70 ℃冰箱保存备用。进行实验时,每个样本取2.5 μg RNA装载于1%甲醛-琼脂糖胶中进行电泳,电泳完成后将RNA转移至尼龙膜,以32P-dCTP (Roche Diagnostics标记盒) 随机标记的探针(鼠GH的cDNA片段长为706 bp)进行杂交,以3-磷酸甘油醛脱氢酶(GAPDH)(687 bp)cDNA标记的探针作为内对照。
1.3 蛋白质印迹法(Western blot)分析 以冷PBS 1×冲洗GH4细胞2次,然后向细胞中加入溶解液(5%N P-4 0、1%SDS、20 mmol/L Tris.Cl、1 mmol/L DTT、1 mm ol/L E DTA、100 m mo l/L NaCl、1 mmol/L PMSF、10 mmol/L NaF、0.1 mmol/L Na Orth和5 μg/mL Aprotinin)冰上溶解5 min,采用室内台式离心机(半径100 mm)以1 500 r/min离心10 min后留上清液,用Bio-Rad法测定蛋白浓度,将蛋白置于-70 ℃备用。进行Western blot实验时,分别取50 μg蛋白先沸水煮沸5 min,然后将各样本装载于12% SDS-PAGE胶中进行电泳,电泳完毕后进行转膜(Millipore),以5%脱脂牛奶封闭,以抗rGH(1∶50 000)抗体进行孵化,置于4 ℃摇动过夜。次日以0.05%PBS-Tween-20常温洗膜10 min×3次,然后加入二抗(辣根过氧化物酶标记,羊抗鼠,1∶2 000)室温摇动1 h,以ECL化学发光法进行底物反应和胶片曝光,以ß-Actin抗体(1∶1 000) 对装载的样品量进行校正(内对照)。
1.4 质粒构建和细胞转染 Ik-1和Ik-6表达质粒及其空白对照质粒PcDNA3.1由美国哈佛大学皮肤生物学研究中心的Dr.K.Georgopoulos教授惠赠[1]。含有全部7个外显子(Exon 1~7)的人全长Ik-1基因cDNA(1 570 bp,Ik-1)以及剔除外显子Exon 3~6的人Ik-1基因cDNA(truncated isoform, 902 bp,Ik-6)分别被克隆至pcDNA3.1载体上。值得一提的是,Ik-6蛋白功能上不具有与靶基因DNA结合的能力。Pit-1全长cDNA的表达载体及其空白对照质粒pcDNA3.1由加拿大多伦多大学总医院Dr.H.Elsholtz教授惠赠。上述所有表达载体的目的基因核酸序列和方向均经限切酶和DNA测序证实。转染前,均以QiaGen Maxi-Prep试剂盒提取DNA,并进行纯化。以Lipofectamine法对GH4细胞进行转染,以G418进行稳定克隆筛选。GH启动子活动则由含有鼠的320 bp GH近端启动子片段的pSV2A-rGH-luc 测定。转染细胞前,利用TRANSFAC Version 4.0数据库对GH基因启动子DNA序列进行分析。采用Lipofactamine法进行瞬时转染,然后进行荧光素酶(Luciferase)发光实验。为了校正转染效率偏差,每次以20 ng/孔的pSV-半乳糖苷对照质粒对转染进行校正。细胞瞬时转染48 h后,以裂解液(25 mmol/L glycylglycine、15 mmol/L MgSO4、4 mmol/L EGTA、1% Triton X、1 mmol/L DTT)溶解细胞,以荧光素酶发光检测仪对Luciferase活动进行20~30 s读数。为了观察Ik-1对染色质去乙酰化作用的影响,以Trichostatin-A(200 ng/mL)处理细胞16 h,然后评价Ik-1对GH启动子活动的影响,每个试验至少重复3次。
1.5 免疫组化分析 稳定转染Ik-1、Ik-6或其空白对照质粒的GH4细胞经过传代培养后,将细胞(1×106个)注入SCID鼠的腹部皮下,观察其生长。2周后,处死小鼠取生长的瘤组织进行免疫组化分析。标本用4%的甲醛固定、石蜡包埋,切成6 μm厚后每片滴加100 μL的一抗,4 ℃过夜,加100 μL聚合物增强剂,室温温育20 min,PBS冲洗3次,每次3 min,然后滴加200 μL酶标抗兔复合物,室温温育30 min,PBS冲洗3次,滴加DAB显色液显微镜下观察。
1.6 染色质组蛋白免疫共沉淀试验(ChIP assay) 以5’-端的rGH启动子(距转录初始位320 bp的DNA序列片段)构建成pSV2A-rGH-luc报告质粒,然后在稳定转染Ik-1或Ik-6的GH4细胞中进行瞬时转染。根据NY Upstate生物技术公司提供的ChIP-PCR实验指南进行实验。在培养的GH4细胞中加入37%的甲醛培养10 min以使细胞核中的组蛋白与DNA充分交联,然后用冷PBS冲洗细胞2次,收集细胞,以超声降解法将细胞核中的DNA剪切至200~1 000 bp大小,然后以台式离心机(半径100 mm)对上述细胞剪切物进行3 000 r/min离心10 min,然后进一步稀释,每个样品预先取20 μL用于估算DNA样本量(input DNA)。剩余溶解物则以鲑鱼精液DNA/蛋白G-琼脂珠进行纯化,然后取一半纯化液与抗乙酰化的组蛋白-3(AcH3)或抗Pit-1抗体进行孵化,并与蛋白G-琼脂糖珠充分混合,4 ℃摇动过夜,以抗乙酰化的AcH3抗体或抗Pit-1抗体进行孵化,并行蛋白质印迹或PCR分析,以未加入抗体孵化的共沉淀样本作为阴性对照。若细胞内Ik-1高表达后能导致染色质去乙酰化,则PCR实验时无PCR产物。PCR所采用的引物如下:rGH,正向 (5’-GTGACCATTGCCCATAAACC-3’),反向(5’-TGCATGCCCTTTTTATACCC-3’),分别对应于rGH基因启动子核苷酸序列的1522~1541和1738~1719节段,以320 bp GH启动子片段为PCR模板,以是否产生216 bp的PCR产物来检测GH启动子的(去)乙酰化状态(引物设计详情请参考GeneBank No.X12967)。
1.7 统计处理 应用SPSS 13.0 统计软件分析,计量数据皆以均数±标准差表示,组间数据比较采用t检验,检验水准为α=0.05。
2 结 果
2.1 Ik-1 抑制了GH基因的表达 先前的研究证实了Ik-1可以在垂体前叶组织表达。为了弄清Ik-1在GH基因表达调节中的作用,我们以Ik-1、Ik-6表达质粒或它们的对照质粒PcDNA3.1对GH4细胞进行稳定转染,然后进行Northern blot和蛋白印记分析。结果显示外源性表达的Ik-1抑制了GH基因 mRNA的表达(图1A),同时也证实了Ik-1能抑制GH蛋白的表达(图1B)。为了进一步验证Ik-1对GH基因的调节作用,将稳定转染Ik-1、Ik-6或其空白质粒的GH4细胞注射入SCID鼠皮下,经过2周体内生长,处死鼠取该瘤组织进行免疫组化分析,结果显示外源性Ik-1能够抑制GH的表达,而Ik-6的作用则相反(图1C所示)。为了弄清Ik-1抑制GH表达的分子机制,将稳定转染Ik-1或Ik-6的GH4细胞分别与GH-luc质粒进行瞬时转染(48 h),然后进行荧光素酶发光测定,结果显示Ik-1能够抑制GH启动子的活动,而Ik-6的作用则相反(图2)。
2.2 Ik-1 改变了GH基因启动子所在染色质区域的乙酰化状态 GH基因启动子无Ik-1结合位点,Ik-1与GH启动子不直接结合[2]。为了弄清Ik-1抑制GH基因表达的分子机制,我们采用染色质组蛋白免疫共沉淀(ChIP)和PCR来检测Ik-1是否改变了GH基因启动子染色质区域的乙酰化状态。GH4细胞经过上述转染后,通过ChIP-PCR证实了Ik-1能增强GH基因启动子的染色质组蛋白H3的去乙酰化状态,而Ik-6则诱导了GH 启动子的乙酰化状态(图3A)。而Ik-1的这一作用也因Ik-1削弱了Trichostatin-A对GH启动子所在染色质区域的乙酰化作用而得到进一步证实(图3B)。 因此,ChIP-PCR结果显示Ik-1抑制GH基因表达是经由染色质组蛋白的去乙酰化作用而实现的。
2.3 Ik-1阻碍了垂体因子Pit-1进入染色质与GH基因启动子结合 为进一步澄清Ik-1的去乙酰化作用,我们检测了Ik-1对Pit1与GH启动子结合能力的影响。ChIP-PCR实验证实外源性表达的Ik-1能阻碍Pit1进入染色质与GH启动子结合(图4A)。当转染Ik-1、Ik-6及其对照质粒的GH4细胞和Pit1表达质粒瞬时转染后,通过荧光素酶发光实验证实,Ik-1抑制了GH启动子的活动,而 Ik-6则升高了GH启动子的活动(图4B)。
3 讨 论
Ik-1是一类Kruppel家族锌指蛋白转录因子。研究表明,Ik-1是人淋巴细胞早期发育与分化过程中起关键作用的调节者[3-4],小鼠缺乏Ik-1基因则会导致胸腺和外周淋巴结发育停止以及淋巴祖细胞和成熟B淋巴细胞完全缺乏[5-6]。如果野生型Ik-1基因发生错误剪切,将会产生结构和功能截然不同的8种同工蛋白产物包括Ik-6(结构残缺型,不能和DNA结合),这样的错误剪切将造成淋巴停止发育和白血病的发生[4]。
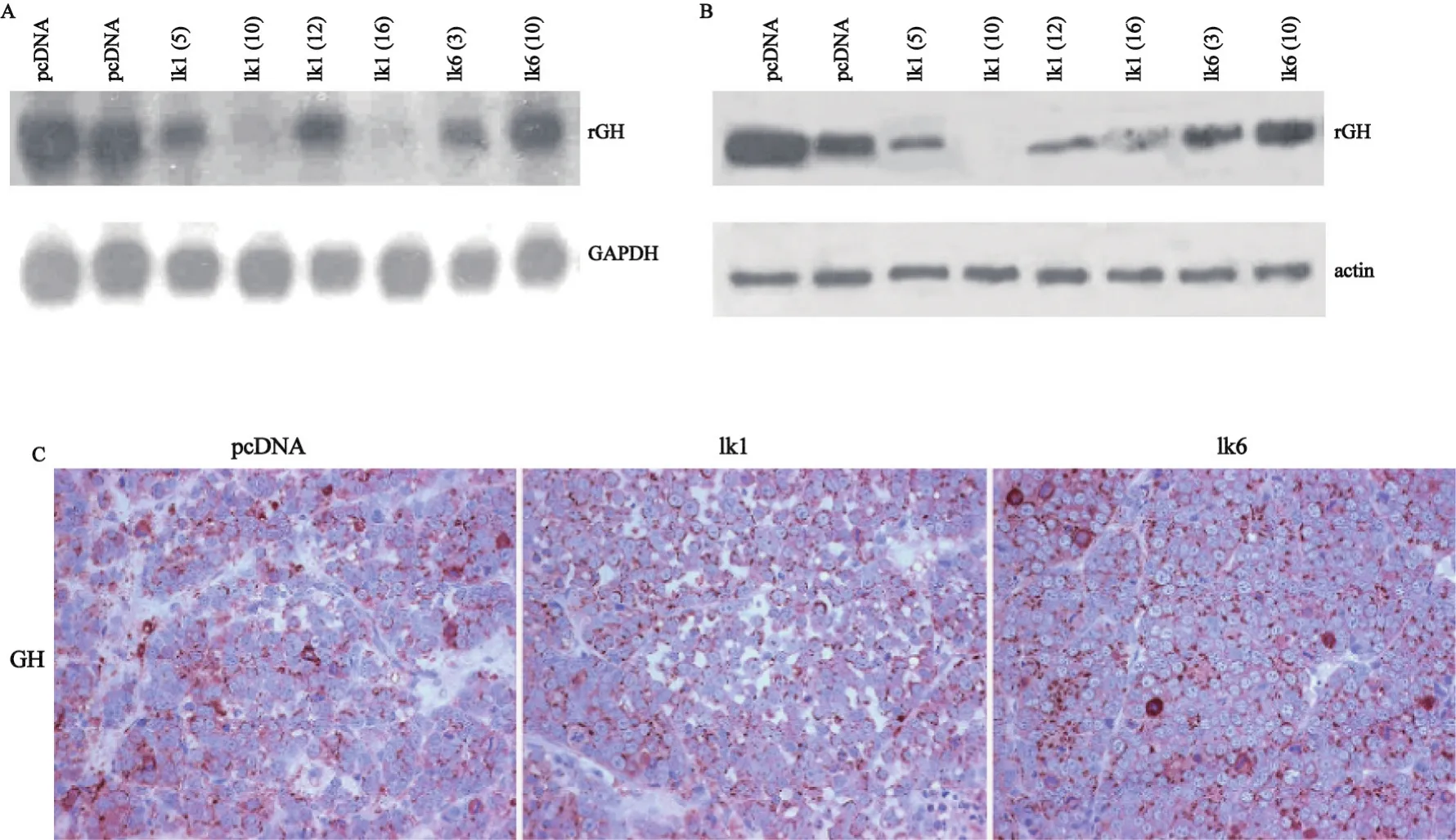
图1 外源性表达的Ik-1抑制了GH4细胞中GH mRNA和蛋白水平的表达Fig.1 Exogenous expressed Ik-1 suppresses the GH gene mRNA and protein expresson in pituitary mammosomatotroph GH4 cells(DAB, ×20)

图2 外源性Ik-1表达抑制了GH4细胞GH启动子的活性Fig.2 Ik-1 confers inhibitory effects on GH promoter activity in GH4 cells
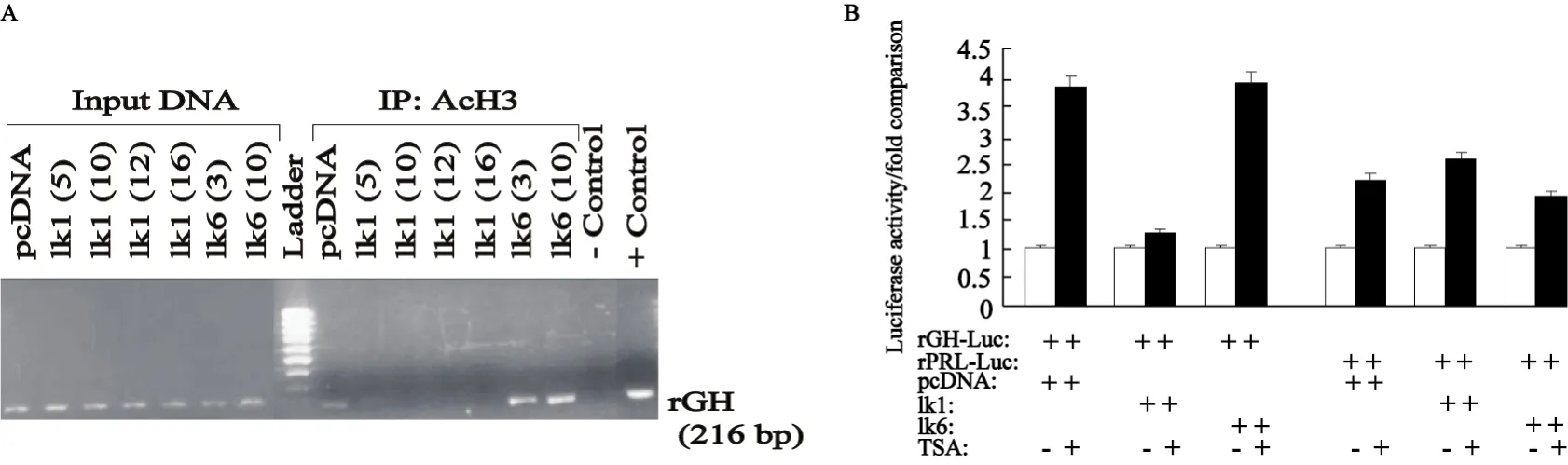
图3 Ik-1改变GH基因启动子所在区域染色质的去乙酰化状态,因而抑制了GH基因的表达Fig.3 Ik-1 inhibits expression of the GH gene by altering chromatin histone acetylation closed to the GH promoter

图4 Ik-1增加了GH基因启动子区域的组蛋白乙酰化状态,从而阻碍了Pit-1进入染色质与GH基因启动子结合Fig.4 The inability of Pit1 to activate the GH promoter, consistent with restricted access to this promoter in the presence of exogenous Ik-1 overexpression
我们先前的研究已证实野生型Ik-1能在垂体前叶组织中表达,且在大约50%的垂体腺瘤患者组织中检测出Ik-6,因此推断垂体肿瘤的形成与进展可能与Ik-1的错误剪切有关[7]。垂体瘤细胞中的Ik-6蛋白功能与野生型Ik-1蛋白功能截然相反。例如当Ik-1、Ik-6分别与FGFR4基因启动子结合时会产生截然不同的染色质修饰作用,因而对一定的靶基因会产生活化或抑制作用[7-8]。在本次研究中,我们观察了Ik-1对GH基因表达的影响,集中探讨Ik-1调节GH基因表达的分子机制。研究证实,Ik-1能够抑制生长激素基因的表达。但是,由于GH基因的启动子调控区缺乏Ik-1结合的特异位点,Ik-1蛋白不能与GH基因启动子直接结合来调节其表达,那么Ik-1是通过什么机制来抑制GH基因的表达?本研究显示,Ik-1在垂体细胞中以特异方式抑制了GH基因的表达,这种抑制完全依赖于Ik-1引起的染色质组蛋白易接近状态(chromatin accessibility)的改变。当外源性Ik-1表达后,导致GH基因启动子所在区域染色质组蛋白的去乙酰化作用增强,Ik-1增强GH基因去乙酰化状态的作用又因其能够抵消TSA引起的乙酰化作用而得到进一步证实。本研究亦提示了Ik-1在垂体细胞中削弱TSA介导的组蛋白乙酰化作用,表明Ik-1的这种调节作用是基于GH独特靶基因而产生的,Ik-1抑制靶基因的表达是基因特异性的[8-9]。事实上,Ik-1是在结构致密的可容纳有限的蛋白调节因子的染色质内与GH靶基因结合的,当染色质处于去乙酰化状态时,DNA与组蛋白在结构上缠绕致密,不利于蛋白调节因子的进入。研究证实垂体因子Pit-1能够上调GH基因的表达,促进生长激素的分泌[10]。由于染色质乙酰化状态的改变使染色质结构重新塑造时,Ik-1能够改变致密缠绕的染色质结构而影响Pit-1的进入,Pit-1活化GH启动子的作用被抑制,故导致GH基因表达受制。这一研究结果将会为今后垂体肿瘤的临床干预治疗提供重要的参考和指导,为临床靶向药物治疗的设计提供新的视野。随着Ik-1作用的深入研究,将不断地启发我们对Ik-1整个家族成员在垂体早期发育、垂体干细胞自我更新以及垂体肿瘤转化过程中的作用的重新认识。鉴于Ik-1对生长激素基因调节的特异性,在垂体瘤形成过程中,Ik-1是否也作用于其他激素分泌基因、以及是否Ik-1其他家族成员也参与了这些分子调控事件,有待于今后进一步研究探索。
本研究结果表明,Ik-1和垂体因子包括Pit1之间形成特定的功能调节网络共同调节GH基因的表达。Ik-1抑制垂体GH基因的表达,是通过增加染色质去乙酰化状态、阻抑垂体因子Pit-1进入染色质与GH启动子结合而实现的。
[1] Ezzat S, Mader R, Fischer S, et al.An essential role for the hematopoietic transcription factor Ikaros in hypothalamicpituitary-mediated somatic growth[J].Proc Natl Acad Sci USA, 2006, 103(7):2214-2219.
[2] Yu S, Asa SL, Ezzat S.Fibroblast growth factor receptor 4 is a target for the zinc-finger transcription factor Ikaros in the pituitary [J].Mol Endocrinol, 2002, 16(5):1069-1078.
[3] Martinelli G, Iacobucci I, Storlazzi CT, et al.IKZF1 (Ikaros)deletions in BCR-ABL1-positive acute lymphoblastic leukemia are associated with short disease-free survival and high rate of cumulative incidence of relapse: a GIMEMA AL WP report [J].J Clin Oncol, 2009, 27(31):5202-5207.
[4] Dovat S, Payne KJ.Tumor suppression in T cell leukemia-the role of Ikaros [J].Leuk Res, 2010, 34(4):416-417.
[5] Yoshida T, Ng SY, Zuniga-Pflucker JC, et al.Early hematopoietic lineage restrictions directed by Ikaros [J].Nal Immunol, 2006, 7(4):382-391.
[6] Kathrein KL, Chari S, Winandy S.Ikaros directly represses the notch target gene Hes1 in a leukemia T cell line: implications for CD4 regulation [J].J Biol Chem, 2008, 283(16):10476-10484.
[7] Ezzat S, Yu SJ, Asa SL.Ikaros isoforms in human pituitary tumors: distinct localization, histone acetylation, and activation of the 5’fibroblast growth factor receptor-4 promoter [J].Am J Pathol, 2003, 163(3):1177-1184.
[8] Ezzat S, Mader R, Yu S, et al.Ikaros integrates endocrine and immune system development [J].J Clin Invest, 2005,115(4):1021-1029.
[9] Ezzat S, Asa SL.The emerging role of the Ikaros stem cell factor in the neuroendocrine system [J].J Mol Endocrinol,2008, 41(2):45-51.
[10] McElvaine AT, Korytko AI, Kilen SM, et al.Pituitary-specific expression and Pit-1 regulation of the rat growth hormonereleasing hormone receptor gene [J].Mol Endocrinol, 2007,21(8):1969-1983.
