聚焦高考等效平衡
2010-09-19孙秀艳
孙秀艳
(承德市承德县第一中学,河北 承德 067400)
一、问题的提出
普通高中化学人教版第二册(必修加选修)对等效平衡是这样表述的:“将0.01molCO和0.01mol H2O(g)通入容积为1L的密闭容器里,在催化剂存在的条件下加热到800℃,结果生成了0.05molCO2和0.05molH2,而反应物CO和H2O(g)各剩余0.05mol(第34页第四段)。”“实验证明,如果不是从CO和H2O(g)开始反应,而是各取0.01molCO2和0.01molH2,以相同的条件进行反应,生成CO和H2O(g),当达到化学平衡状态时,反应混合物里 CO、H2O(g)、CO2、H2各为 0.005mol,其组成与前者完全相同(第35页第二段)。”这两段文字说明“化学平衡状态的建立与化学反应途径无关”。即在一定条件下,可逆反应无论从正反应开始还是从逆反应开始,或正逆反应同时开始,只要起始加入物质的物质的量“相当”,就可以建立效果相同的平衡状态,也就是等效平衡状态,简称等效平衡。
二、概念的理解
一定条件:①恒温、恒容;②恒温、恒压。
效果相同的平衡状态:①平衡混合物中同一物质的分数(质量分数、体积分数、物质的量分数)相同;其物质的量、浓度等可能不同,但存在比例关系。②转化成同一边物质后,同一物质的转化率相同。
平衡状态只与始态有关,而与途径无关(如:①反应是从正反应方向开始还是从逆反应方向开始;②投料是一次还是分成几次;③反应容器经过扩大-缩小或缩小-扩大的过程),只要起始加入物质的物质的量“相当”,就可以达到相同的平衡状态。
三、规律的运用
1.等效平衡规律
一定条件下,对可逆反应m A(g)+nB(g)pC(g)+qD(g),改变起始物质的加入量,达到平衡状态时规律如下:

等效平衡类型 等效条件 等效结果恒温恒容m+n≠p+q极限转化后相同起始物质的物质的量·两次平衡时同一物质的分数相同,但n、c、正逆反应速率成比例变化恒温恒压极限转化后相同起始物质的物质的量两次平衡时同一物质的分数相同、且n、c、正逆反应速率均相同m+n=p+q极限转化后相同起始物质的物质的量数·值·相·等比··值·相·等比··值·相·等两次平衡时同一物质的分数、c、正逆反应速率相同,但n成比例变化
注意:①极限转化是指根据题给条件按化学方程式的计量系数比把生成物的起始加入量全部折算成反应物的量或把反应物的起始加入量全部折算成生成物的量,即:n(总起始)=n(起始)+Δn(全折)。②比值相等包含数值相等。
2.解题方法
(1)分析是否属于等效平衡问题(审题关键词:一定条件,改变起始量,分数、浓度等仍与原平衡相同)。
(2)属何种类型的等效平衡(审题关键词:恒温恒容有体积差、恒温恒容无体积差、恒温恒压)。
(3)极限转化后与原平衡所给起始投料情况进行比较(数值相等、比值相等)。
(4)建立等效平衡关系式。
(5)解关系式得出答案。
3.典例分析
(1)考查等效平衡起始量的判断
例1:(1993全国)在一定温度下,把2 mol SO2和1 mol O2通入一定容积的密闭容器中,发生如下反应,2SO2+O22SO3,当此反应进行到一定程度时反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c 分别代表初始时加入的 SO2、O2、SO3的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同。请填空:
①若 a=0,b=0,则 c=___________。
②若 a=0.5,则 b=___________,c=___________。
③a、b、c的取值必须满足的一般条件是___________,___________。(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)
解析:由题意可知这是恒温恒容、有体积差条件下的等效平衡,起始投入量按化学方程式计量系数转化成一边物质后应满足数值相等。①初始态2m ol SO2和1molO2的混合物极限转化后相当于2 mol SO3,故c=2。②若a=0.5,则b=0.5/2=0.25,此时与题干所设初始态的差别是△a=2-0.5=1.5,△b=1-0.25=0.75;此时 SO3的初始加入量c必须转化为等效于a=0.5,b=0.75的量,根据化学计量系数比推知c=1.5。③根据等效平衡的规律可得如下式子:a+c=2 ,b+c/2=1,a=2b。
答案:①c=2 ②b=0.25,c=1.5③a+c=2 b+c/2=1(或 2b+c=2)
变式:将一定容积的密闭容器改为一个容积可变的密闭容器,当温度不变时,只改变起始加入量,平衡时反应混合物中三种气体的百分含量仍跟上述平衡完全相同,则:
①若 a=0,b=0,则 c___________。
②若 a=0.5,则 b=___________,c___________。
③a、b、c的取值必须满足的一般条件是_______,___________。
解析:由题意可知这是恒温恒压条件下的等效平衡,起始投入量按化学方程式计量系数转化成一边物质应满足比值相等。由于起始加入SO2与O2的物质的量比为2:1,与化学方程式前的系数比相同,无论起始投入SO3的物质的量为何值,转化成SO2与O2的物质的量比均为2:1。所以,①若a=0,b=0,则C为大于零的任意值;②若a=0.5,则b=0.25,C≥0的任意值。
答案:①C>0 ②b=0.25,C≥0 ③a=2b C≥0(a、b、c不能同时为零)
(2)考查等效平衡中起始量与平衡量之间的关系
例2:(2004北京)在一定温度下,一定体积的密闭容器中有如下平衡:H2(气)+I2(气)2HI(气)。已知H2和I2的起始浓度均为0.10mol·L-1时,达平衡时H I的浓度为0.16 mol·L-1,若H2和I2的起始浓度均为0.20 mol·L-1时,则平衡时 H2的浓度(mol·L-1)是( )
A.0.16 B.0.08 C.0.04 D.0.02
解析:恒温恒容,反应前后无体积差,起始相同物质的物质的量比值相等,为等效平衡问题,故平衡时同一物质的浓度成比例变化。通过化学平衡计算,当H 2和I2的起始浓度均为0.10mol·L-1时,平衡时H2的浓度为0.02mol·L-1,则当H2和I2的起始浓度均为0.20 mol·L-1时,平衡时 H2的浓度为 0.04m ol·L-1。
答案:C
例3:一定温度下,某密闭容器中充入1molA2和2molB2,发生反应 A2(g)+B2(g) 2AB(g);△H=-aKJ/mol(a>0),达到平衡后,生成bm ol AB。当温度不变时,若起始加入的 A2、B2、AB 的物质的量分别为 x、y、z,则下列说法不正确的是 ( )
A.若保持恒容,x∶y<1∶2,z=0,则达到新平衡状态时的A 2转化率一定升高。
B.若保持恒容,x=0,y=1,z=2,达到平衡时,吸收的热量与原平衡放出的热量之和为aKJ。
C.若保持恒容,x∶y∶z=1∶1∶b,则达到新平衡状态时,A2的体积分数与原平衡时不同。
D.若保持恒压,x∶y=1∶2,z为任意值,则达到新平衡状态时AB的物质的量为(x+y+z)/3。
解析:由于反应前后无体积差,无论恒温恒容,还是恒温恒压,起始投入量转化成一边物质后比值相等即为等效。A选项x∶y<1∶2,相当于增大了B2的物质的量,A 2转化率一定升高,正确;B选项x=0,y=1,z=2,按化学方程式前的系数转化成左边物质的量后与原平衡数值相等,生成AB和消耗AB的总物质的量为2mol,根据能量守恒定律,消耗与生成等量的AB其能量变化值相等,故达到平衡时,吸收的热量与原平衡放出的热量之和为 aKJ,正确;C选项 x∶y∶z=1∶1∶b,按化学方程式前的系数转化成左边物质的量后x∶y=1∶1,与原平衡比值不等,故A2的体积分数与原平衡时不同,正确;D选项x∶y=1∶2,达到新平衡时AB的物质的量分数与原平衡AB的物质的量分数(b/3)相等,又因反应前后总物质的量不变,所以达到新平衡时AB的物质的量为(x+y+z)b/3,错误。
答案:D
(3)考查等效平衡与平衡移动的综合运用
例4:(2008全国Ⅱ)在相同温度和压强下,对反应CO2(g)+H2(g)CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
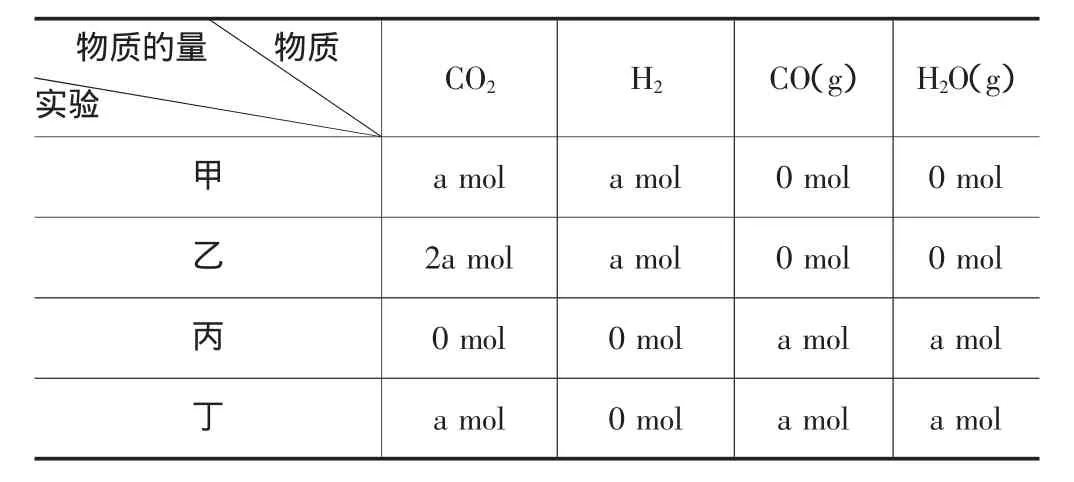
物质的量 物质实验 CO2 H2 CO(g) H2O(g)甲amol amol 0mol 0mol乙2amol amol 0mol 0mol丙0mol 0 mol amol amol丁amol 0 mol amol amol
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A.乙=丁>丙=甲
B.乙>丁>甲>丙
C.丁>乙>丙=甲
D.丁>丙>乙>甲
解析:由题意可知这是恒温恒压条件下的等效平衡,起始量按照方程式前的系数转化成一边物质后应满足比值相等,则甲、丙为等效平衡,乙、丁为等效平衡;乙、丁两组实验中二氧化碳的物质的量是甲、丙两组实验中二氧化碳物质的量的2倍,而氢气的物质的量保持不变,乙、丁两组实验所建立的平衡相当于在甲、丙两组实验基础上,向体系中又amol CO2,根据化学平衡移动原理,增大反应物的量平衡向正反应方向移动,使CO的物质的量增大。故选择A。
答案:A
(4)利用等效平衡的方法考查不等效平衡的问题
例5:(节选2003江苏)恒温、恒压下,在一个可变容积的容器中发生如下发应:A(g)+B(g)C(g)①若开始时放入1molA和1molB,到达平衡后,生成amolC;
②若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应,到达平衡后生成b molC。将b与(1)小题中的a进行比较(选填一个编号)。
(甲)a<b
(乙)a>b
(丙)a=b
(丁)不能比较a和b的大小
解析:A(g)+B(g)C(g)的正反应为气体体积减小的反应,①中为恒温恒压,②中为恒温恒容,①相当于在②中容器的基础上增加压强,此时平衡正向移动,故可得:a>b。
答案:乙
