氮元素对发菜生长及多糖含量的影响
2010-09-15胡征宇
汤 俊,万 能,胡征宇*
氮元素对发菜生长及多糖含量的影响
汤 俊1,2,万 能2,胡征宇1,*
(1.中国科学院水生生物研究所,湖北 武汉 430072;2.常熟理工学院生物与食品工程系,江苏 常熟 215500)
为优化培养条件,研究含氮(BG11)和无氮(BG110)培养基对发菜(Nostoc flagelliforme)的色素、藻胆蛋白及胞内多糖和胞外多糖(EPS)含量的影响。结果显示:含氮组发菜的叶绿素a(Chl a)、类胡萝卜素(Carotenoids)、藻蓝蛋白(PC)、别藻蓝蛋白(APC)、藻红蛋白(PE)的含量均显著高于无氮组;胞内及胞外多糖含量无氮组高于含氮组,两者胞内多糖含量最大分别为1.03mg/mL和0.78mg/mL,EPS含量最大分别为243.8μg/mL和74.9μg/mL。表明氮元素的缺乏对发菜的色素合成有抑制作用,但在一定程度上能够促进胞内及胞外多糖的合成和分泌。
发菜;氮;多糖;藻胆蛋白
发菜(Nostoc flagelliforme)是一种固氮蓝藻,其群体多呈墨绿色丝状,主要分布于我国北方及西北干旱和半干旱地区[1]。发菜含有较高含量的多糖、蛋白及必需氨基酸,并且对于高血压、甲状腺肿大等疾病有一定的治疗作用,在我国作为食品和草药已有上千年的历史[2]。多糖是一类具有抗衰老、抗肿瘤、降血糖及免疫促进等活性作用的生物大分子[3-6]。关于多糖活性的研究已有许多报道,如发菜多糖能够清除超氧阴离子自由基和羟自由基[5],螺旋藻多糖能够抑制癌细胞增殖[7-9]等。有研究证明,藻胆蛋白也同样具有清除自由基、抑制癌细胞和病毒增殖的作用[9-11]。本实验研究氮元素对发菜的生长、藻胆蛋白及多糖等组分含量的影响,为优化培养条件和多糖等功能性物质的开发利用提供参考。
1 材料与方法
1.1 藻种与培养条件
发菜(N.flagelliforme,FACHB-818)来自中科院水生生物研究所典型培养物保藏委员会淡水藻种库。取对数生长期的藻体进行培养实验。温度为(27±2)℃,光照强度为28μE/(m2·s),通气培养。BG11培养基配方参照Rippka等[12]的方法,BG110为不含NaNO3的BG11培养基。
1.2 叶绿素和类胡萝卜素含量的测定
藻样经离心弃上清液。藻体加入无水甲醇,避光60℃水浴1h。离心取上清液分别测定波长665nm、649nm和450nm处吸光度[13]。根据下列公式计算叶绿素含量(CChla)及类胡萝卜素(CCarotenoids含量)。

1.3 藻胆蛋白含量的测定
取藻样,离心弃上清,藻体经暗处研磨后加入磷酸缓冲液(0.05mmol/mL,pH7.2)。-20℃反复冻融以充分提取藻蓝蛋白,分光光度计测定波长615、652nm及562nm处的吸光度[13]。根据下列公式分别计算藻胆蛋白各组分的含量。

1.4 胞内多糖含量的测定
藻样经蒸馏水清洗后研磨,然后再加入蒸馏水于95℃水浴3h。离心取上清,采用苯酚硫酸法在波长490nm处测定吸光度,参照葡萄糖标准曲线,计算多糖含量。
1.5 胞外多糖的测定及可见光区吸收光谱扫描
藻样离心后取上清液,用蒸馏水进行4倍稀释,稀释后的溶液采用苯酚硫酸法显色测定多糖含量,并在波长400~800nm之间扫描吸收光谱。
1.6 数据处理
数据用Origin 7.0处理,数据表示为平均值±标准差,P<0.05为差异显著。
2 结果与分析
2.1 氮元素对发菜叶绿素和类胡萝卜素含量的影响

图1 氮元素对发菜叶绿素(A)和类胡萝卜素(B)含量的影响Fig.1 Effect of nitrogen on the contents of Chl a and carotenoids of N. flagelliforme
如图1所示,在含氮和无氮培养基中生长的发菜,其两种色素的含量均显著增高,但在培养后期,无氮组的色素含量上升趋势明显低于含氮组。其中,BG11培养条件下生长20d的叶绿素和类胡萝卜素含量分别为27.5mg/mL和7.2mg/mL,而BG110组为11.2mg/mL和2.9mg/mL。色素含量一般可用作衡量微藻生物量变化的指标,从结果可以看出,培养基中提供氮源与否,发菜都能够生长,但生物量的快速增加需要充足的氮源供应。
2.2 氮元素对发菜藻胆蛋白含量的影响
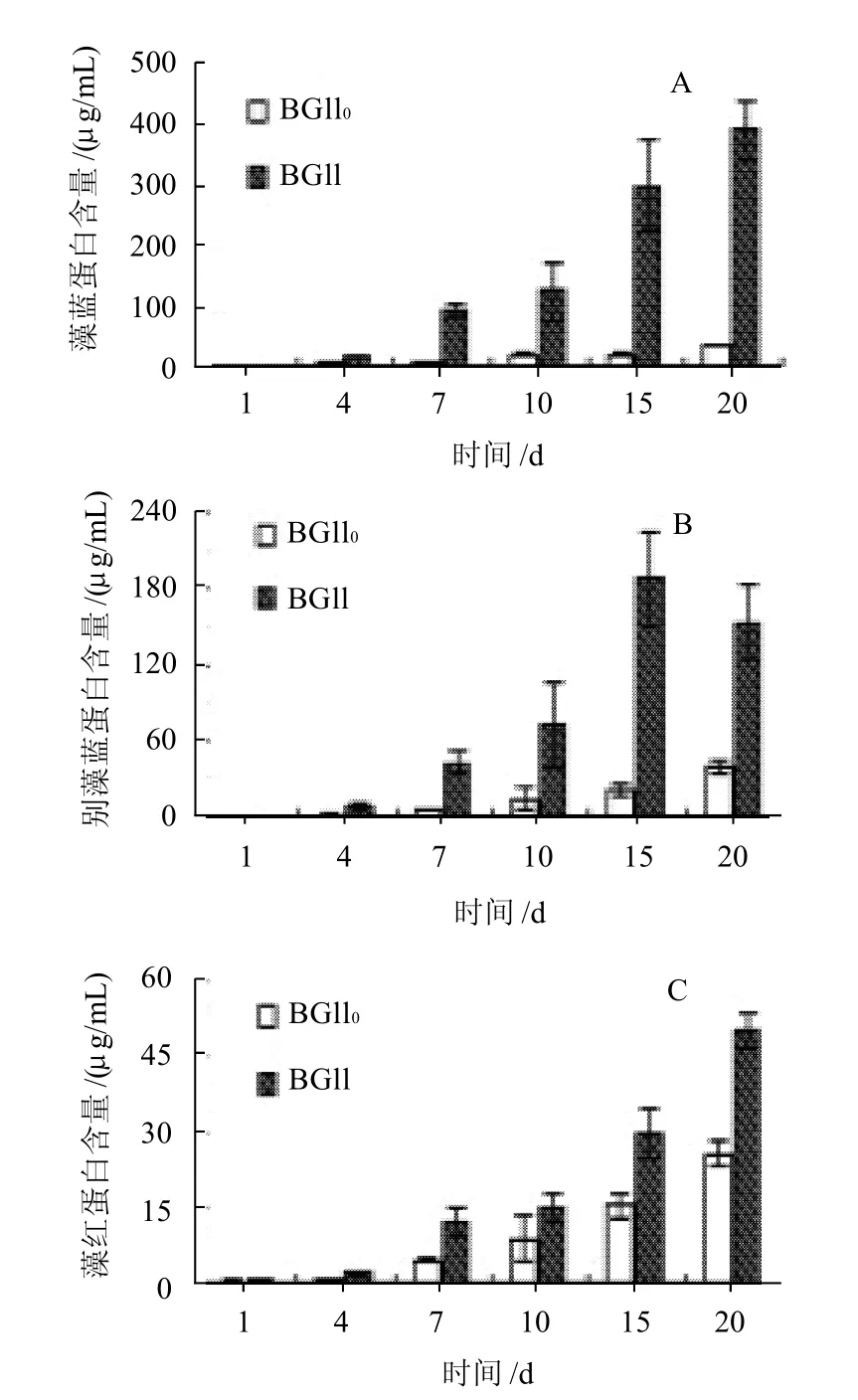
图2 氮元素对发菜藻蓝蛋白(A)、别藻蓝蛋白(B)及藻红蛋白(C)含量的影响Fig.2 Effect of nitrogen on the contents of PC, APC and PE of N. flagelliforme
藻胆蛋白包含藻蓝蛋白(PC)、藻红蛋白(PE)和别藻蓝蛋白(APC),是蓝藻重要的辅助捕光色素系统,在光合作用中起着吸收和传递能量的重要作用。如图2所示,BG11和BG110培养的发菜,其藻胆蛋白各组分的含量随着培养时间的增长而增加,其中PC含量最高,其次为APC和PE。在培养至20d时,BG11和BG110组的PC含量分别为395.5、33.4μg/mL;APC含量分别为153.4、38.0μg/mL;PE含量分别为50.3、25.7μg/mL。BG11组藻胆蛋白含量比BG110组高出61.7%,说明培养基中提供氮元素有利于发菜藻胆蛋白的合成。
2.3 氮元素对发菜多糖含量的影响

图3 氮元素对发菜胞内多糖(A)和EPS(B)含量的影响Fig.3 Effect of nitrogen on the contents of endo- and exopolysaccharides of N. flagelliforme
由图3可知,在培养前期,BG11组培养的发菜胞内多糖含量低并且与BG110组差异不显著,但培养至15d时,BG110组发菜多糖含量迅速增加并显著高于BG11组的发菜多糖含量。第20天时,胞内多糖含量分别为BG110组1.03mg/mL和BG11组0.78mg/mL(图3)。在培养至第15天时,可检测到较高含量的胞外多糖(EPS),并且BG110组含量高于BG11组。随培养时间的延长,含量差异显著增大,最大含量分别为BG110组243.8μg/mL和BG11组74.9μg/mL。这说明与提供充足氮源相比,氮元素的缺乏更能有效的促进多糖,尤其是胞外多糖的合成与分泌。2.4胞外多糖的吸收光谱
如图4A显示,BG110培养的发菜,其胞外物质在波长490nm处有特征吸收峰,说明主要成分为多糖,并且含量随培养时间的延长而显著增加。BG11组(图4B)的发菜在培养初期,虽然在波长490nm处有吸光度,但没有典型的吸收峰,说明此阶段并没有胞外多糖的分泌。随着培养的进行,波长490nm的典型吸收峰出现并且愈发明显,表明此阶段有胞外多糖的分泌,而且含量逐渐增加,但含量明显低于BG110组,这与多糖含量结果相一致,同时再次表明氮元素的缺乏能够促进胞外多糖的分泌。


图4 不同培养时间和不同培养基培养的发菜胞外多糖的吸收光谱Fig.4 Visible absorption spectra of Nostoc flagelliforme cultivated in BG11 and BG110 for different days
3 讨 论
糖类物质除了显著的药用活性外还具有许多其他重要的生物学功能,特别是在与其所生长环境之间的相互作用中,糖类的合成有十分特殊的意义。有研究认为,在机体抵抗环境的胁迫中,保持细胞膜的完整性最为重要,而研究证明,蓝藻中对细胞膜保护功能最明显的就是糖物质[14]。胞外多糖的丰富合成是念珠藻的重要特征之一,其最基本的生物学功能是保持水分,这种功能对于生长于沙漠地带的发菜来说意义重大。正是由于多糖具有如此多的生物学意义,多糖与其限制因素的研究越来越受到重视。
氮是藻类生长繁殖必不可少的营养因子,是细胞代谢中形成氨基酸、嘌呤、嘧啶、卟啉、氨基糖等物质的基本元素,其种类及其浓度的变化,都可以影响到藻类的色素、蛋白和多糖的合成[15-16]。
研究发现,BG110培养下,发菜叶绿素及藻胆蛋白的含量远低于BG11组,说明无机氮源(NO3)的缺失对发菜的生长有抑制作用。虽然发菜可以固氮,但这是个非常耗能的过程,无法提供给细胞分裂和生长充足的氮源会影响发菜的生长状况[17]。
Spoer等[18]研究发现,小球藻(Chlorella vulgaris)在氮缺乏时会导致糖含量的增加,但以蛋白质的降低作为代价。Kroen等[19]发现氮缺失时,墨西哥衣藻(Chlamydomonas mexicana)会增加糖的积累,这与本实验获得的胞内及胞外多糖的含量均为无氮培养组较高的结果相一致。
培养基中NO3对糖含量的检测有干扰[20],因此本实验除了利用常规方法测定糖含量外,还进行了EPS的扫描检测。结果显示,在BG110培养基中多糖的典型吸收峰显著,并且含量随时间的增加而升高,说明在培养基中氮的缺乏可促进发菜分泌EPS,但含量低于胞内多糖的合成量。
发菜因与发财谐音,且营养价值高,在东南沿海和部分海外地区被视为重要的节日馈赠礼品,也是我国重要出口物资之一[17]。近半个世纪来,发菜的生长环境遭到严重破坏,自然资源量已无法满足社会需求,因此发菜的人工培养备受关注。本研究就培养条件及其对多糖等功能性物质含量的影响进行了测定分析,所得结论对发菜的人工培养及活性成分的开发利用都具有重要的指导意义。
[1]毕永红, 胡征宇. 葛仙米的营养价值及其开发利用[J]. 中国野生植物资源, 2004, 23(1): 40-42.
[2]邓中洋, 况琪军, 胡征宇. 葛仙米室内规模化培养、群体显微结构及营养成分分析[J]. 武汉植物学研究, 2006, 24(5): 481-484.
[3]WANG Jing, ZHANG Quanbin, ZHANG Zhongshan, et al. Antioxidant activity of sulfated polysaccharide fractions extracted from Laminaria japonica[J]. International Journal of Biological Macromolecules, 2008, 42(2): 127-132.
[4]KIMURA Y, ATTAUR R. Antitumor and vascular physiological effects of natural products[J]. Studies in Natural Products Chemistry, 2005, 30: 55-78.
[5]汤俊, 胡征宇. 三种念珠藻多糖对自由基的清除作用[J]. 武汉植物学研究, 2006, 24(1): 63-66.
[6]TANG Jun, HU Zhengyu, CHEN Xinwen. Free radical scavenging and antioxidant enzymes activation of polysaccharide extract from Nostoc sphaeroides[J]. American Journal of Chinese Medicine, 2007, 35(5): 887-896.
[7]YUFENG L, LIZHI X, NI C, et al. Inhibitory effect of phycocyanin from Spirulina platensis on the growth of human leukemia K562 cells[J]. Journal of Applied Phycology, 2000, 12(2): 125-130.
[8]SHIH S R, TSAI K N, LI Y S, et al. Inhibition of enterovirus 71-induced apoptosis by allophycocyanin isolated from a blue-green alea Spirulina platensis[J]. Journal of Medical Virology, 2003, 70: 119-125.
[9]陈新美, 梅兴国. 螺旋藻多糖和藻胆蛋白的肿瘤防治作用及机制[J].中草药, 2004(1): 100-103.
[10]陈美珍, 张永雨, 余杰, 等. 龙须菜藻胆蛋白的分离及其清除自由基作用的初步研究[J]. 食品科学, 2004, 25(3): 159-162.
[11]王庭健, 林凡, 赵方庆, 等. 藻胆蛋白及其在医学中的应用[J]. 植物生理学通讯, 2006, 42(2): 303-307.
[12]RIPPKA R, DERUELLES J, WATERBURY J B, et al. Generic assignments, strain histories and properties of pure cultures of cyanobacteria [J]. Journal of General Microbiology, 1979, 111(1): 1-61.
[13]BENNETT A, BOGORAD L. Complementary chromatic adaptation in a filamentous blue-green alga[J]. Journal of Cell Biology, 1978, 58: 419-435.
[14]韩丹翔, 毕永红, 胡征宇. 念珠藻的研究进展及其应用前景[J]. 高技术通讯, 2004(3): 106-110.
[15]URKOVSKI A. Ammonium assimilation and nitrogen control in Corynebacterium glutamicum and its relatives: an example for new regulatory mechanisms in actinomycetes[J]. FEMS Microbiology Reviews, 2003, 27(5): 617-628.
[16]INTILA S, SHEHAWY R. Ammonium ions inhibit nitrogen fixation but do not affect heterocyst frequency in the bloom-forming cyanobacterium Nodularia spumigena strain AV1[J]. Microbiology, 2007, 153(11): 3704-3712.
[17]李运广, 胡征宇. 发菜(Nostoc agelliforme)培养条件的研究[J]. 武汉植物学研究, 2003, 21(5): 411-414.
[18]SPOER H A, DRAGET K I. Chemistry and physical properties of alginates[J]. Carbohydrate in European, 1996, 14: 6-13.
[19]KROEN W, RAYBURN W. Influence of growth status and. nutrients on extracellular polysaccharide synthesis by the soil alga Chlamydomonas mexicana (Chlorophyceae)[J]. Journal of Phycology, 1984, 20(2): 253-257.
[20]黄泽波. 丝状蓝藻水溶性多糖的研究[D]. 武汉: 中国科学院水生生物研究所, 1997.
Effect of Nitrogen on the Growth and Polysaccharide Content of Nostoc flagelliforme
TANG Jun1,2,WAN Neng2,HU Zheng-yu1,*
(1.Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China;2. Department of Biology and Food Engineering, Changshu Institute of Technology, Changshu 215500, China)
Cultivation of Nostoc flagelliforme in nitrogen-containing (BG11) and non-nitrogen-containing (BG110) media was conducted for figuring out the effects of nitrogen on the growth and the contents of phycobiliprotein (PC), allophycocyanin (APC), phycoerythrin (PE) and endo- and exopolysaccharides of Nostoc flagelliforme were investigated. The results showed that after 20 d cultivation, compared to BG110 medium, N. flagelliforme cultured in BG11 medium had much higher contents of Chl a, carotenoides, PE, APC and PC, but much lower contents of endo- and exo polysaccharides. The maximum content of endopolysaccharides was 1.03 mg/mL in BG110and 0.78 mg/mL in BG11, while that of exopolysaccharides was 243.8μg/mL in BG110 and 74.9μg/mL in BG11. These results indicate that nitrogen deficiency may inhibit the growth of N.flagelliforme, but promote the synthesis of endo- and exopolysaccharides to a certain extent.
Nostoc flagelliforme;nitrogen;polysaccharide;phycobiliprotein
TS254.58
A
1002-6630(2010)19-0092-04
2010-02-20
国家自然科学基金项目(30671611);苏州市科技局应用藻类学重点实验室基金项目(SZS0806)
汤俊(1980—),女,讲师,博士,主要从事藻类生理生化研究。E-mail:tyilin929@hotmail.com
*通信作者:胡征宇(1957—),男,研究员,博士,主要从事藻类生物技术和藻类系统分类学研究。E-mail:Huzy@ihb.ac.cn
