基于 2-(4-苯基-1,2,3-三唑)亚甲基吡啶(PTMP)的过渡金属配合物的合成与晶体结构
2010-09-15陈兴国秦金贵
傅 杨 刘 炎 钟 成 李 桦 陈兴国秦金贵
(武汉大学化学与分子科学学院,有机高分子光电功能材料湖北省重点实验室,武汉 430072)
基于 2-(4-苯基-1,2,3-三唑)亚甲基吡啶(PTMP)的过渡金属配合物的合成与晶体结构
傅 杨 刘 炎 钟 成 李 桦 陈兴国*秦金贵
(武汉大学化学与分子科学学院,有机高分子光电功能材料湖北省重点实验室,武汉 430072)
本文报道了一类基于2-(4-苯基-1,2,3-三唑)亚甲基吡啶(PTMP)配体的过渡金属镍、钴和锌配合物的合成,并通过单晶衍射实验确定了它们的晶体结构。研究结果表明,在这类金属配合物中,PTMP均通过吡啶氮原子和1,2,3-三唑中的2位氮原子与金属配位,并形成了六元螯合环。在Co(Ⅱ)及Ni(Ⅱ)的配合物中,有2个PTMP参与配位,配位数为6,配合物的空间构型是畸变的八面体;而在Zn(Ⅱ)中则只有1个PTMP参与配位,配位数为4,配合物的空间构型是变形的四面体。晶体结构数据分析及理论计算结果表明,尽管PTMP分子中1,2,3-三唑环上的2位氮原子相对于3位氮原子而言,电子云密度较低,但在这类配合物中由于“螯合效应”2位氮原子仍然表现出了较强的配位能力。
1,2,3-三唑;合成;过渡金属配合物;晶体结构
在有机配体的设计合成中,含中性给体原子的螯合配体一直是研究者所关注的重点之一[1]。2001年Sharpless等发现了Cu(Ⅱ)催化的端炔与有机叠氮的[2+3]环加成反应(简称CuAAC反应)[2],它所表现出的反应条件温和、原子经济性高、反应区域选择性好、后处理简单等特点,很快引起国内外学术界的极大兴趣,在化学合成、生物医药设计、材料制备、超分子组装与构筑等方面得到了广泛应用[3-5]。由 CuAAC 反应制备的 1,4-二取代-1,2,3-三唑类化合物,其三唑环含有2个具有孤对电子对的氮原子,可以参与金属离子的配位,因此提供了一条构筑新型配合物或超分子功能体系的有效途径[5-16]。2006年Schibi[5]等首次将这一理念用于配体设计,并将合成的配合物用于放射性生物医学标记研究而获得了较理想的研究结果。
最近,含有1,2,3-三唑环的有机配体及其配合物的设计合成进一步引起了人们的研究兴趣。然而,绝大部分的研究主要关注的是1,2,3-三唑环上3位氮(N3)原子与金属离子的配位[6-7,9-12],只有少数的工作涉及到1,2,3-三唑环上2位氮(N2)原子与金属离子的配位[8,13-14]。理论计算表明,N2原子的电子云密度明显低于N3原子,说明1,2,3-三唑环上N2原子虽然含有可配位的孤对电子对,但它可能并不是一个理想的配位点[5,15-16]。
为进一步研究1,2,3-三唑环上N2原子与不同金属离子的配位能力,本文选择了一个简单的基于1,2,3-三唑环的有机配体 (2-(4-苯基-1,2,3-三唑)亚甲基吡啶,简称PTMP)与一系列过渡金属离子配位,得到了其相应的钴、镍、锌的配合物,并通过单晶结构衍射实验确定了它们的结构。同时利用DFT方法计算了配体的电荷分布情况,探讨了1,2,3-三唑环上的2位氮原子与金属离子的配位作用。
1 实验部分
1.1 试剂与仪器
实验所用试剂如无特殊说明,均为市售化学纯或分析纯,未经纯化直接使用。核磁共振(1H NMR和13C NMR)采用Varian Mercury-VX300型核磁共振仪完成;质谱采用Finnigan Trance Mass Spectrometer仪器;红外光谱 (KBr压片)采用NICOLET 170SX FTIR光谱仪进行;元素分析采用Vario ELⅢ元素分析仪完成;熔点在北京泰克仪器厂生产的X-4数字显示显微熔点仪上测定(温度未校正)。单晶结构测试在Bruker Smart ApexⅡCCD单晶衍射仪上进行,入射波长为 0.071 073 nm(Mo Kα射线,石墨单色器),在不同温度下,衍射数据采用φ-ω扫描方式由SMART程序收集。全部衍射数据经Lorentz和极化校正。结构用直接法解出。全部非氢原子坐标和各向异性温度因子均采用SHELXL97程序进行全矩阵最小二乘法修正。
1.2 化合物合成
配体 2-(4-苯基-1,2,3-三唑)亚甲基吡啶(PTMP)按文献合成[3],单晶培养在二氯甲烷及正己烷的混合溶液中完成。熔点 78 ℃,1H NMR(CDCl3,300 Hz,TMS 内标,ppm):δ=8.61(d,1H,J=3.9 Hz),7.94(s,1H),7.83(d,2H,J=7.5 Hz),7.70(t,1H),7.41(t,2H),7.43 ~7.29(m,3H),5.71(s,2H);13C NMR (CDCl3,300 Hz,TMS 内 标 ,ppm):δ=154.7,145.0,148.4,137.6,130.7,129.0,128.4,125.9,123.7,122.7,120.50,55.9;IR(KBr粉末压片,cm-1):3 121,3 094,3 045,2 983,2 360,2 341,1591,1480,1462,1438,1424,1384,1224,1200,1 192,1 078,1 051,1 030,998,975,791,754,771,746,699,693,593;MS:m/z=237.2(M+);元素分析按 C14H12N4计算值(%):C 71.17,H 5.12,N 23.71;实测值(%):C 71.55,H 4.81,N 23.33。
二氯二[2-(4-苯基-1,2,3-三唑)亚甲基吡啶]合钴(Ⅱ)([Co(PTMP)2Cl2],1)的合成:将 236.3 mg(1 mmol)PTMP溶于3 mL丙酮中,加入2 mL空白丙酮作为缓 冲 层,将 2 mL 溶 有 119 mg CoCl2·6H2O(0.5 mmol)的丙酮小心地置于缓冲层上方静置。约2 d后得到可供结构测试的单晶样品123 mg,产率41%。IR(cm-1,KBr 粉末压片):3 135,3 057,2 983,2 935,1654,1606,1574,1481,1437,1359,1322,1234,1 201,1 161,1 086,1 065,1 020,975,831,766,719,719,697,663,611,511,479; 熔点 258 ℃。元素分析按C28H24N8Cl2Co 计算值 (%):C 55.83,H 4.02,N 18.60;实测值(%):C 55.71,H 3.92,N 18.27。
二氯二[2-(4-苯基-1,2,3-三唑)亚甲基吡啶]合镍 (Ⅱ)([Ni(PTMP)2Cl2],2)的 合 成:236 mg(1.0 mmol)PTMP 和 161 mg(0.5 mmol)NiCl2·6H2O 溶于 25 mL甲醇中,氩气氛围下回流24 h,待冷却至室温后,将所得蓝绿色溶液过滤,浓缩至5 mL,加入乙醚。约1周后,出现大量天蓝色晶体120 mg,产率40%。IR(cm-1,KBr粉末压片):3 127,3 084,3 074,3 030,2 979,2 934,1 652,1 608,1 573,1 486,1 476,1 441,1 354,1 313,1 268,1 246,1 199,1 158,1 085,1 063,1 020,976,912,839,818,766,753,723,708,693,641,608,557,509,479,433。熔点:>250 ℃(分解)。元素分析按C28H24N8Cl2Ni计算值 (%):C 55.85,H 3.84,N 18.56;实测值(%):C 55.31,H 4.02,N 18.61。
二叠氮酸根二[2-(4-苯基-1,2,3-三唑)亚甲基吡啶]合镍(Ⅱ)([Ni(PTMP)2(N3)2],3)的合成:合成采用水热法: 称取 47.2 mg (0.2 mmol)PTMP,29.1 mg(0.1 mmol)Ni(NO3)2·6H2O,13 mg(0.2 mmol)NaN3,放入水热反应器中,加入3 mL去离子水,于烘箱中80℃反应3 d,冷却至室温,过滤收集所得深蓝色晶体,用水、二氯甲烷、甲醇各洗涤3次,除去未反应的配体及金属盐,得产物38.3 mg,产率62%。IR(cm-1,KBr粉末压片):3 119,3 075,3 025,2 036,1 646,1 608,1 575,1 480,1 436,1 355,1 310,1 246,1 200,1159,1088,1023,972,941,919,858,839,763,724,697,646,613,510。熔点:>300 ℃(分解)。元素分析按C28H24N14Ni计算值 (%):C 54.66,H 3.93,N 31.87;实测值(%):C 55.41,H 3.85,N 31.99。
二氯[2-(4-苯基-1,2,3-三唑)亚甲基吡啶]合锌(Ⅱ)([Zn(PTMP)Cl2],4)的合成:在 10 mL 试管中,将140 mg(0.5 mmol)ZnCl2的丙酮溶液小心的置于75 mg(0.25 mmol)PTMP的二氯甲烷溶液上层,自然扩散,约2个月后,得到无色透明的晶体状产物101 mg,产率 86%。IR(cm-1,KBr粉末压片):3124,3089,3 058,3 030,2 998,2 924,1 612,1 575,1 480,1 440,1 377,1 355,1 316,1 255,1 226,1 158,1 084,1 062,1 029,972,944,916,842,766,723,695,646,606,547,507,481。熔点:>250 ℃(分 解)。元素分析按C14H12N4Cl2Zn 计算值 (%):C 45.13,H 3.25,N 15.04;实测值(%):C 45.22,,H 3.13,N 15.10。
2 结果与讨论
2.1 配合物结构
图1给出了所有配合物的化学结构式。由图可见,当PTMP与相应过渡金属盐反应时,均通过吡啶环上的氮原子和1,2,3-三唑环的N2原子与中心金属配位构成六元螯合环;但由于中心金属的不同,配合物的立体构型发生了改变。4个金属配合物均为单核配合物,其中PTMP与Co(Ⅱ)和Ni(Ⅱ)形成的3个配合物均为六配位的八面体构型,而与Zn(Ⅱ)形成的配合物则为四配位的四面体构型。配合物主要晶体学数据见表1,主要键长键角数据见表2,
CCDC:759810,1;767939,2;767940,3;767941,4。
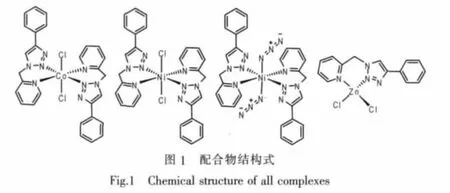
表1 配合物的晶体学及结构精修参数Table 1 Crystal data and structure refinement for complex

续表1

表2 配合物1~4中重要的键长、键角Table 2 Selected bond length and angles for complex 1~4

续表2
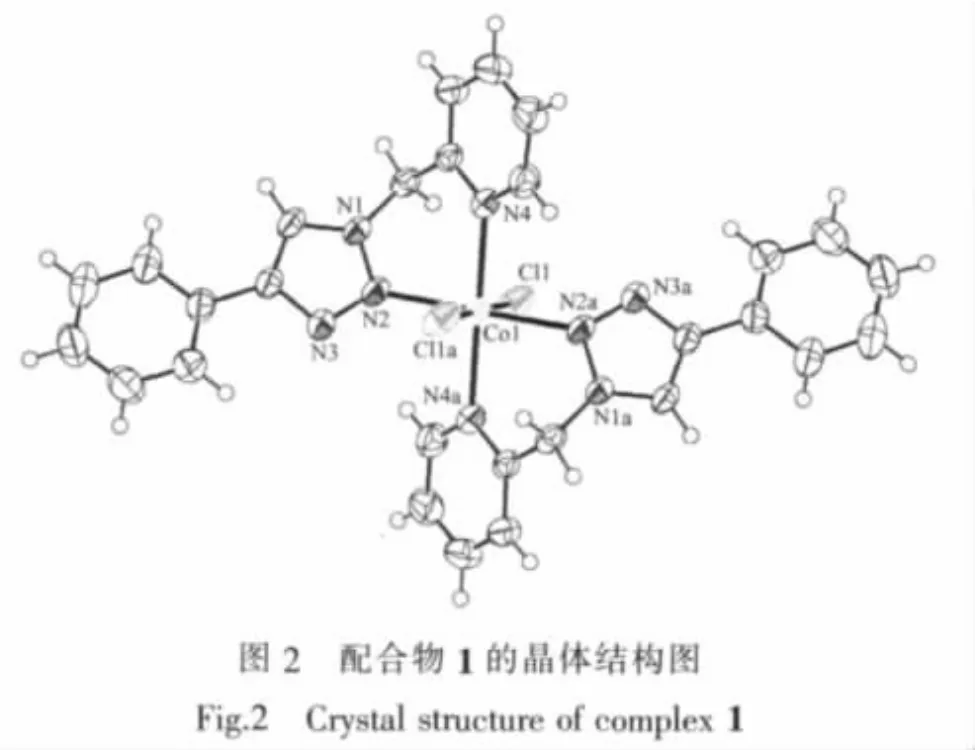
2.1.1 配合物[Co(PTMP)2Cl2](1)的晶体结构
配合物1晶体结构见图2,其数据采集条件以及部分晶体学、结构精修参数列于表1中。从图2及表1发现,配合物1的晶体结构和文献报道的铜配合物类似[13a],同为单核配合物,属于单斜晶系P21/c空间群。每个配合物中,由2个PTMP配体和2个氯离子与Co(Ⅱ)配位,形成八面体空间构型。八面体的赤道平面由4个氮原子组成,2个吡啶氮原子处于赤道平面的对位,2个三唑环的N2原子处于另外的对位上,八面体的顶点则由2个氯离子占据,Co(Ⅱ)离子位于八面体的中心,2个PTMP配体各自的苯环位于赤道平面的对位上。此外,从表4还可以看出,三唑环N2原子与Co(Ⅱ)的配位键键长(Co1-N2)为0.21964 nm,比吡啶氮原子与Co(Ⅱ)的配位键键长(Co1-N4)0.21855 nm略长,说明N2原子与Co(Ⅱ)的配位能力比吡啶氮原子稍弱,但仍具有较强的配位作用,这可能与两者间的螯合效应有关。
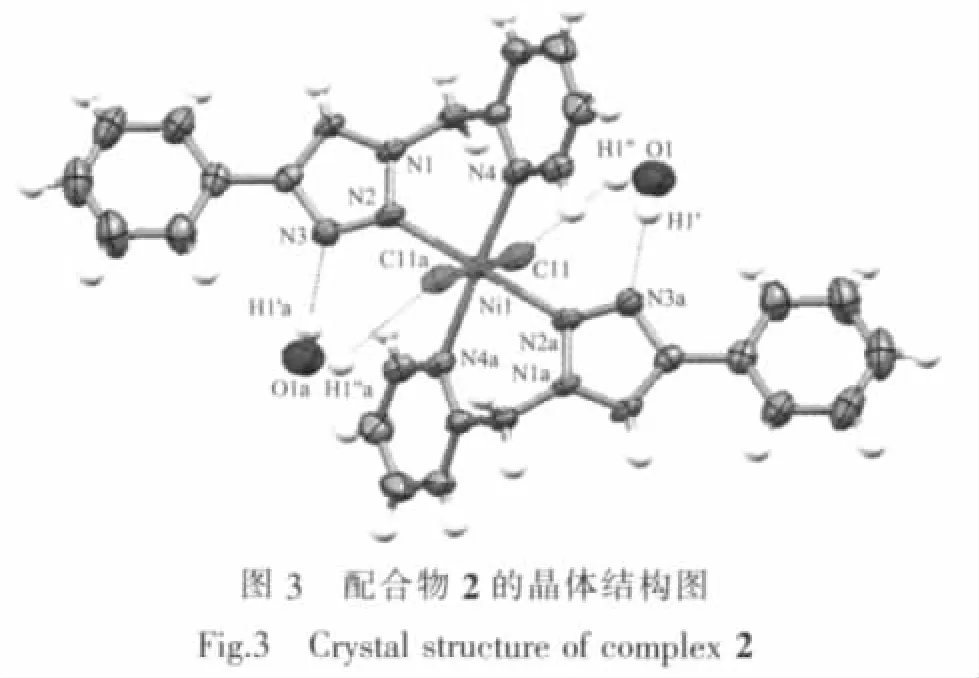
2.1.2 配合物([Ni(PTMP)2Cl2])(2)的晶体结构
配合物2晶体结构如图3,属于单斜晶系P21/c空间群。它和配合物1具有基本相同的几何立体构型,同为单核配合物,但是晶胞中多了2个未配位的结晶水分子。每个配合物单元均由2个PTMP配体和2个氯离子与Ni(Ⅱ)配位,形成了八面体空间构型。八面体的赤道平面由4个氮原子组成,2个吡啶氮原子处于赤道平面的对位,2个三唑环N2原子处于另外的对位上,顶点由2个氯离子占据,Ni(Ⅱ)原子位于八面体的中心,2个配体各自的苯环则位于赤道平面的对位上。另外,2个未参与配位的结晶水分子分别与三唑环上未参与配位的N3原子以及八面体顶点的氯离子形成了2个O-H…N氢键和2个O-H…Cl氢键 (参数列于表3),由此构成水分子与[Ni(PTMP)2Cl2]单元的超分子组装结构,这样可以进一步稳定其晶体结构。
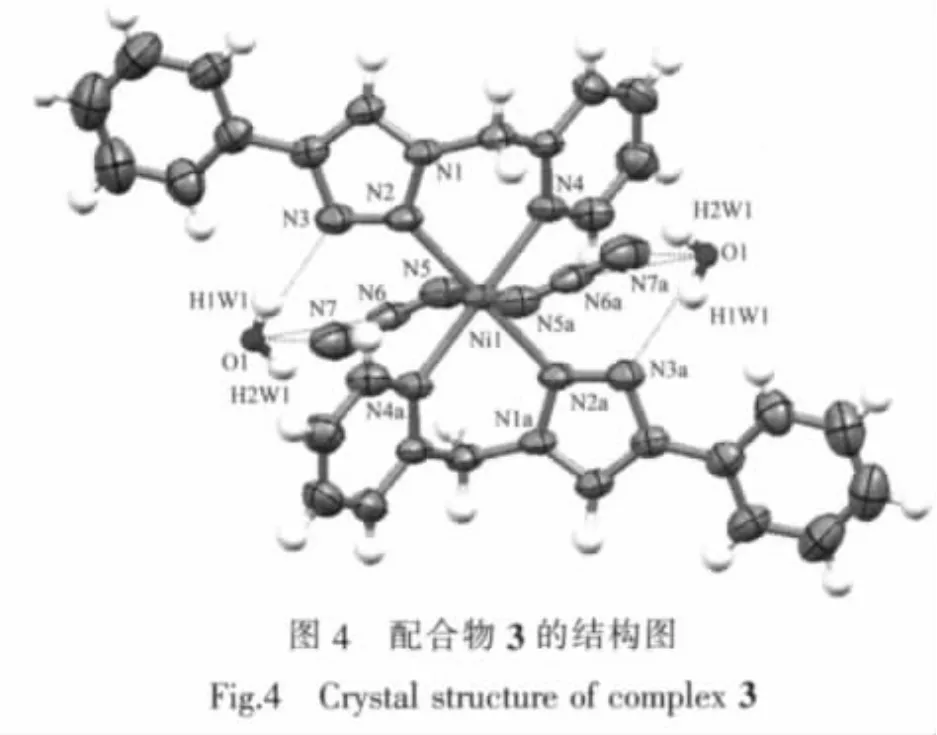
2.1.3 配合物[Ni(PTMP)2(N3)2](3)的晶体结构
为了探讨辅助配体对配合物结构的影响,本文还利用叠氮钠(NaN3)与硝酸镍Ni(NO3)2替代NiCl2与配体反应,得到了相应的配合物3。3同样为单核配合物,属于单斜晶系P21/c空间群,在每个配合物单元中,2个PTMP配体和2个叠氮酸根(N3-)与Ni(Ⅱ)配位,形成了八面体空间构型。八面体的赤道平面由4个氮原子组成,2个吡啶氮原子处于赤道平面的对位,2个三唑环N2原子处于另外的对位上,而八面体的顶点由2个叠氮酸根(N3-)构成,Ni(Ⅱ)离子位于八面体的中心,2个配体各自的苯环位于赤道平面的对位上。另外,在配合物3中也存在2个未参与配位的水分子,它们与未配位的三唑环N3原子以及配位的叠氮酸根离子中2个未参与配位的氮原子形成了3个O-H…N氢键(参数列于表3),由此构成水分子与 [Ni(PTMP)2(N3)2]单元的超分子组装结构。与配合物2相比,配合物3中的水分子和三唑上N3原子所形成的氢键键角更大,相对强度更高,这一结果说明在PTMP与Ni(Ⅱ)形成的配合物中,水分子参与形成的氢键作用有利于稳定其晶体结构。此外,配位叠氮酸根离子的3个氮原子间的夹角为178.57°,基本保持了直线构型。通常叠氮酸根的头、尾2个氮原子均具有配位能力,但在3中它并没有起到桥联作用,只是头部氮原子参与配位,同时作为抗衡阴离子维持了3的电荷平衡。

表3 配合物2与3中的氢键参数Table 3 Hydrogen bond geometry in complex 2 and 3
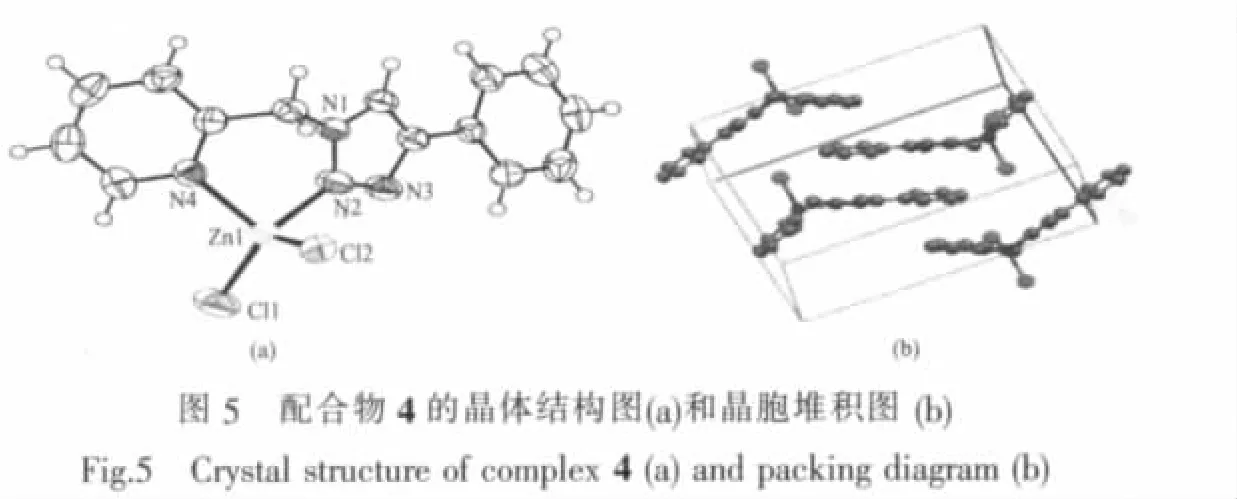
2.1.4 配合物[Zn(PTMP)Cl2](4)分子结构
在锌的配合物中,常见的配位数为4,5和6,其相应的立体构型为平面四边形或四面体、四方锥和正八面体。不同于上述其他3个配合物,配合物4中的Zn(Ⅱ)采取了4配位的方式,它仅与1个PTMP配体发生了作用,同时与另外2个氯离子配位,形成了变型四面体构型。在这个变形四面体中,来自配体中吡啶氮原子、三唑环上N2原子构成了其中2个顶点,而另外2个顶点则由配位氯离子构成。4的晶胞中含有4个[Zn(PTMP)Cl2]结构单元,分子间存在较强的π-π堆积作用。每个配合物单元中的三唑环4-位取代苯环所在的平面与邻近配合物单元中的吡啶环所在平面的二面角为8.86°,边对面距离为 0.3295 nm,两环间质心距为 0.3626 nm;与另一个相邻配合物分子中三唑环所在平面的夹角为14.75°,两环间质心的距离为 0.367 9 nm。
2.2 配体PTMP配位前后的结构对比
由图6及表4可知,虽然在本文所合成的4个配合物中,PTMP均与金属形成了六元螯合环,其船式构象也没有改变,但是对于每个配合物而言,由于中心金属的配位数不同,导致配合物的键长和键角产生了微小差异。其中在配合物1~3中,其中心金属(Co(Ⅱ)或Ni(Ⅱ))的配位数为6,均采用了八面体的空间构型,具有相似的结构。由于配体中参与螯合的2个氮原子并不等价,导致了配合物分子内氮原子-金属配位键(N-M)键长的差异,并引起赤道平面发生形变,成为平行四边形而非正八面体中的正方形,但是八面体中两顶点与中心金属形成的键角仍然保持了180°,因此畸变程度并不大。在4中,中心金属Zn(Ⅱ)的配位数为4,其几何构型为四面体,相对于正四面体而言,同样由于配体中配位氮原子的不等价效应,使得四面体发生了畸变,两顶点与中心金属形成的键角,最大值达到120°而最小值仅为 109.34°,与标准正四面体的 109.5°相比,均发生了一定程度的偏移。

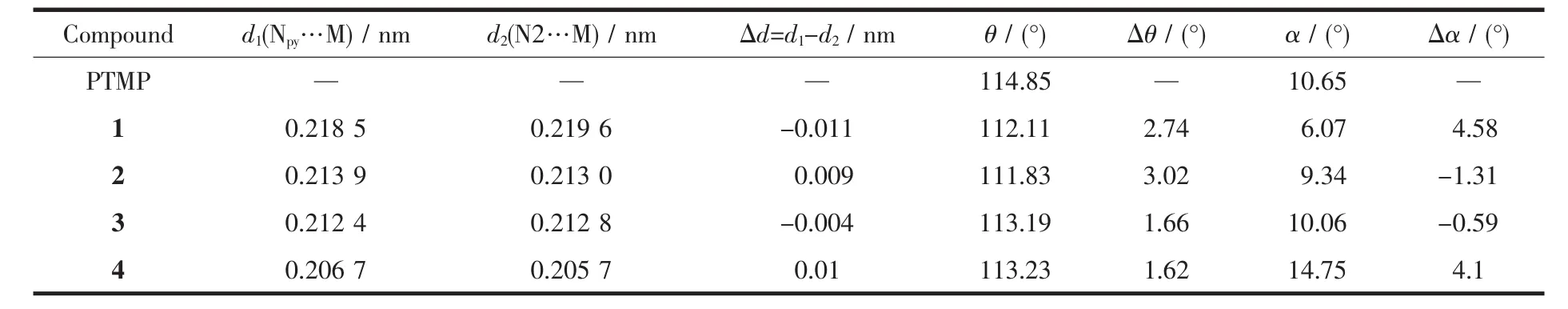
表4 配合物1~4与配体的结构参数对照表Table 4 Structure difference between PTMP and complex in 1~4
另外,在1~4中,配体中三唑环上的N2原子的配位能力与分子中另外1个吡啶氮原子相比,相差较小(键长的变化范围在±0.001 nm之间),有时甚至表现了比吡啶氮原子更强的配位能力。所有配合物的桥连角θ与未配位前的PTMP相比,均有所减小;三唑环4-位取代苯环发生了不同程度的旋转(二面角差值 Δα 在 6°到 14.5°之间),说明配体具有一定的柔性,在与不同金属配位时,其结构可以发生不同程度的旋转和扭曲,以适应不同的立体几何构型。而且配体与金属作用的强弱,尤其是其结构中N2原子与金属配位的强弱,除与金属本身有关以外,还受到辅助配体(如N3-等)的影响;在不同的辅助配体共同作用下,N2原子的配位能力有可能发生改变,这为以后合成具有不同结构和不同功能的含 1,4-二取代-1,2,3-三唑配体的配位化合物,并进行超分子自组装,提供了一条新的思路。
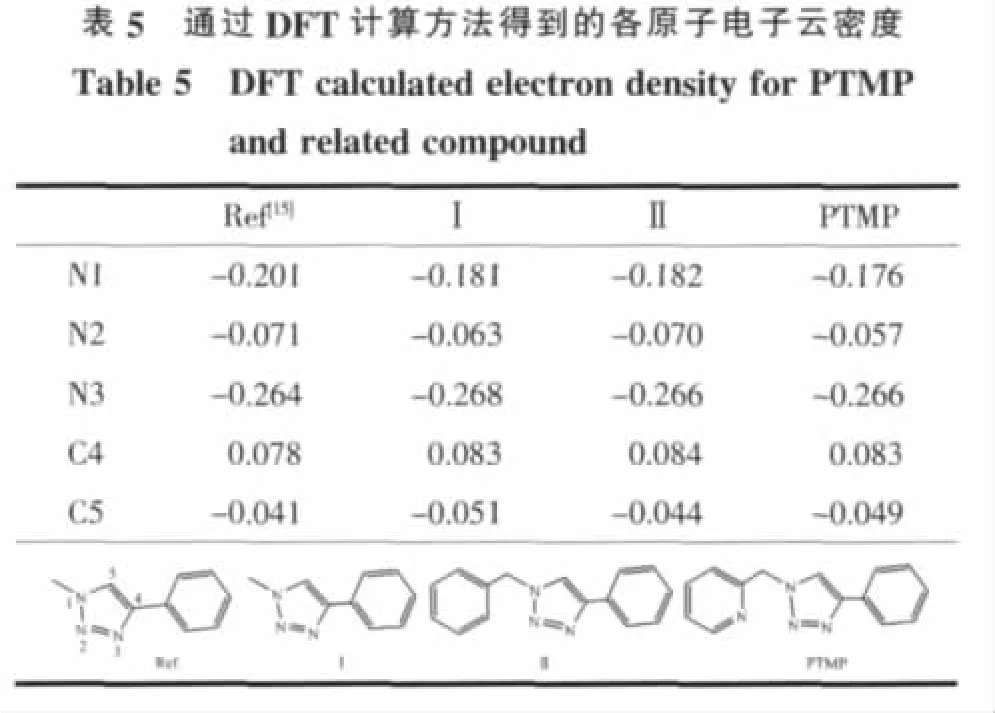
2.3 配体中三唑环原子的电子云密度分布
文献[15]曾报道,1,2,3-三唑环中 N2 原子的电子云密度明显低于N3原子,因此,N2原子并不是理想的配位点,一些实验结果也证实了这一点[5,15-16]。为此,参照文献[15]中的计算方法[17],本文计算了PTMP及其类似物的电子云密度分布,相应结果见表5。为了使计算结果与文献[15]具有可比性,我们选择了文献报道的化合物(1-甲基-4-苯基-1,2,3-三唑)作为参照物(表5中的Ref为文献计算结果,Ⅰ为本工作计算结果),通过比较可以发现本文的计算结果与文献报道尽管有一定的差异,但电子云密度变化的总体趋势与文献[15]保持一致。可见1,2,3-三唑环上N2原子的电子云密度相对较低,如果仅从计算结果来看,N3原子应该表现出更强的配位能力,但在上述配合物中均为N2原子参与配位,并没有出现N3原子参与配位的情况。基于以上结果,我们推测这是由于螯合效应导致2位氮原子的配位能力增强所致。
3 结 论
本文合成了一系列基于2-(4-苯基-1,2,3-三唑)亚甲基吡啶(PTMP)配体的过渡金属镍、钴和锌配合物,并利用单晶衍射方法确定了它们的结构。虽然理论计算结果显示,其分子中1,2,3-三唑环的N2原子与N3原子相比具有较低的电子云密度,但由于螯合效应的影响,N2原子的配位能力得到了显著增强,表现出较强的配位能力。这为以后设计合成具有不同结构及不同功能的基于1,2,3-三唑配体的功能配合物提供了一条新的思路。
[1]Gavrilova A L,Bosnich B.Chem.Rev.,2004,104:349-384
[2]Kolb H C,Finn M G,Sharpless K B.Angew.Chem.Int.Ed.,2001,40:2004-2021
[3]Himo F,Lovell T,Hilgraf R,et al.J.Am.Chem.Soc.,2005,127:210-216
[4]Lutz J F.Angew.Chem.Int.Ed.,2007,46:1018-1025
[5]Mindt T L,Struthers H,Brans L,et al.J.Am.Chem.Soc.,2006,128:15096-15097
[6]Happ B,Friebe C,Winter A,et al.Chem.-Asian J.,2009,4:154-163
[7]Schulze B,Friebe C,Hager M D,et al.Dalton Trans.,2009:787-794
[8]Crowley J D,Bandeen P H.Dalton Trans.,2010,39:612-623
[9]Li Y J,Huffman J C,Flood A H.Chem.Commun.,2007:2692-2694
[10]van Assema S G A,Tazelaar C G J,Bas de Jong G,et al.Orgnometallics,2008,27:3210-3215
[11]Schuster E M,Botoshansky M,Gandelman M.Angew.Chem.Int.Ed.,2008,47:4555-4558
[12]Struthers H,Spingler B,Mindt T L,et al.Chem.Eur.J.,2008,14:6173-6183
[13](a)Crowley J D,Bandeen P H,Hanton L R.Polyhedron,2010,29:70-83(b)FU Yang(傅 杨),DUAN Tai-Nan(段泰男),LI Hua(李桦),et al.6th National Conference on Coordination Chemistry(第六届全国配位化学会议论文集).Hongkong:[s.n.],2009.101
[14]Donnelly P S,Zanatta S D,Zammit S C,et al.Chem.Commun.,2008:2459-2461
[15]Maisonial A,Serafin P,Trakia M,et al.Eur.J.Inorg.Chem.,2008:298-305
[16]Beyer B,Ulbricht C,Escudero D,et al.Organometallics,2009,28:5478-5488
[17]Frisch M J,Trucks G W,Schlegel H B,et al.Gaussian 09,Revision A.02,Gaussian,Inc.,Wallingford CT,2009.
The Synthesis and Crystal Structure of Transition Metal Complexes Based on 2-[(4-Phenyl-1,2,3-triazole)methyl]pyridine
FU Yang LIU Yan ZHONG Cheng LI Hua CHEN Xing-Guo*QIN Jin-Gui
(Department of Chemistry and Hubei Key Laboratory on Organic and Polymeric Opto-Electronic Materials,Wuhan University,Wuhan 430072)
In this paper a series of transition metal(Co,Ni,Zn)complexes based on a ligand,2-[(4-phenyl-1,2,3-triazole)methyl]pyridine(PTMP),has been reported.The crystal structure of the complexes is determined by single crystal X-ray diffraction.It is found that PTMP coordinates to the metal via Npyatom of pyridine group and N2 atom of 1,2,3-triazole unit to form a six-member chelating ring.The coordination number of Co(Ⅱ) and Ni(Ⅱ) complexes is 6 with distorted octahedron geometry,but Zn(Ⅱ)adopts distorted tetrahedron geometry with a coordination number of 4.From the crystal structural data and DFT calculation it can be inferred that the “chelating effect” enhances the coordination ability of N2 atom in 1,2,3-triazole group of PTMP even though it has lower electron density than N3 atom.This suggests that coordination of 1,4-subsititued-1,2,3-triazole ligand with different metals will afford an effective approach to construct new coordination supramolecular architectures or synthesize new functional coordination materials.CCDC:759810,1;767939,2;767940,3;767941,4.
1,2,3-triazole;transition metal complex;synthesis;crystal structure
O614.81+2;O614.24+1
A
1001-4861(2010)07-1133-08
2010-03-05。收修改稿日期:2010-04-27。
国家自然科学基金资助项目(No.20774071)。
*通讯联系人。E-mail:xgchen@whu.edu.cn
傅 杨,男,26岁,博士研究生;研究方向:有机光电材料、功能配合物。
