白云石与氟磷灰石的浸出过程热力学
2010-09-13李军旗
黄 芳,王 华,李军旗
(1.贵州大学 材料与冶金学院,贵州 贵阳 550003;2.昆明理工大学 冶金与能源工程学院,云南 昆明 650093)
白云石与氟磷灰石的浸出过程热力学
黄 芳1,2,王 华2,李军旗1
(1.贵州大学 材料与冶金学院,贵州 贵阳 550003;2.昆明理工大学 冶金与能源工程学院,云南 昆明 650093)
根据化学位图绘制基本原理和方法,分析了 Mg2+-Ca2+-H2CO3-H2O、CaCO3·MgCO3-SO2-4-H2O、Ca2+-F--H3PO4-H2O、Ca5(PO4)3F-SO2-4-H2O和Mg2+-H3PO4-H2O体系在常温下的热力学平衡,研究了Ca-Mg-P-H2SO4体系在常温下的溶液-矿物溶解、沉积条件,形象、直观地描述了该溶液体系化学平衡条件及反应进行的限度,为磷矿选矿和湿法浸出过程提供理论依据。结果表明:硫酸可以促进白云石和氟磷灰石的溶解,溶解产物主要是Mg2+、H3PO4,其次是 H2PO-4,固相产物主要是硫酸钙晶体;氟磷灰石溶解过程中产生的磷酸在酸性条件下不与溶出的Mg2+反应形成Mg3(PO4)2。
白云石;氟磷灰石;浸出;热力学;
镁是湿法磷酸工业中最重要的杂质元素之一,而脱除胶磷矿中的MgO是一个技术难题,因为含镁矿物白云石的表面性质与磷矿物的表面性质差异较小,胶磷矿嵌布粒度又非常细,目前是通过各种选矿方法获取磷精矿。对国内某重要磷矿浮选尾矿的研究发现,其表面几乎检测不出有镁存在,镁主要“包裹”在矿物颗粒内部,这增大了回收磷、镁的难度;镁的物相主要是白云石(占87%左右)和氟磷灰石(占9%左右)。高镁磷矿和高镁磷尾矿大多采用酸法浸出,所用硫酸廉价易得,流程、设备简单,且在高效分离钙、镁和制造钙镁磷肥中具有无比的优越性。因此,研究了白云石和氟磷灰石在硫酸体系中的热力学平衡,并讨论了溶液、矿物溶解和沉积现象。
P.Somasundaran[1]曾研究了磷灰石-方解石-白云石(纯化学组成)与溶液的化学平衡;邵绪新[2]研究了胶磷矿与白云石分离的溶液化学,分析 了 Fe2+-H3PO4-H2O、Ca2+-H3PO4-H2O、Mg2+-H3PO4-H2O、Ca2+-H2CO3-H3PO4-H2O、Mg2+-H2CO3-H3PO4-H2O、Ca2+-H2CO3-H2O、Mg2+-H2CO3-H2O等体系的热力学平衡。在前人工作基础上,利用可靠的热力学数据,根据化学位图绘制基本原理和方法[3],在研究Mg2+-Ca2+-H2CO3-H2O和Ca2+-F--H3PO4-H2O体系基础上,探讨了CaCO3·和体系中各组分浓度与p H的关系,得到相应的热力学稳定图,并形象、直观地描述了体系化学平衡条件及反应进行的限度,确定了平衡体系中某种组分的优势,为磷矿选矿和湿法浸出过程研究提供理论依据。
1 热力学稳定图的理论依据
化学位图是热力学研究的有力工具。对于在水溶液中进行的化学反应,通常用 E-p H图来阐明各组分在水溶液中的稳定性,但由于磷矿的溶解反应是一个复分解反应,反应过程不涉及电子得失,分析浸出过程时,E-p H图的纵轴实际并没有起作用,而体系中组分离子的浓度变化才能体现矿物溶解的特征,因此,采用热力学稳定图来分析各体系的热力学。
绘制热力学稳定图最通用的办法是根据水溶液热力学计算原理[4],考虑一定体系中可能发生的各类基本反应,分别写出反应的化学平衡方程式、标准反应自由能变化的热力学计算式,绘制组分浓度对数-p H图,从而得到体系的热力学稳定图。
热力学平衡通式可表达为:

反应在常温下的平衡条件为:
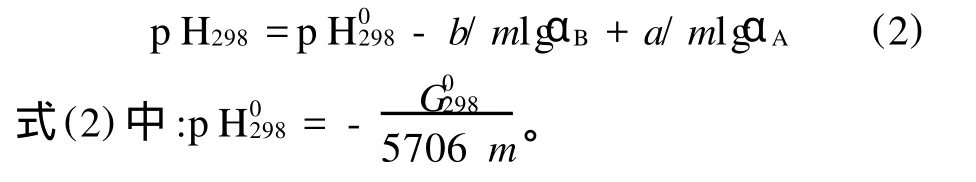
2 CaCO3·MgCO3-H2SO4-H2O体系分析
从分析Mg2+-Ca2+-H2CO3-H2O系热力学平衡出发,研究对该水溶液体系平衡的影响,以平衡常数、吉布斯自由能的变化等数据为依据讨论白云石的溶解过程。
2.1 Mg2+-Ca2+-H2CO3-H2O系
根据体系可能存在的化学反应,按等溶解离子浓度作用,绘制Mg2+-Ca2+-H2CO3-H2O体系稳定图,如图1所示。可以看出,CaCO3·MgCO3在酸性溶液中的溶解度最大,酸性越强,溶解度越大,并分别以Mg2+和Ca2+存在于溶液中;而在碱性溶液中,以络合阳离子Mg(OH)+或Ca(OH)2·Mg(OH)2形式存在。
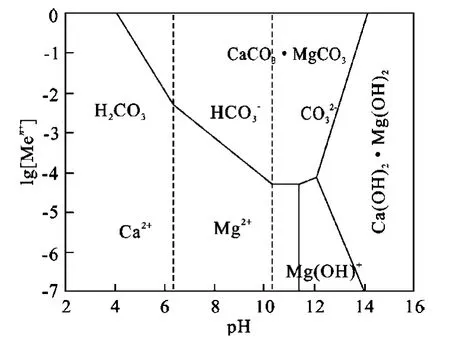
图1 Mg2+-Ca2+-H2CO3-H2O系热力学平衡图
将热力学数据代入式(2),以溶解的离子活度的对数对p H作图,得热力学稳定图。需要指出的是,这里以溶液离子的浓度近似代替其活度。
由于浸出体系中形成的硫酸钙晶体可以呈3种水合结晶形态与溶液处于平衡状态,即CaSO4·2H2O、CaSO4·H2O 和 CaSO4,使得浸出体系的溶液化学十分复杂[5]。为了简化分析过程,在绘制热力学稳定图时,均假定形成的是CaSO4·2H2O(因为实际生产中常用二水物法)。
2.2 CaCO3·MgCO3-SO--H2O系
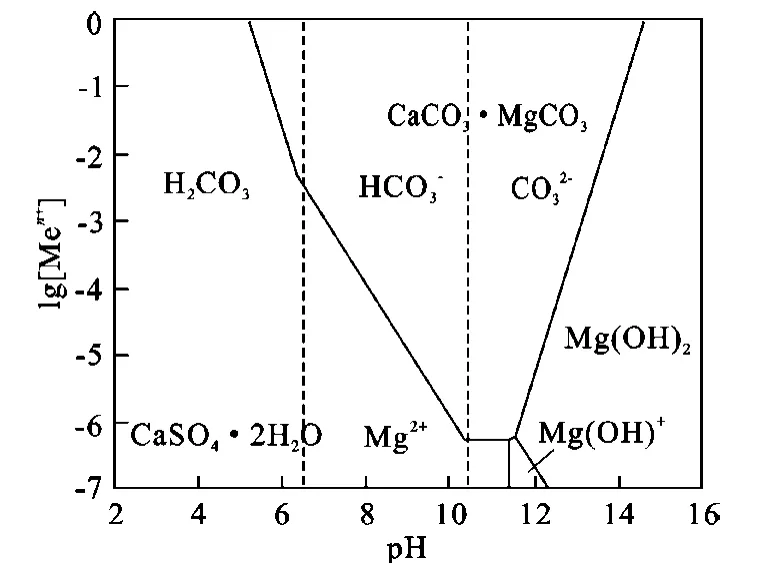
图2 CaCO3·MgCO3-SO--H2O系热力学平衡图
3 Ca5(PO4)3F-H2SO4-H2O体系分析
从分析Ca2+-F--H3PO4-H2O系热力学平衡出发,研究对该水溶液体系平衡的影响,以平衡常数、吉布斯自由能的变化等为依据讨论氟磷灰石的溶解过程。
3.1 Ca2+-F--H3PO4-H2O系
根据体系可能存在的化学反应,以等溶解离子浓度作图,得 Ca2+-F--H3PO4-H2O体系稳定图,如图3所示。
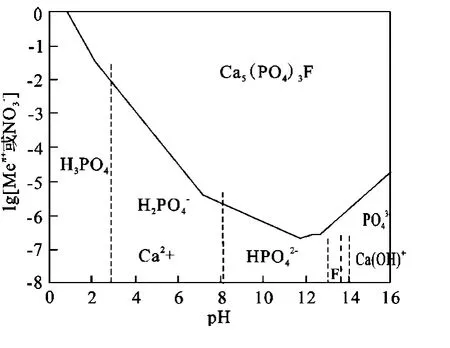
图3 Ca2+-F--H3PO4-H2O系热力学平衡图
可以看出,Ca5(PO4)3F在酸性溶液中的溶解度最大,酸性越强,溶解度越大,并以Ca2+形式存在于溶液中;而在碱性溶液中,以络合阳离子Ca(OH)+或阴离子F-存在。
3.2 Ca5(PO4)3F-SO--H2O系
根据体系可能存在的化学反应,以等溶解离子浓度作图,得Ca2+-F--H3PO4-H2O体系稳定图,如图4所示。可以看出,的存在,极大地增加了氟磷灰石在酸性溶液中的溶解度;溶解度随酸度增大而减小;钙主要以CaSO4·2H2O形式存在于溶液中。
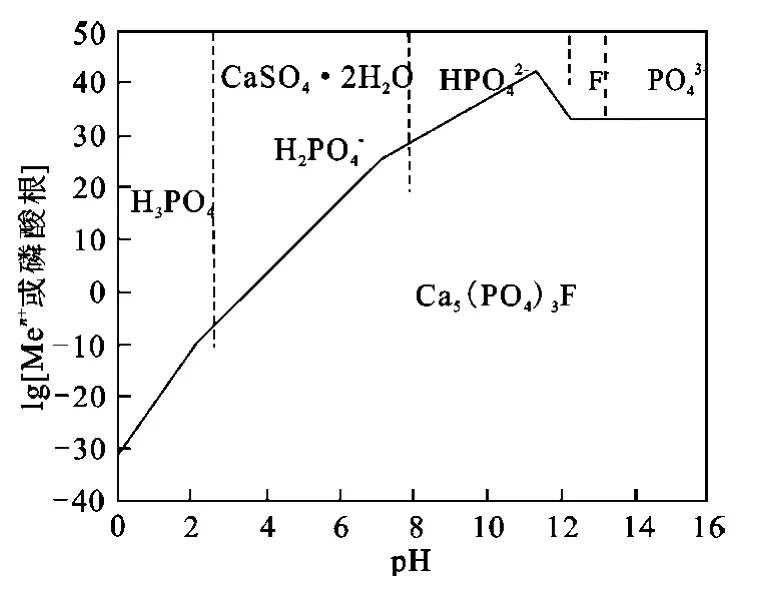
图4 Ca5(PO4)3F-SO--H2O系热力学稳定图
硫酸的加入促进了白云石的溶解,溶解产物主要是Mg2+和CaSO4·2H2O;同时也促进了氟磷灰石的溶解,溶解产物主要是 H3PO4、H2PO-4和CaSO4·2H2O。因此,磷矿在硫酸溶液中的溶解产物液相主要是 Mg2+和 H3PO4、H2PO-4溶液,固相主要为CaSO4·2H2O。所以,进一步研究Mg2+和 H3PO4溶液体系的分离条件,就可以解决中低品位磷矿的综合利用问题。
4 Mg2+-H3PO4-H2O体系分析
由于磷矿中的氟磷灰石在酸溶过程中会产生H3PO4,矿物的酸浸过程实际上处于硫酸和磷酸的混酸体系中,因此,CaCO3·MgCO3-H2SO4-H2O系和Ca5(PO4)3F-H2SO4-H2O系不能够完全反映实际情况,有必要对CaCO3·MgCO3-H2SO4-H3PO4-H2O系进行研究。需要说明的是,氟磷灰石在硫磷混酸体系中发生的反应可从Ca5(PO4)3F-H2SO4-H2O系获知,因此,这里不再累述Ca5(PO4)3F-H2SO4-H3PO4-H2O系。
白云石中的镁在酸作用下以 Mg2+形式溶出,而CaCO3·MgCO3-H2SO4-H2O系没有反映磷酸的作用,所以,研究CaCO3·MgCO3-H2SO4-H3PO4-H2O体系的关键是研究 Mg2+-H3PO4-H2O体系。
根据体系可能存在的化学反应,以等溶解离子浓度作图绘制 Mg2+-H3PO4-H2O体系稳定图,如图5所示。可以看出,与氟磷灰石相比,Mg3(PO4)2的溶解度要大得多:在酸性溶液中,Mg2+不易形成Mg3(PO4)2,而是以Mg2+形式存在;在碱性溶液中,Mg2+容易与发生反应形成Mg3(PO4)2;在高碱性区形成 Mg(OH)+或Mg(OH)2。也就是说,随溶解过程中磷酸的产生,高镁磷尾矿中的镁以Mg2+形式溶出,不会与 H3PO4反应形成Mg3(PO4)2。

图5 Mg2+-H3PO4-H2O系热力学稳定图
5 结论
1)硫酸可以促进白云石和磷灰石的溶解,溶解产物液相主要是 Mg2+、H3PO4溶液,其次是;固相产物主要是硫酸钙的结晶水合物。
2)磷灰石溶出过程中产生的磷酸在酸性条件下对溶出的 Mg2+没有影响,不会形成Mg3(PO4)2。
3)白云石和磷灰石的溶解极其溶解产物受溶液p H值影响。
[1]Somasundaran P.Mineral-Solution Equilibria in Sparingly Soluble Mineral System[J].Colloids and Surfaces,1985(15):309-333.
[2]邵绪新.胶磷矿浮选化学——胶磷矿和白云石的捕收与抑制[D].北京:中国矿业大学,1990:72-83.
[3]李自强,何良惠.水溶液化学位图及其应用[M].成都:成都科技大学出版社,1991:52-172.
[4]傅崇说.冶金溶液热力学原理与计算[M].北京:冶金工业出版社,1989:320-389.
[5]无机化学编写组.无机化学[M].北京:人民教育出版社,1978:27-29.
Abstract:According to basic principles and methods of drawing chemical potential graph,the phenomena of solution-mineral dissolution and precipitation are researched by analyzing the thermodynamic equilibriumsof Mg2+-Ca2+-H2CO3-H2O,CaCO3andsystemsatnormaltemperature.Thechemical equilibrium conditions and dissolving limit of systems have been discussed.The results show that H2SO4as acid solvent can accelerate the dissolving of dolomite and phosphorite,dissolving products are Mg2+,H3PO4and H2PO-4in the liquid and solid of CaSO4.At the acid conditions,Mg2+leached does not react with phosphoric acid from phosphorite’s leaching to form Mg3(PO4)2.Key words:dolomite;phosphorite;leaching;thermodynamics
Leaching Thermodynamics of Dolomite and Phosphorite
HUANG Fang1,2,WANG Hua2,LI Jun-qi1
(1.Materials and Metallurgical College,Guizhou University,Guiyang,Guizhou 550003,China;2.Faculty of Metallurgical and Energy Engineering,Kunming Univ.Sci.Technol.,Kunming,Yunnan 650093,China)
TF111.3
A
1009-2617(2010)02-0084-04
2009-12-18
贵州省科学技术基金资助项目(编号:黔科合J字[2007]2182号),教育部春晖计划资助项目。
黄芳(1975-),女,贵州贵阳人,博士研究生,副教授,主要研究方向为冶金物理化学。
