不同瑞士乳杆菌发酵牛乳产肽的比较研究
2010-09-13卢姗姗张少辉高艳玲付丽娜
殷 捷,卢姗姗,张少辉,2,高艳玲,付丽娜,2,*
(1.上海交通大学农业与生物学院,上海 200240;2.上海交通大学陆伯勋食品安全中心,上海 200240)
不同瑞士乳杆菌发酵牛乳产肽的比较研究
殷 捷1,卢姗姗1,张少辉1,2,高艳玲1,付丽娜1,2,*
(1.上海交通大学农业与生物学院,上海 200240;2.上海交通大学陆伯勋食品安全中心,上海 200240)
为了从3株瑞士乳杆菌(JCM1120、CICC6024和实验室保存菌株L0906)中筛选出1株产肽丰富的瑞士乳杆菌作为后续实验用菌株。采用水解度、pH值、小肽含量3个指标设计实验。结果表明:产酸能力最强的菌株CICC6024在相同发酵过程中最大水解度明显高于其他菌株;菌株CICC6024和菌株JCM1120的小肽含量在发酵时间16h处达到最大,菌株L0906的发酵活性较为缓慢,在发酵时间28h尚未达到顶峰;另外小肽的反相液相色谱峰图显示,菌株16h时CICC6024菌对应的20mAU以上的小肽峰多达19个。通过比较,最后选定CICC6024菌株作为后续实验用菌株,发酵时间为16h。
瑞士乳杆菌;pH值;水解度;小肽含量
Abstract :Three Lactobacillus helveticus strains (JCM1120, CICC6024 and L0906) were individually used to ferment fat-free milk powder. During 30 hours of fermentation, the changes in degree of hydrolysis (DH), pH and number of small peptides were examined periodically. The results indicated that CICC6024 strain had the strongest acid-producing ability and resulted in the highest maximum DH and the contents of small peptides in milk fermented by Lactobacillus helveticu CICC6024 and JCM1120 both reached their maximum amounts at 16 h; however, the fermentation activity of L0906 strain was relatively lower and still did not reach the peak at 28 h. In addition, 19 peaks with height of more than 20 mAU were observed in the RP-HPLC profile of the 16 h fermentation product of stain CICC6024. These investigations suggest that CICC6024 is an optimal strain for the production of small peptides derived from fermented milk and the optimal fermentation period is 16 h.
Key words:Lactobacillus helveticu;pH;degree of hydrolysis;content of small peptides
乳蛋白肽链分子中存在多种生物活性片段(肽类),这些片段虽在母体蛋白质中未显示出活性,但是经特定方式水解游离出来后就可以显示出不同的生物学活性。迄今,已发现了多种来源于乳蛋白的生物活性肽,如抗血栓肽、抗高血压肽、抗氧化肽、免疫调节肽等[1]。通常,获取乳蛋白源活性肽有两种方式:一是酶解方式,即利用消化道酶以及植物或微生物来源的蛋白酶水解乳蛋白,获取乳蛋白源活性肽:二是利用微生物(如乳酸菌)的蛋白酶系发酵乳蛋白来获取乳蛋白源活性肽。瑞士乳杆菌可以将完整的乳蛋白水解进而释放许多生物活性肽和氨基酸,然后借助其细胞中特定的运输系统将氨基酸、二肽、三肽和一些寡肽(不超过18个氨基酸)运送进入胞内(这些小肽往往对人体的免疫系统也有促进作用),以满足自身生长所需的氮源,而剩余的寡肽则会残留于乳中[2]。
研究发现,不超过20个氨基酸的小肽对人体的免疫系统具有促进作用[3],换算到小肽的分子质量来说也就是最多不能超过3kD,因此本实验探索发酵牛乳中分子质量小于3kD的小肽含量与牛乳水解度以及pH值之间的关系,找出发酵牛乳产肽较多的瑞士乳杆菌并确定其最适的发酵条件,为后续实验提供依据。
1 材料与方法
1.1 材料与试剂
脱脂乳粉 新西兰Fonterra公司。
L-leucine(GS0045)、三硝基苯磺酸(TNBS) 美国Sigma公司;NaDodSO4国药集团化学试剂公司;Agilent SC-18色谱柱(4.6mm×150mm,3.5μm) 美国Agilent公司;乙腈 美国Fisher公司;超滤膜(分子质量3kD和10kD)、超纯水 美国Millipore公司;其他试剂均为分析纯。
1.2 菌种与培养基
3株瑞士乳杆菌:CICC6024 广东菌种保藏中心;JCM1120 中国农业微生物菌种保藏管理中心;L0906实验室保存菌株。
MRS液体培养基(每升):蛋白胨5g、牛肉膏10g、酵母膏5g、磷酸二氢钾2g、柠檬酸铵2g、乙酸钠5g、硫酸镁0.58g、硫酸锰0.25g、葡萄糖20g、吐温-80 1mL,调节pH6.2~6.4。
1.3 仪器与设备
UV-2550紫外分光光度计(配有UVProbe数据处理软件) 日本Shimadzu公司;AKTA purify10(配有可变波长紫外检测器和UNICORN 5.11数据处理软件) 美国GE公司;PHS-3D型pH计 上海智光仪器有限公司;GL-22M高速冷冻离心机 上海卢湘仪离心机仪器有限公司;Amicon 8400超滤器 美国Millipore公司。
1.4 方法
1.4.1 发酵牛乳的制备
分别将3株菌在MRS液体培养基中活化3代后按照体积分数2%的接种量接种到质量浓度12g/100mL的脱脂乳中活化两代直到菌种活力完全恢复[4]。然后按照2%的接种量接种到12g/100mL脱脂乳中摇匀后分装到15mL灭菌塑料管中,40℃摇床发酵,根据之前做过的瑞士乳杆菌生长曲线按0~28h内每隔2h为一个时间点,取样;每个时间点取3个样品做平行。
1.4.2 pH值测定
采用pH计直接测定不同菌株发酵脱脂乳不同时间的pH值。
1.4.3 牛乳水解度(DH)测定
参照Adler-Nissen[5]采用的TNBS法测定牛乳的水解度。用质量浓度0.1g/100mL的TNBS测定水解液中游离α-NH2的含量来测定牛乳的水解度。游离的α-NH2浓度从L-leu(亮氨酸)标准曲线上读出。实验中得出的标准曲线是y=0.37994x+0.01228,r=0.99829。
1.4.4 反相色谱(reverse phase chromatogram,RPC)法测定发酵上清中的小肽含量
不同发酵时间的样品分别用30g/100mL的(NH4)2SO4沉淀后4℃、8000r/min离心10min取上清,然后将上清液依次通过10、3kD的超滤膜[6]。选用Agilent SC-18色谱柱,以乙腈和水的混合液进行梯度洗脱,乙腈的体积分数以4%/min的速率从2%变化到100%,流速1mL/min,取上述滤液进行反相色谱分离。滤液中的小肽按照亲水性大小依次从柱子中洗脱下来,在215nm波长处记录吸收峰。使用谱线峰的面积积分反映小肽的含量[7]。
2 结果与分析
2.1 3株瑞士乳杆菌菌株对中乳水解度的影响
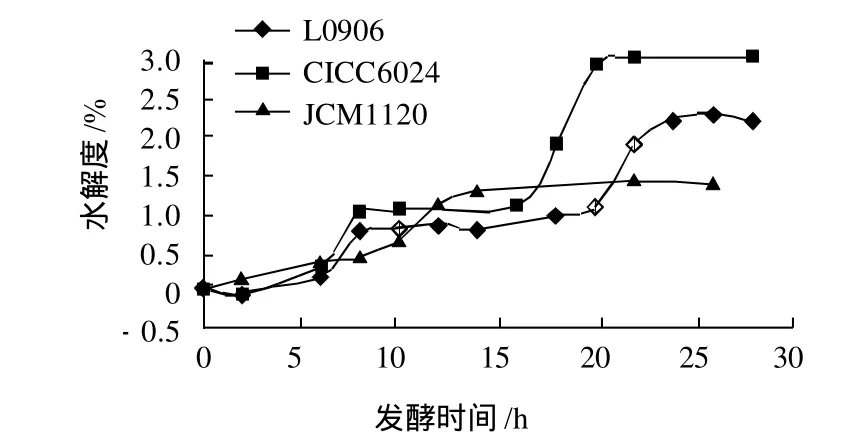
图1 3株菌对牛乳水解度随发酵时间的变化Fig.1 Change in DH of at-free milk during fermentation by L0906,CICC6024 or JCM1120
如图1所示,3株菌对应的水解度曲线的线性基本是一致的,菌株CICC6024在相同发酵过程中对牛乳的最大水解度明显高于其他两株菌,最大水解度为3%,而JCM1120和L0906分别为1.4%和2.2%。由此说明CICC6024水解脱脂乳的能力较强。
2.2 牛乳水解度与产酸能力之间的关系

图2 3株菌发酵脱脂乳pH值随发酵时间的变化Fig.2 pH change of fat-free milk during fermentation by L0906,CICC6024 or JCM1120
由图2可知,乳杆菌发酵牛乳会将乳糖水解成乳酸从而使pH值降低,一开始pH值下降的较为缓慢,到达一定的时间迅速下降,这一点在CICC6024菌上表现的特别明显。结合图1可知,发酵14h之后CICC6024菌的pH值相对较低,水解度较大。说明产酸能力在一定程度上可以反映其水解能力。但是并不能得出产酸能力强产肽能力就必定强的结论,王宇等[8]研究发现,乳酸菌的产酸能力只是发酵能力的一个必要非充分条件,就是说发酵能力强的菌株通常也具有强的产酸能力。
2.3 牛乳水解度与分子质量3kD以下小肽含量的关系
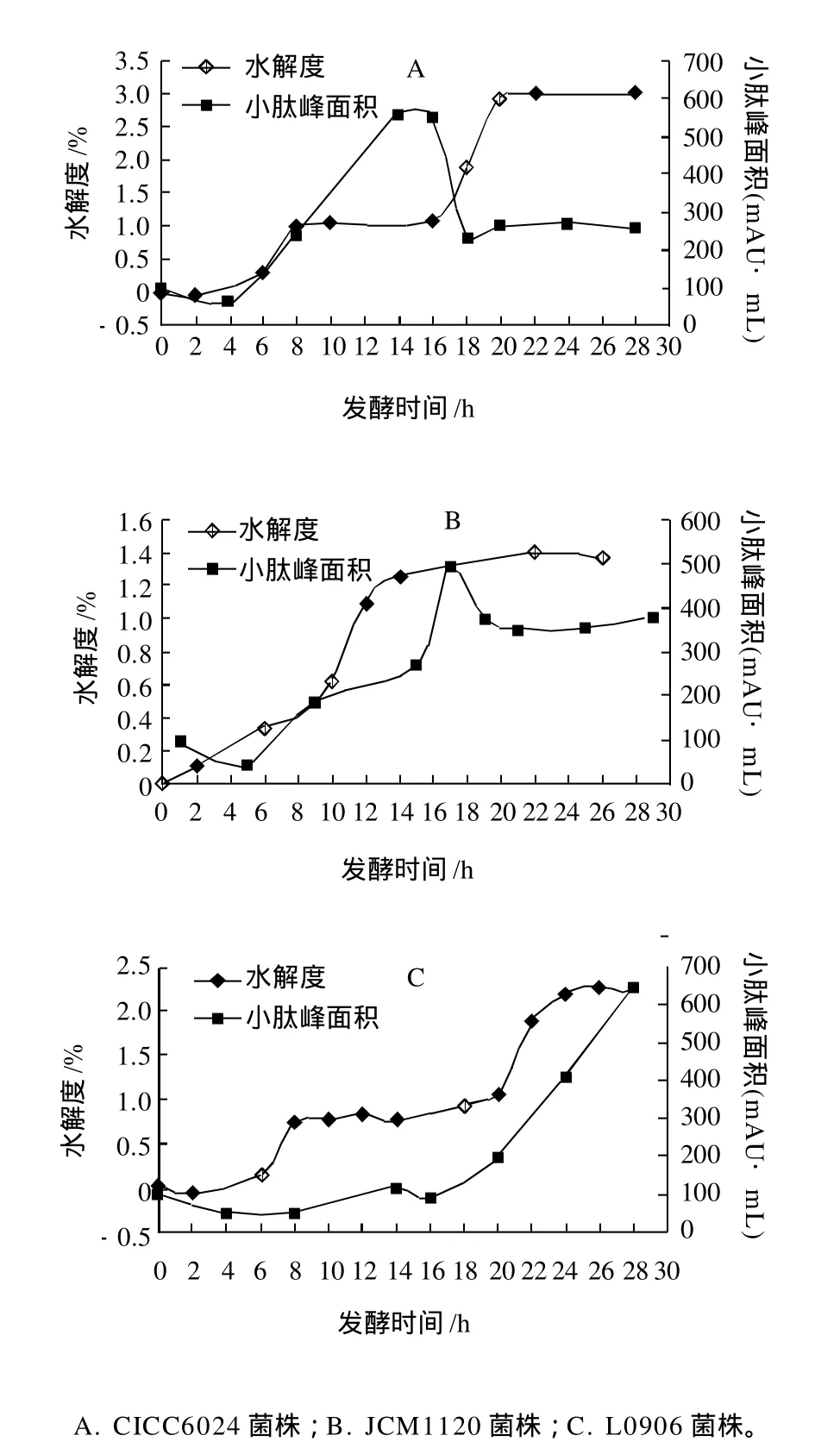
图3 3种菌发酵脱脂乳水解度和产肽量随发酵时间的变化Fig.3 Change in DH and content of small peptides in fat-free milk during fermentation by L0906, CICC6024 or JCM1120
从图3可以看出,CICC6024菌和JCM1120菌的小肽峰面积都在16h处达到最大,之后呈下降趋势,而此刻的水解度并未到达最大,由此推断活性小肽多在菌株的对数期和稳定期的前期产生,而且这些小肽可能是菌株生长所必需的原料[2],因此在发酵的后期这些小肽的峰面积会有所下降。而L0906菌发酵脱脂乳产肽速率相对太慢,在前24h小肽的峰面积都保持较低的水平,基于生产工艺以及工业化生产成本的考虑,拒绝产肽较多但发酵速率最慢的L0906菌。最终选取产肽能力强且发酵速率快的CICC6024菌作为发酵牛乳产肽的发酵菌株,发酵时间为16h。
2.4 不同发酵时间3株瑞士乳杆菌发酵产肽分析
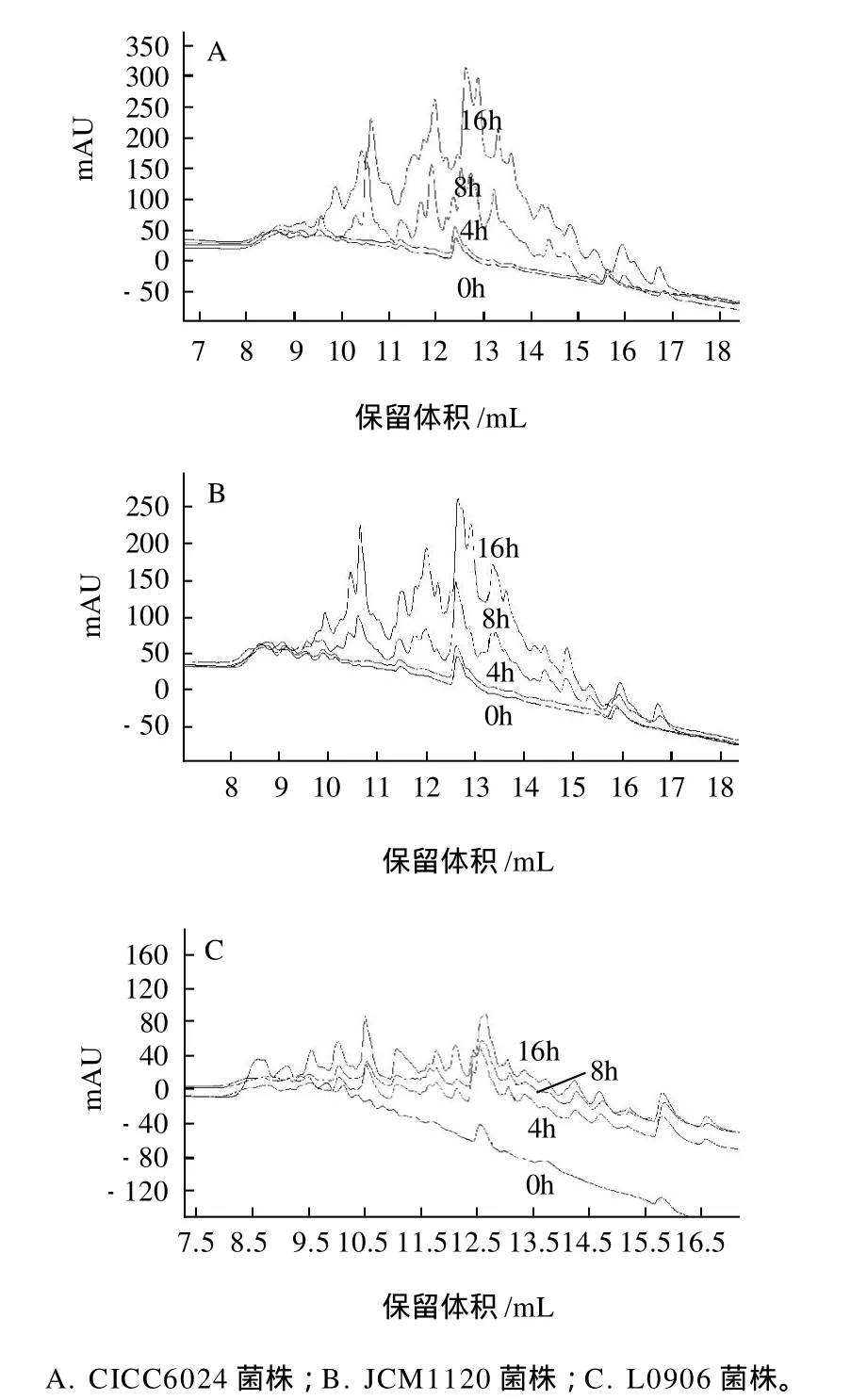
图4 CICC6024、JCM1120、L0906菌柱在不同发酵时间的小肽反相液相色谱峰Fig.4 RP-HPLC chromatograms of fermentation products of CICC6024, JCM1120 and L0906 at 0, 4, 8 and 16 h
图4直观表明,随着发酵时间的延长,小肽峰高度和峰面积都在不断的提高,反映出16h之前CICC6024、JCM1120、L0906菌株发酵脱脂乳产生小肽的含量随发酵时间的延长而逐渐增多,并且3株菌小肽峰的个数也逐渐增多,这也反映了小肽的类型随发酵时间的延长逐渐丰富起来。
3 结 论
本研究发现,CICC6024和JCM1120菌株发酵牛乳产肽量都在16h处达到最大,其中产酸能力最强的CICC6024菌株其水解度也是最大的,在22h即可达到3%,而这比文献[9]中报道的乳杆菌的水解度1%~2%要高许多;L0906菌株的发酵活性较为缓慢,在28h尚未达到顶峰;另外小肽的反相液相色谱峰图显示,CICC6024菌株和JCM1120菌株以及L0906菌株的峰都较为复杂而且小肽类型随发酵时间增长而逐渐丰富起来。通过比较最后选定CICC6024菌株为后续实验所用菌株,发酵产肽时间定为16h。
功能性发酵乳制品的开发有着广阔的前景,长时间食用发酵乳制品如干酪、酸奶等对人体的免疫系统有良好的促进作用[10],而作为此领域研究者,必须选择那些发酵能力强的菌株,在选择发酵产肽能力强的乳酸菌时往往始于水解度以及产肽量的直接或间接测定[11],优先以产肽能力和水解度为筛选指标可以有效地提高筛选效率。本实验为后续实验筛选出了发酵菌株CICC6024菌。
[1] MEISEL H. Overview on milk protein-derived peptides[J]. International Dairy Joumal, 1998, 8(5): 363-373.
[2] SCHEPERS A W, THIBAULT J, LACROIX C. Lactobacillus helveticus growth and lactic acid production during pH-controlled batch cultures in whey permeate/yeast extract medium. Part I. multiple factor kinetic analysis[J]. Enzyme and Microbial Technology, 2002, 30(2): 176-186.
[3] RUBAS W, GRASS G M. Gastrointestinal lymphatic absorption of peptides and proteins[J]. Advanced Drug Delivery Reviews, 1991, 7(1):15-69.
[4] RICCI G, FORTINA M G. Characterization of Lactobacillus helveticus strains isolated from cheeses by distribution studies of insertion sequences[J]. International Journal of Food Microbiology, 2006, 112(2): 112-119.
[5] ADLER-NISSEN J. Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J]. Journal of Agricultural and Food Chemistry, 1979, 27(6): 1256-1262.
[6] CHEISON S C, ZHANG Shaobing, WANG Zhang, et al. Comparison of a modified spectrophotometric and the pH-stat methods for determination of the degree of hydrolysis of whey proteins hydrolysed in a tangential-flow filter membrane reactor[J]. Food Research International, 2009,42(1): 91-97.
[7] MARTINEZ C, DELGADO M, POZOB D, et al. VIP and PACAP enhance IL-6 release and mRNA levels in resting peritoneal macrophages:in vitro and in vivo studies[J]. Journal of Neuroimmunology, 1998, 85(2): 155-167.
[8] 王宇, 田丰伟, 陈卫, 等. 乳酸菌发酵乳血管紧张素转化酶抑制活力的比较研究[J]. 食品与发酵工业, 2008, 34(2): 29-33.
[9] RASIC J, KURMAN J. Yogurt[M]. Copenhagen: Tedmology Dairy Publishing House, 1986: 1209-1245.
[10] de MORENO de LEBLANC A, MATAR C, THERIAULT C, et al.Effects of milk fermented by Lactobacillus helveticus R389 on immune cells associated to mammary glands in normal and a breast cancer model[J]. Immunobiology, 2005, 210(5): 349-358.
[11] PIRAINOA P, ZOTTA T. Acid production, proteolysis, autolytic and inhibitory properties of lactic acid bacteria isolated from pasta filata cheeses: A multivariate screening study[J]. International Dairy Journal,2008, 18: 81-92.
Production Comparison of Small Peptides in Milk Fermented by Different Strains of Lactobacillus helveticus
YIN Jie1,LU Shan-shan1,ZHANG Shao-hui1,2,GAO Yan-ling1,FU Li-na1,2,*
(1. School of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240, China;2. Bor S. Luh Food Safety Research Center, Shanghai Jiao Tong University, Shanghai 200240, China)
TS252.1
A
1002-6630(2010)15-0186-04
2009-12-21
国家“863”计划项目(2008AA10Z329)
殷捷(1985—),男,硕士研究生,研究方向为发酵乳制品的免疫活性。E-mail:jack.yin.sjtu@gmail.com
*通信作者:付丽娜(1980—),女,讲师,博士研究生,研究方向为发酵乳制品的免疫活性。E-mail:fln1980@126.com
