双孢蘑菇多酚氧化酶交联作用对酪蛋白乳化性及其稳定性的影响
2010-09-13吴进菊高金燕陈红兵
吴进菊,高金燕,刘 潇,程 伟,陈红兵,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学 中德联合研究院,江西 南昌 330047;3.南昌大学生命科学与食品工程学院,江西 南昌 330047)
双孢蘑菇多酚氧化酶交联作用对酪蛋白乳化性及其稳定性的影响
吴进菊1,2,高金燕1,3,刘 潇1,2,程 伟1,2,陈红兵1,2,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学 中德联合研究院,江西 南昌 330047;3.南昌大学生命科学与食品工程学院,江西 南昌 330047)
利用双孢蘑菇多酚氧化酶(PPO)对酪蛋白进行交联,考察交联后酪蛋白乳化性和乳化稳定性,并采用SDSPAGE电泳检测交联物的形成情况。结果表明:当PPO酶比活力为400U/mL,25℃反应4h时,交联后的酪蛋白乳化性和乳化稳定性分别为18.3m2/g和19.8min,较未交联的酪蛋白乳化性和乳化稳定性分别提高了17.3%和37.5%。交联后酪蛋白的乳化性和乳化稳定性得到显著提高,并且与形成的聚合物含量有着密切的关系。
双孢蘑菇多酚氧化酶;酪蛋白;交联;乳化性;稳定性
Abstract:Cross-linking of food proteins can modify their functional properties. Casein was cross-linked by polyphenol oxidase from Agaricus bisporus. The emulsifying capacity and emulsion stability of cross-linked casein were analyzed and SDS-PAGE was used to detect the amount of polymer formation. The emulsifying capacity and emulsion stability of cross-linked casein obtained after polyphenol oxidase treatment at 25 ℃ and an enzyme concentration of 400 U/mL for 4 h were 18.3 m2/g and 19.8 min, 17.3% and 37.5% higher than those of non-cross-linked casein, respectively. Such significant increments in both emulsifying properties might be tightly related to the amount of formed cross-linked casein.
Key words:Agaricus bisporus polyphenol oxidase;casein;cross-linking;emulsifying capacity;emulsion stability
对食物蛋白进行交联,可改善蛋白质的功能特性,如热稳定性、乳化性、凝胶特性、保水性、流变学特性等[1]。近年来,利用酶对蛋白进行交联引起了学者的广泛关注。可用于蛋白交联的酶主要有转谷氨酰胺酶、过氧化酶、多酚氧化酶等,它们可催化蛋白质形成分子内或分子间交联[1]。目前,研究最多和最深入的是转谷氨酰胺酶的交联作用[2-3],而多酚氧化酶对蛋白的交联作用研究相对较少。
多酚氧化酶(polyphenol oxidase,PPO,EC 1.14.18.1) 是一种含铜金属酶,普遍存在于各种植物、真菌和昆虫中。国外学者研究发现,PPO能催化多种蛋白发生交联反应,如小麦醇溶蛋白[4]、α-乳白蛋白[5]、β-乳球蛋白[5]、溶菌酶[5]、蚌类蛋白[6]、原胶原蛋白[7]、β-酪蛋白[8]和麸质[9]等,但是暂未发现对牛乳中全部酪蛋白进行交联的研究。目前,国内尚未见PPO交联食物蛋白方面的报道。本实验采用双孢蘑菇多酚氧化酶对酪蛋白进行交联,研究了PPO酶比活力、反应温度和时间对酪蛋白交联后乳化性和乳化稳定性的影响,旨在通过交联反应改善酪蛋白的乳化性和乳化稳定性。
1 材料与方法
1.1 材料
鲜牛奶 江西南昌阳光乳业有限公司;咖啡酸Sigma-aldrich公司;邻苯二酚、丙酮、磷酸氢二钠、磷酸二氢钠等试剂均为国产分析纯。
1.2 仪器与设备
Allegra 64R 高速冷冻离心机 美国Backman公司;中空纤维超滤器 北京市宣武超滤设备厂;TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;FJ-200 高速分散均质机 上海标本模型厂;PB-10 型酸度计 德国Sartorius公司。
1.3 方法
1.3.1 酪蛋白的制备
将鲜牛奶脱脂后用1mol/L HCl调pH值至4.6,40℃保温30min沉淀酪蛋白,将酪蛋白冷冻干燥后4℃保存备用。称取酪蛋白2g,加入0.1mol/L NaOH 20mL,60℃溶解后用0.1mol/L HCl调整溶液的pH值为7.0,最后用蒸馏水定容到100mL,即得0.02g/mL酪蛋白溶液。
1.3.2 PPO粗酶液的制备
将从市场上买来的新鲜双孢蘑菇去皮、切碎,放入研钵中,加入液氮,迅速用杵捣碎至无明显颗粒的粉末状。加入预冷丙酮(-20℃),用布氏漏斗进行抽滤,然后进行真空冷冻干燥,即得丙酮粉,-20℃保存备用。取冷冻干燥丙酮粉0.2g,加入10mL预冷(4℃)的0.05mol/L、pH 7.0磷酸盐缓冲液,磁力搅拌25~30min,7000r/min离心20min,上清液即为粗酶液[10]。
1.3.3 PPO交联对酪蛋白功能特性影响的实验方案
反应体系为1g/mL酪蛋白溶液,在酪蛋白溶液中加入100mmol/L咖啡酸使其终浓度为1mmol/L,然后加入PPO粗酶液,使酶与溶液比分别达到200、400、600、800U/mL和1000U/mL,最后补充蒸馏水使酪蛋白溶液终质量浓度为0.01g/mL,混匀,15~35℃分别反应1~8h后,80℃加热5min停止反应。冷却至室温后测定蛋白的乳化性和乳化稳定性,对照不加酶液。
1.3.4 酪蛋白乳化性和乳化稳定性的测定
反应条件同1.3.3节,结束后立即测定溶液的乳化性(EAI)和乳化稳定性(ESI)。采用Liu等[11]的方法并稍有改变:取反应混合物10mL,加入大豆色拉油3mL,然后以10000r/min高速均质2min,立即或10min后用微量吸液器从底部抽取乳状液10μL,与5mL 0.1% SDS混合,在分光光度计上500nm波长处测其吸光度。EAI(m2/g)和ESI (min)采用如下公式进行计算:

式中:T为2.303;C为乳化液形成前蛋白质水溶液中蛋白质量浓度/(g/mL);φ为乳化液中油的体积分数;A0为均质后迅速被稀释的乳化液的吸光度;A10min为乳化液在静止10min后的吸光度;t为时间(本实验是10min)。
1.3.5 PPO酶比活力测定
参照Gawlik-Dziki[12]等的方法,用0.05mol/L、pH7.0磷酸盐缓冲液配制0.04mol/L邻苯二酚溶液,取2.8mL邻苯二酚溶液,加入0.2mL粗酶液,混匀后在420nm波长处比色,酶液加入后开始计时,每30s记录1次OD420nm随时间的变化值,以最初直线段的斜率计算酶比活力。一个酶活力单位定义为在测定条件下,每分钟引起光密度值改变0.001所需的酶量。
1.3.6 交联聚合物的SDS-PAGE电泳检测[13]
在酪蛋白溶液中加入100mmol/L咖啡酸使其终浓度为1mmol/L,然后加入PPO粗酶液,使酶与溶液比为400U/mL,最后补充蒸馏水使酪蛋白溶液终浓度为0.01g/mL,混匀,25℃分别反应1~8h后,80℃加热5min停止反应。取10μL样品加入等体积的上样缓冲液,煮沸3~5min后取4μL上样。采用5%的浓缩胶和15%的分离胶,浓缩胶中10mA 电泳20min,分离胶中30mA电泳50min左右。电泳完毕采用Quantity One软件对蛋白条带进行光密度扫描分析,对蛋白质含量进行相对定量。
蛋白条带相对含量=条带的平均光密度(OD)×条带面积/mm2。
2 结果与分析
2.1 PPO酶比活力对交联后酪蛋白乳化性和乳化稳定性的影响
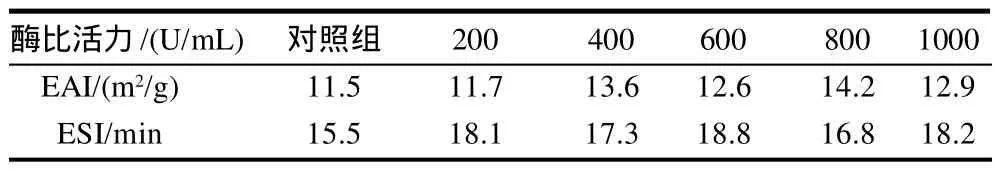
表1 PPO酶比活力对交联后酪蛋白乳化性和乳化稳定性的影响Table 1 Effect of PPO activity on emulsifying activity and emulsion stability of cross-linked casein
由表1可知,交联后酪蛋白的乳化性和乳化稳定性较对照组均有所提高。当酶比活力为400U/mL和800U/mL时,酪蛋白乳化性相对较高,分别为13.6m2/g和14.2m2/g,对照组仅为11.5m2/g。当酶比活力为600U/mL时,酪蛋白乳化稳定性最高,达到了18.8min,其次为酶比活力为200U/mL和1000U/mL时,酪蛋白的乳化稳定性分别为18.1min和18.2min,而对照组为15.5min。
2.2 反应温度对交联后酪蛋白乳化性和乳化稳定性的影响
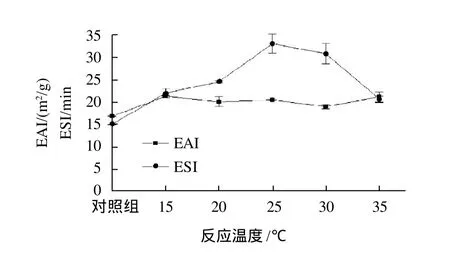
图1 反应温度对交联后酪蛋白乳化性和乳化稳定性的影响Fig.1 Effect of temperature on emulsifying activity and emulsion stability of cross-linked casein
由图1可知,在15~35℃的范围内,交联后酪蛋白的乳化性和乳化稳定性均比对照组高。反应温度对交联后酪蛋白乳化性的影响不太明显。反应温度为30℃时酪蛋白乳化性最小,为19.0m2/g,其他反应温度下酪蛋白乳化性变化较小,均在20.5m2/g左右,而对照组酪蛋白的乳化性仅为16.8m2/g。反应温度在15~25℃的范围内,随着温度的升高,酪蛋白的乳化稳定性逐渐升高,25℃时达到最高,为32.9min。当反应温度高于25℃时,酪蛋白的乳化稳定性随着温度的升高而降低,35℃时仅为20.6min,但仍比对照组(15.1min)高很多。
2.3 反应时间对交联后酪蛋白乳化性和乳化稳定性的影响
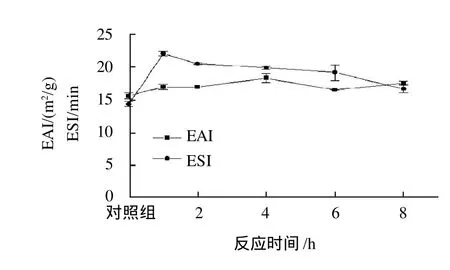
图2 反应时间对交联后酪蛋白乳化性和乳化稳定性的影响Fig.2 Effect of incubation time on emulsifying activity and emulsion stability of cross-linked casein
将反应混合物置于25℃分别反应1、2、4、6h和8h,考察反应时间对交联后酪蛋白乳化性和乳化稳定性的影响,结果如图2所示。反应时间在1~4h范围内,随着时间的增加,酪蛋白乳化性也随之增加,在4h时达到最高,为18.3m2/g;而在4~8h内,酪蛋白的乳化性先减小后增加,但交联后酪蛋白的乳化性均比交联前高。在1~8h范围内,酪蛋白的乳化稳定性随着反应时间的增加而减少。反应1h的酪蛋白乳化稳定性最高,达到了22.0min,而反应8h的酪蛋白乳化稳定性最小,为16.7min。
因此,当PPO酶比活力为400U/mL、25℃反应4h时,交联后的酪蛋白乳化性和乳化稳定性分别为18.3m2/g和19.8min,与未交联的酪蛋白相比较,乳化性和乳化稳定性分别提高了17.3%和37.5%。另外,通过t检验可知,在此反应条件下,交联前后酪蛋白的乳化性差异显著(P<0.05),乳化稳定性差异极显著(P <0.01)。
2.4 聚合物含量对酪蛋白乳化性和乳化稳定性的影响
采用SDS-PAGE电泳观察反应时间对酪蛋白交联的影响(图3),并对聚合物进行光密度扫描分析,结果如图4所示。在1~4h范围内,随着反应时间的延长,酪蛋白相对含量逐渐减少,聚合物相对含量逐渐增多。而在4~8h范围内,随着反应时间的延长,酪蛋白含量和聚合物含量反而有所降低。而从2.3节分析中可知,在相同的交联条件下,反应时间在1~4h范围内,随着时间的增加,酪蛋白乳化性也随之增加,在4~8h内,酪蛋白的乳化性呈先减小后增加的趋势,而酪蛋白的乳化稳定性在1~8h范围内随着反应时间的增加而减少。由此可知,交联后酪蛋白的乳化性和乳化稳定性与形成的聚合物的含量有着密切的关系,但并不是一个简单的线性关系。
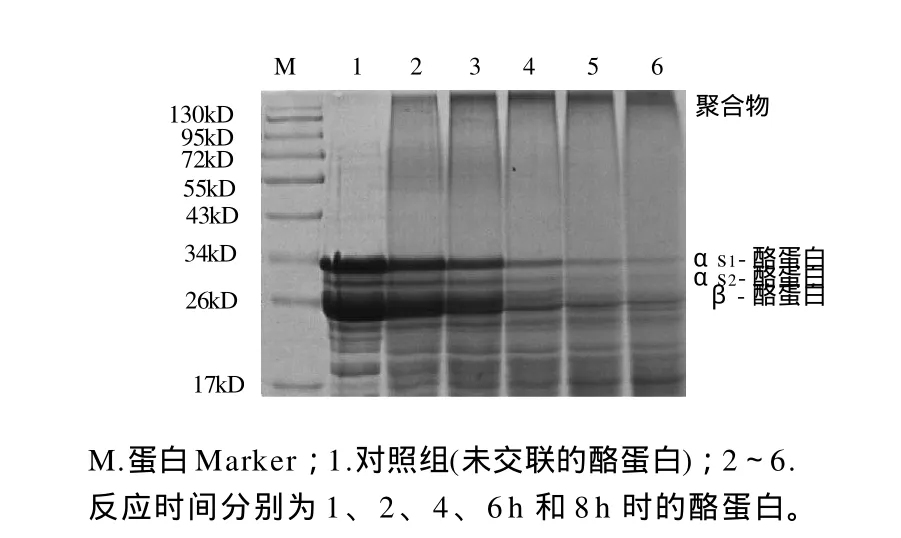
图3 反应时间对酪蛋白交联的影响Fig.3 Effect of incubation time on cross linking of casein

图4 反应时间对酪蛋白和聚合物相对含量的影响Fig.4 Effect of incubation time on casein and polymer formation
3 结 论
通过调节PPO酶比活力、反应温度和时间,可以提高交联后酪蛋白的乳化性和乳化稳定性。当PPO酶比活力为400U/mL,25℃反应4h时,交联后的酪蛋白乳化性和乳化稳定性分别为18.3m2/g和19.8min,较未交联的酪蛋白乳化性和乳化稳定性分别提高了17.3%和37.5%,并且交联后酪蛋白的乳化性和乳化稳定性与形成的聚合物的含量有着密切的关系。
[1] 吴进菊, 高金燕, 陈红兵. 转谷氨酰胺酶交联作用对乳蛋白功能特性的影响[J]. 食品科学, 2007, 28(10): 601-604.
[2] FVRGEMAND M, MURRAY B S, DICKINSON E, et al. Crosslinking of adsorbed casein films with transglutaminase[J]. Int Dairy J,1999, 9: 343-346.
[3] MARTIN P B, MANFRED H, SABINE L, et al. Yoghurt gel formation by means of enzymatic protein cross-linking during microbial fermentation[J]. Food Hydrocolloid, 2007, 21: 585-595.
[4] TAKASAKI S, KAWAKISHI S, MURATA M, et al. Polymerisation of gliadin mediated by mushroom tyrosinase[J]. L W T, 2001, 34(8): 507-512.
[5] THALMANN C R, LOTZBEYER T. Enzymatic cross-linking of proteins with tyrosinase[J]. Eur Food Res Technol, 2002, 214: 276-281.
[6] BURZIO L A, BURZIO V A, PARDO J, et al. in vitro Polymerization of mussel polyphenolic proteins catalyzed by mushroom tyrosinase[J].Comp Biochen Phys B, 2000, 126: 383-389.
[7] DABBOUS M K. Inter-and intramolecular cross-linking in tyrosinasetreated tropocollagen[J]. J Biol Chem, 1966, 241(22): 5307-5312.
[8] MONOGIOUDI E, CREUSOT N, KRUUS K, et al. Cross-linking of[beta]-casein by Trichoderma reesei tyrosinase and Streptoverticillium mobaraense transglutaminase followed by SEC-MALLS[J]. Food Hydrocolloid, 2009, 23 (7): 2008-2015.
[9] TILLEY K A, BENJAMIN R E, BAGOROGOZA K E, et al. Tyrosinase cross-links: molecular basis of gluten structure and function[J]. J Agric Food Chem, 2001, 49(5): 2627-2632.
[10] 吴进菊, 郭小英, 陈红兵, 等. 蛋白交联中多酚氧化酶的酶源筛选及酶学性质研究[J]. 食品科学, 2009, 30(23): 229-232.
[11] LIU Chun, WANG Xiansheng, MA Hao, et al. Functional properties of protein isolates from soybeans stored under various conditions[J]. Food Chem, 2008, 111(1): 29-37.
[12] GAWLIK-DZIKI U, ZLOTEK U, SWIECA M. Characterization of polyphenol oxidase from butter lettuce (Lactuca sativa var. capitata L.)[J]. Food Chem, 2008, 107(1): 129-135.
[13] 李建武. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1994:36-55.
Emulsify Capacity and Stability of Cross-linked Casein with Polyphenol Oxidase from Agaricus bisporus
WU Jin-ju1,2,GAO Jin-yan1,3,LIU Xiao1,2,CHENG Wei1,2,CHEN Hong-bing1,2,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China;3. School of Life Sciences and Food Engineering, Nanchang University, Nanchang 330047, China)
TQ93
A
1002-6630(2010)15-0117-04
2010-04-22
国家“863”计划项目(2006AA10Z324);江西省教育厅科学技术研究项目(GJJ09063);江西省研究生创新资金项目
吴进菊(1983—),女,博士研究生,研究方向为食品生物技术。E-mail:wujinju302@163.com
*通信作者:陈红兵(1967—),男,教授,博士,研究方向为食品生物技术。E-mail:chbgjy@hotmail.com
