日本大耳白黑眼兔在不同生长阶段蛋白质营养与肝脏相关基因表达的关系
2010-09-11吕建敏刘月环
吕建敏,刘月环
(1.浙江中医药大学动物实验研究中心,杭州 310053;
2.浙江省医学科学院浙江省实验动物动物中心,杭州 310013)
研究报告
日本大耳白黑眼兔在不同生长阶段蛋白质营养与肝脏相关基因表达的关系
吕建敏1,刘月环2
(1.浙江中医药大学动物实验研究中心,杭州 310053;
2.浙江省医学科学院浙江省实验动物动物中心,杭州 310013)
目的研究日粮粗蛋白水平和生长阶段对日本大耳白黑眼兔(WHBE兔)肝脏相关基因表达的影响。方法采用两因素实验设计,分别选取断奶和2月龄WHBE兔各20只进行为期1个月的幼兔期和育成兔期饲养实验,每个阶段实验均将兔随机分为5组,各组日粮粗蛋白水平分别为12%、14%、16%、18%和20%,实验结束,用实时荧光定量PCR技术测定肝脏胰岛素样生长因子-1(IGF-1)和磷酸烯醇式丙酮酸羧激酶-C(PEPCK-C)的mRNA的表达丰度。结果生长阶段和粗蛋白水平均对WHBE兔肝脏IGF-1mRNA的表达丰度有显著影响,育成兔期IGF-1 mRNA的表达丰度明显高于幼兔期;日粮粗蛋白水平为16%和18%时IGF-1mRNA表达丰度较高,显著高于其他3组。PEPCK-C mRNA的表达也以16%粗蛋白组最高,幼兔期和育成兔期之间差异无显著性。结论日粮粗蛋白水平对IGF-1和PEPCK-C基因表达有显著影响,生长阶段与IGF-1mRNA表达密切相关。
日粮;粗蛋白;生长阶段;WHBE兔;基因表达
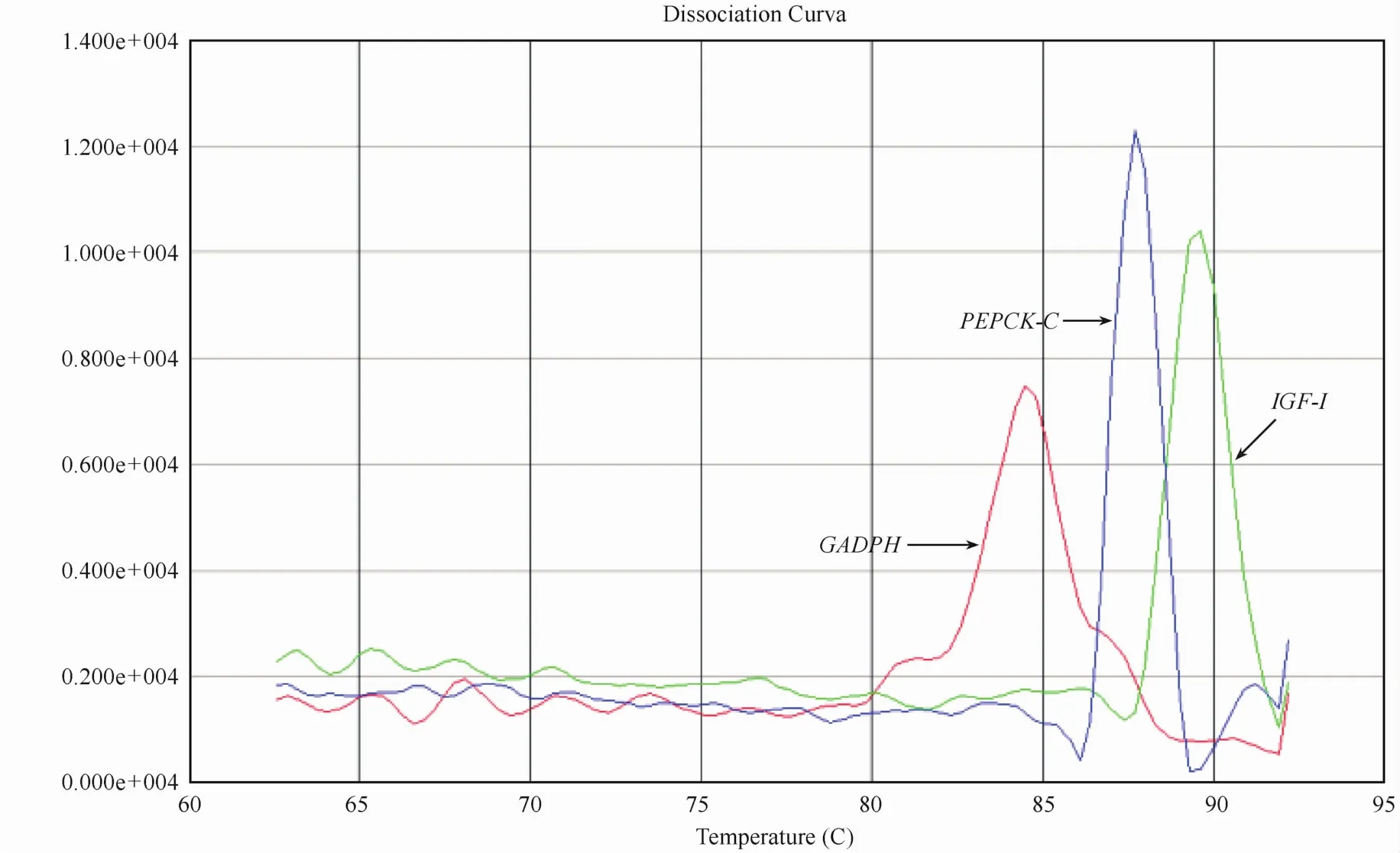
图2 IGF-I、PEPCK-C和GADPH cDNA real-time PCR 产物的熔解曲线Fig.2Melting curve analysis of IGF-I, PEPCK-C and GADPH real-time PCR amPlified Products
生物技术的飞速发展为营养学的深入研究提供了有力的保障,利用现代生物技术,可以使人们从分子水平去认识某些营养物质的作用机制,不仅能更准确地判断动物对某些营养物质的精确需要量,而且能深刻揭示它们的作用机理。近年来对营养与基因相互关系的研究已逐渐为人们所重视,主要体现在营养水平对调控代谢的相关酶和激素的基因表达影响研究。日本大耳白黑眼兔(WHBE兔)是浙江中医药大学动物实验研究中心培育的实验兔新品系,研究WHBE兔营养需要和相关功能基因表达关系,对于制定相应饲养标准,合理配制日粮,完善WHBE兔的系统研究具有积极作用。本文从蛋白质营养入手,选取了与蛋白质代谢相关的两种基因肝脏胰岛素样生长因子-1(IGF-I)mRNA和磷酸烯醇式丙酮酸羧激酶-C(PEPCK-C)mRNA,利用荧光定量PCR技术,研究不同日粮粗蛋白水平对WHBE兔肝脏IGF-I mRNA和PEPCK mRNA表达丰度的影响,以期从分子水平上得到不同生长阶段的WHBE兔对日粮粗蛋白的精确需要量,同时为蛋白质需要研究方法提供新的思路。
1 材料和方法
1.1 实验动物与分组
断奶和2月龄雄性WHBE兔各20只,体质量分别为800~1000 g和2000~2200 g,来源于浙江中医药大学动物实验研究中心【SCXK(浙)2005-0022】,用于幼兔和和育成兔的饲养实验。每阶段兔均饲养30 d,实验在浙江中药大学动物实验研究中心进行【SYXK(浙)2003-0004】,并按实验动物使用的3R原则给予人道的关怀。
将幼兔和育成兔均随机分为5组,每组4只,分别饲喂含12%、14%、16%、18%和20%粗蛋白的日粮,各组饲料配方和营养水平见表1和表2。
实验结束,处死动物,迅速采集肝脏样本,液氮冷冻,待实验室分析用。
1.2 肝脏IGF-I和PEPCK-C基因表达分析
1.2.1 肝细胞总RNA的提取
(1)将肝脏组织在液氮中磨成粉末后,再以50~100 mg组织加入1 m L Trizol液研磨,样品总体积不能超过所用Trizol体积的10%。
(2)研磨液室温放置5 min,然后以每1 m L Trizol液加入0.2 m L的比例加入氯仿,盖紧离心管,用手剧烈摇荡离心管15 s。
(3)取上层水相于一新的离心管,按每m L Trizol液加0.5 m L异丙醇的比例加入异丙醇,室温放置10 min,12 000 g离心10 min。
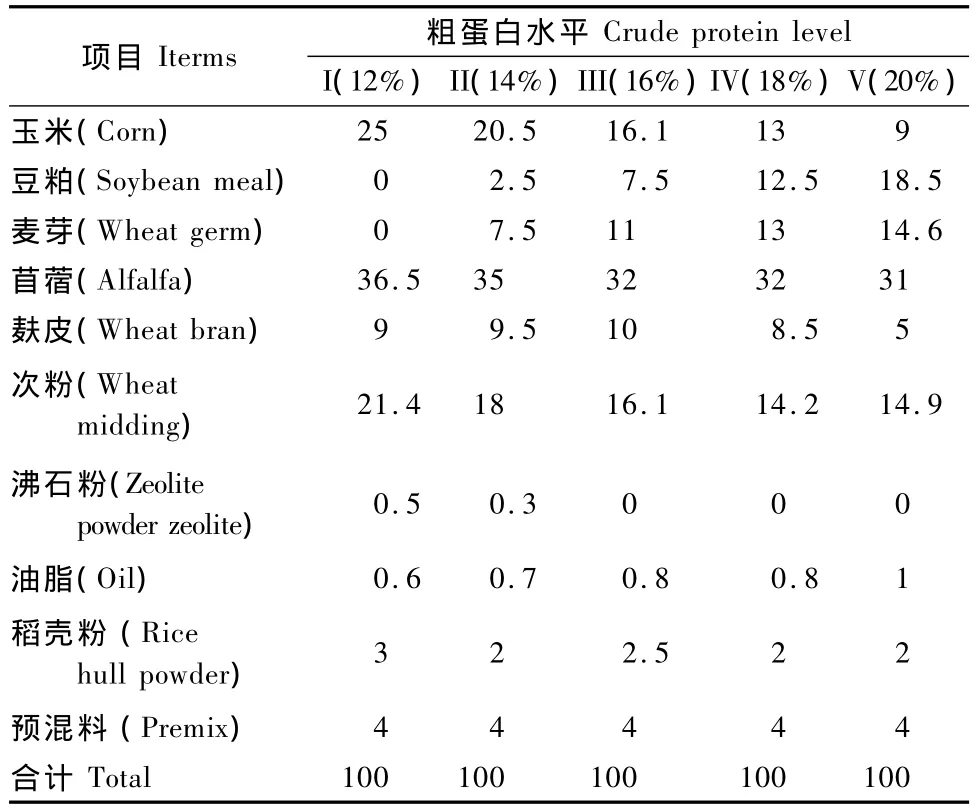
表1 日粮配方(风干基础)Tab.1 Composition of the experimental diets(air dry basis)
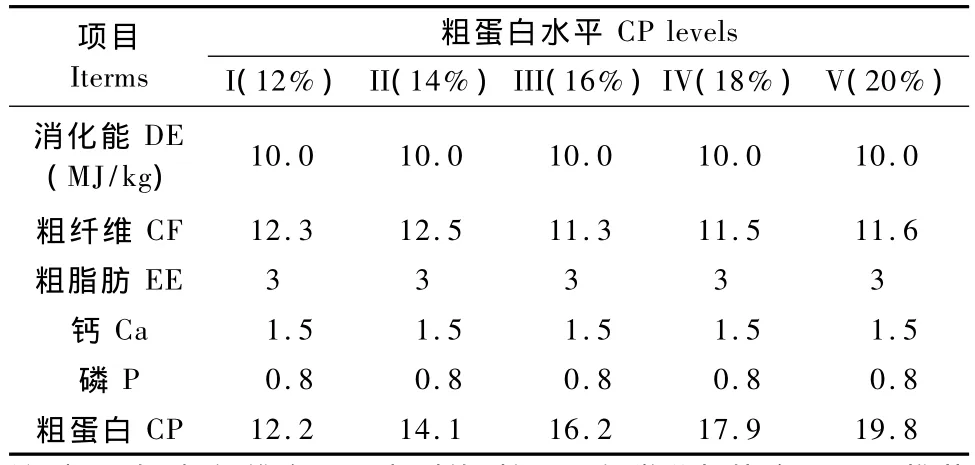
表2 日粮营养水平(风干基础)Tab.2 Nutrient levels of the experimental diets(air-dry basis)
(4)弃去上清液,按每m L Trizol液加入至少1 mL的比例加入75%乙醇,涡旋混匀,4℃下7500 g离心5 m in。
(5)小心弃去上清液,然后室温或真空干燥5~10 min,注意不要干燥过分,否则会降低RNA的溶解度。然后将RNA溶于无酶水中。
(6)使用核酸测定仪测定RNA的浓度,并根据A260/280值判断RNA的质量,实验所用样本都在1.8~2.0之间。
1.2.2 肝细胞总RNA的反转录:按Takara反转录酶试剂盒说明书进行反转录。
1.2.3 引物设计与合成:IGF-I和PEPCK-C的引物根据NCBI上登录的兔IGF-I序列(OCU75390)和PEPCK-C片段序列(EF616471)设计合成。内参GADPH的引物根据NCBI登录的兔GADPH序列(NM:001082253)设计合成。所有引物均由上海英骏生物技术有限公司合成。见表3。
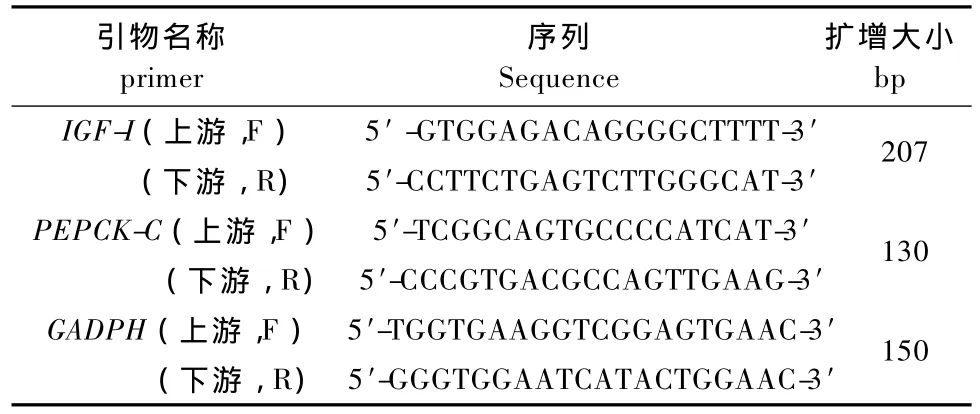
表3 IGF-I,PEPCK-C及GADPH的PCR引物序列表Tab.3 The PCR primers for IGF-I,PEPCK-C and GADPH
1.2.4 cDNA的荧光定量PCR:以SYBR Premix Ex TaqTM试剂建立20 μL反应体系,包括SYBR Green I荧光染料预混试剂10 μL、ROXⅡ0.4 μL、上游和下游引物(20 μmol/L)各0.25 μL、cDNA模板1 μL和双蒸去离子水8.1 μL。反应条件:①94℃预变性15 s;②94℃变性5 s,60℃退火和延伸34 s并采集荧光信号,共40个循环;③按仪器操作说明选择熔解曲线分析,60℃升至94℃,60℃保温1 min、94℃保温15 s,自动采集荧光。所用仪器为美国ABI公司生产的7500型real-time PCR检测系统(Applied Biosystems)。
1.3 统计分析
将mRNA表达量最低的一组(12%粗蛋白组)作为参照(对照组)。经内标基因均一化处理后,通过2-△△CT方法计算,目标基因表达差异通过其他粗蛋白水平组样本相对于对照组的样本的倍数来表示。即对于除对照组以外粗蛋白水平组的样本,相对于参照样本的基因表达倍数为2-△△CT。

采用SAS统计软件(1997)广义线性模型(GLM)进行两因素方差分析和显著性比较,多重比较采用Duncan法。
2 结果和分析
2.1 PCR产物电泳图及熔解曲线
由PCR产物的电泳图(图1)可见,目的基因(IGF-I和PEPCK-C)的片段和参比基因(GADPH)的片段大小都与设计扩增片段大小一致。Real-time PCR产物的熔解曲线见(图2,彩插6),IGF-1、PEPCK-C和GADPH熔解的Tm温度分别为89.3℃,87.7℃和84.8℃,其扩增片段的特异性峰表明引物设计与反应条件均适用于此定量PCR反应。PCR扩增产物的基因序列分析结果与GenBank中兔IGF-I,PEPCK-C的相应区域的同源性在98%以上,由此可以确认扩增所得序列片段即为目的基因序列。
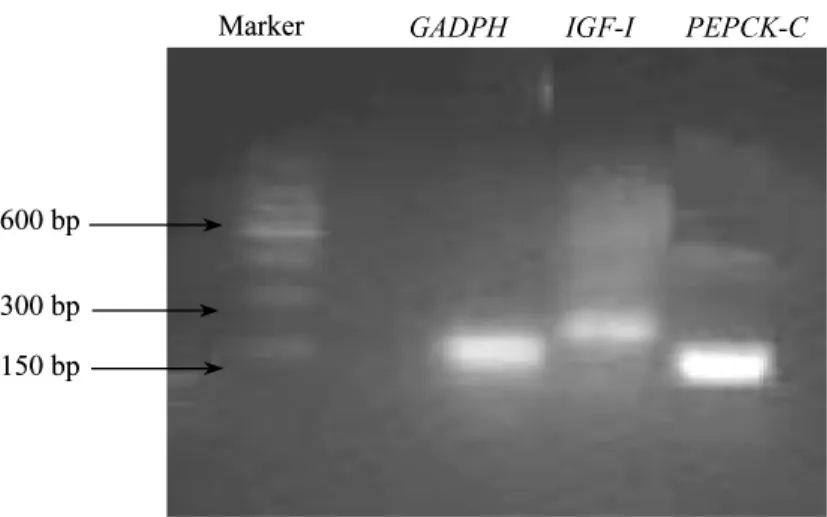
图1 IGF-I、PEPCK-C和GADPH cDNA PCR扩增产物电泳图谱Fig.1 Agarose gel electrophoresis of IGF-I,PEPCK-C and GADPH cDNA
2.2 肝脏IGF-I和PEPCK-C基因表达
幼兔期和育成兔期WHBE兔肝脏IGF-I mRNA和PEPCK-C mRNA表达结果见表4。
由表4可知,幼兔期和育成兔期WHBE兔肝脏IGF-I的基因表达丰度以16%和18%粗蛋白组最高,与其他3组差异有显著性(P﹤0.05)。不同生长阶段WHBE兔的肝脏IGF-Ⅰ基因表达存在显著差异,育成兔期明显高于生长期(P﹤0.05)。幼兔期和育成兔期WHBE兔PEPCK-C mRNA的表达随着日粮粗蛋白水平的变化趋势基本与IGF-I mRNA表达一致,以16%粗蛋白组最高,与12%粗蛋白组差异有显著性(P<0.05),但幼兔期和育成兔期间差异无显著性(P>0.05)。
3 讨论与结论
胰岛素样生长因子(IGF-I)是下丘脑-垂体-靶器官生长轴的终端,是生长激素启动生长活性的主要介导者,不仅反映动物的营养和生长状况,而且对免疫系统的发育和功能的维持可能具有重要意义[2]。Lemonzy等(1994)[3]发现蛋白质缺乏会导致大鼠肝、肾组织IGF-I mRNA表达下降。Kanamoto等(1994)[4]研究发现蛋白质的质量和数量均能影响大鼠肝组织IGF-I mRNA表达。Fukada等(2004)[5]和Pedroso等(2006)[6]在有关鱼类的实验中,都发现营养水平的提高可以提高IGF-I的基因表达。本实验结果表明:在16%、18%粗蛋白水平下幼兔期和育成兔期WHBE兔肝脏IGF-I mRNA表达峰度均高于其他水平,且12%粗蛋白水平下表达量最小,这与前人的研究结果一致。由于肝脏中IGF-I mRNA变化会直接影响血浆中IGF-I浓含量[7],McMurtry等(1997)[8]发现成年家禽血清中IGF-I含量要明显高于幼年家禽,本研究也发现,育成兔期WHBE兔IGF-1的基因表达丰度显著高于幼兔期,其原因还有待进一步研究。
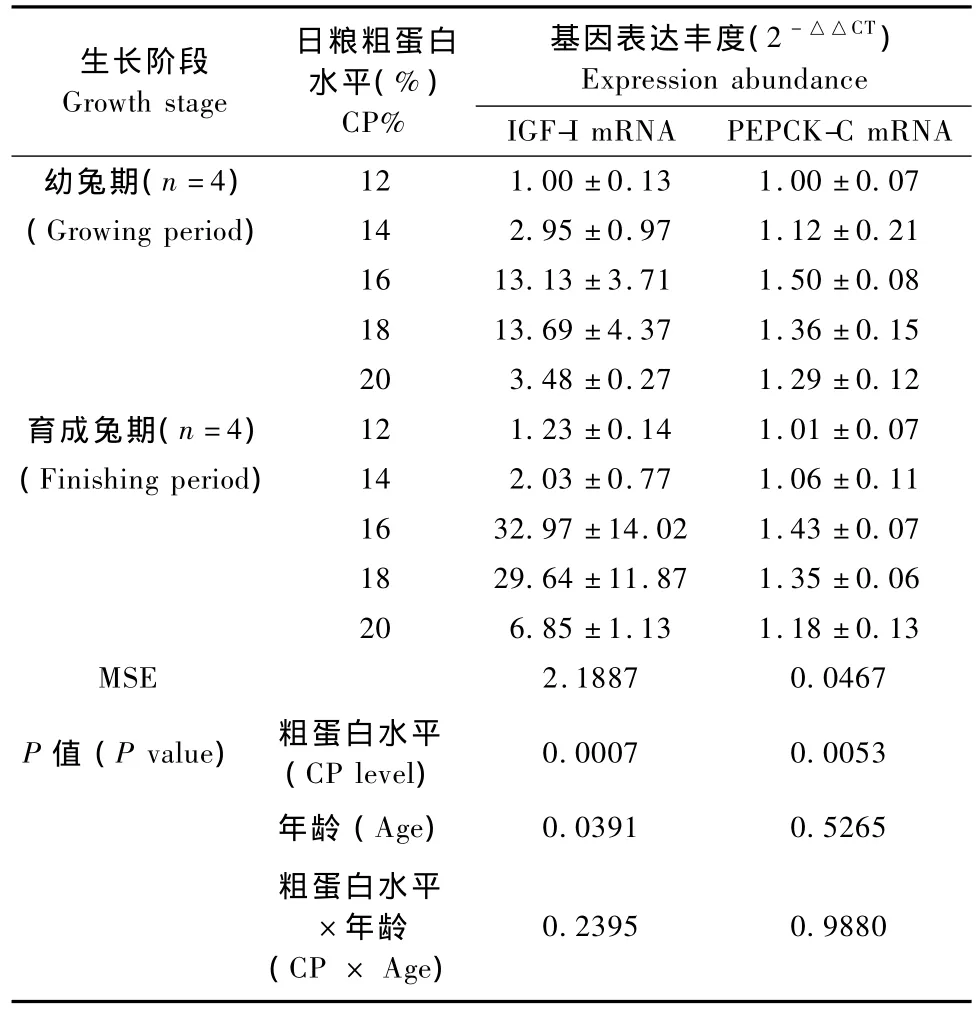
表4 幼兔期和育成兔期WHBE兔IGF-1和PEPCK-C基因表达丰度Tab.4 The expression abundance of IGF-1 mRNA and PEPCK-C mRNA during growing and finishing periods
PEPCK-C是糖异生作用的关键酶之一,PEPCK-C的酶活性与其mRNA的表达量呈显著相关。Lemaigre等(1994)[9]研究发现禁食或糖尿病会显著提高PEPCK的活性。Kirchner等(2003)[10]报道,日粮蛋白水平也会影响到肝脏PEPCK mRNA的表达,蛋白质采食量过低引起虹鳟鱼体内糖异生酶的基因表达水平的下降。陈伟健(2008)[11]研究发现补饲适量的菜粕,可明显提高湖羊肝脏PEPCK-C mRNA表达峰度,而过高蛋白补饲量则使表达峰度降低。从本研究结果看,幼兔期和育成兔期WHBE兔肝脏PEPCK-C mRNA的表达量都是在16%粗蛋白水平下达到最高,在12%粗蛋白水平下最低,且差异显著。这表明,适当的蛋白营养水平可以提高肝脏中PEPCK-C的基因表达量,但是水平过高的将失去这种作用。
综上所述,日粮粗蛋白水平对WHBE兔肝脏的IGF-1和PEPCK-C的基因表达均有显著影响,在16%~18%粗蛋白水平下表达丰度最大;育成兔期WHBE兔IGF-1的基因表达明显高于幼兔期;幼兔期和育成兔期WHBE兔的日粮适宜粗蛋白水平应在16%~18%。
结果表明,IGF-1和PEPCK基因都与日粮粗蛋白水平密切相关,表达丰度与日粮粗蛋白水平的变化趋势较一致,本研究同时为今后准确确定兔日粮粗蛋白水平提供了检测依据。
(本文图2见彩插6。)
[1]Association of Official Analytical Chemist,Official Methods of analysis[M].15 th Edition.AOAC,Arlington,VA.1990.69-90.
[2]Gelato MC.Growth hormone-insulin-like growth factor I and immune function[J].Trends Endocrinol Metab.1993,4:106-110.
[3]Lemonzy S,Pucilowska JB,Underwood LE.Reduction of IGF-I in protein restricted rats is associated with differential regulation of IGF-binding protein messenger ribonucleic acids in liver and kidney,and peptides in liver and serum[J].Endocrinology. 1994,135(2):617-623.
[4]Kanamoto R,Yokota T,Hayashi Shin-Ichi.Expression of c-mys and Insulin-like factor-I in the liver of growing rat vary reciprocally in response to change in dietary protein[J].J Nutr,1994,124:2329-2334.
[5]Fukada H,Ozaki Y,Pierce AL,et al.Salmon growth hormone receptor:molecular cloning,ligand specificity,and response to fasting[J].Gen Comp Endocrinol.2004,139:61-71.
[6]Pedroso FL,de Jesus-Ayson EGT,Cortado HH,et al.Changes in mRNA expression of grouper(Epinephelus coioides)growth hormone and insulin-like growth factor I in response to nutritional status[J].Gen.Comp Endocrinol,2006,145:237-246.
[7]Miura Y,Kato H,Hoguchi T.Effect of dietary protein on IGF-I messenger ribonucleic acid content in rat liver[J].Br J Nutrit,1992,67:257-265.
[8]McMurtry JP,Frands GL,Upton Z.Insilin-like growth factors in poultry[J].Domest Anim Endocrinol,1997,14:199-229.
[9]Lemaigre FP,Rousseau GG.Transcriptional control of genes that regulate glycolysis and gluconeogenesis in adult liver[J]. Biochem J,1994,303:1-14.
[10]Kirchner S,Sadasivam Kaushik S,Panserat S.Low protein intake is associated with reduced hepatic gluconeogenic enzyme expression in rainbow trout(Oncorhynchus mykiss)[J].J Nutr,2003,133:2561-2564.
[11]陈伟健.蛋白能量平衡对反刍动物饲料组合效应的影响及其机理研究[D].浙江大学博士学位论文.2008:86-90.
Relationship of Dietary Crude Protein and G row th Stages w ith the Expression of Hepatic Functional Genes in WHBE Rabbits
LV Jian-min1,LIU Yue-huan2
(1.Laboratory Animal Research Center,Zhejiang Chinese Medical University,Hangzhou 310053,China; 2.Zhejiang Center of Laboratory Animals,Zhejiang Academy of Medical Sciences,Hangzhou 310013,China)
ObjectiveTo evaluate the effects of dietary crude protein(CP)level on hepatic functional genes expression during the growing and finishing periods in WHBE rabbits.M ethods Twenty rabbits were used in each stage according to a two-way trail.The rabbits in both periods were divided into five equal groups and fed with the diets of equal digestible energy but different CP contents(12%,14%,16%,18%and 20%).After a one-month feeding trail,the expression abundance of hepatic IGF-1 and PEPCK-C genes in the rabbits was determined by real-time PCR.Results The growth stages had significant effect on hepatic IGF-I mRNA expression,with a higher expression abundance in the finishing period,compared with that in the growth period.The IGF-I gene expression abundance was higher in rabbits receiving 16% or 18%CP than that of lower CP levels.Hepatic PEPCK-C mRNA was also highest at 16%CP level,but there were no significant differences between growing and finishing periods.ConlusionThere is a significant relationship between the expression of the two genes and dietary CP.The expression of IGF-I mRNA,but not PEPCK–C mRNA,is closely related to different growth stages.
Diet;Crude protein;Grow th stage;WHBE rabbit;Gene expression
R-33
A
1005-4847(2010)03-0208-04
2009-10-12
浙江省科技厅资助项目(2008F80003);浙江省卫生厅资助项目(2006A94)。
吕建敏(1971-),女,副研究员,博士,研究方向:实验动物营养与免疫方面的科研工作。E-mail:jiaminvv@yahoo.com.cn
刘月环(1974-),女,副研究员,硕士,研究方向:生物技术与实验动物育种.。E-mail:yuehuanliu@163.com
