HPLC法测定肠安康颗粒中白术内酯Ⅰ与苍术酮的含量
2010-09-10何雄伟重庆市第九人民医院重庆市400700
何雄伟(重庆市第九人民医院,重庆市 400700)
HPLC法测定肠安康颗粒中白术内酯Ⅰ与苍术酮的含量
何雄伟*(重庆市第九人民医院,重庆市 400700)
目的:建立肠安康颗粒中白术内酯Ⅰ与苍术酮的含量测定方法。方法:采用高效液相色谱法,色谱柱为伊利特ODS色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-水(梯度洗脱),流速为1 mL·min-1,检测波长为220 nm。结果:白术内酯Ⅰ进样量在0.1~2.0 μg范围内与峰面积积分值呈良好线性关系(r=0.999 9),平均回收率为98.84%,RSD=0.76%(n=6);苍术酮进样量在0.5~10.0 μg范围内与峰面积积分值呈良好线性关系(r=0.999 9),平均回收率为98.43%,RSD=1.14%(n=6)。结论:本方法简便、准确,可用于肠安康颗粒的质量控制。
肠安康颗粒;白术内酯Ⅰ;苍术酮;高效液相色谱法;含量测定
*主管药师。研究方向:中药制剂与质量标准。电话:023-68289034
肠安康颗粒是根据国家级名中医临床验方研发的医院制剂,由黄芪、益母草、白术、龟板、鳖甲等7味药材组成,具有补气、活血、软坚散结之功效,是肠癌辅助治疗用药,抗转移疗效确切[1~3]。为提高制剂质量,笔者采用高效液相色谱(HPLC)法同时测定了肠安康颗粒中白术内酯Ⅰ与苍术酮的含量,方法简便、准确,可用于该制剂的质量控制。
1 材料
1.1 仪器
LC-10ATvp HPLC仪、SPD-10Avp紫外检测器(日本岛津公司);色谱工作站(杭州英谱科技开发有限公司);电子分析天平(瑞士梅特勒-托利多公司);KQ-400型超声提取仪(昆山市超声仪器有限公司)。
1.2 试药
乙腈为色谱纯,水为重蒸馏水,其余试剂均为分析纯;白术内酯Ⅰ、苍术酮标准品均由浙江省中医药研究院制备(纯度均>98%);肠安康颗粒(批号:20071011、20071015、20071102)及阴性样品均由重庆市第九人民医院自制。
2 方法与结果
2.1 色谱条件
色谱柱:伊利特ODS色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱(洗脱程序见表1);柱温:室温;流速:1 mL·min-1;检测波长:220 nm。
2.2 溶液的制备
2.2.1 标准品溶液:精密称取干燥至恒重的白术内酯Ⅰ标准品10.00 mg,置于25 mL容量瓶中,加甲醇至刻度,摇匀,制得白术内酯Ⅰ贮备液;再取苍术酮标准品10.00 mg,置于5 mL容量瓶中,加甲醇至刻度,摇匀,制得苍术酮贮备液。精密吸取2种贮备液各1 mL,置于10 mL容量瓶中,加甲醇至刻度,摇匀,制成每1 mL含白术内酯Ⅰ0.04 mg及苍术酮0.20 mg的混合标准品溶液。
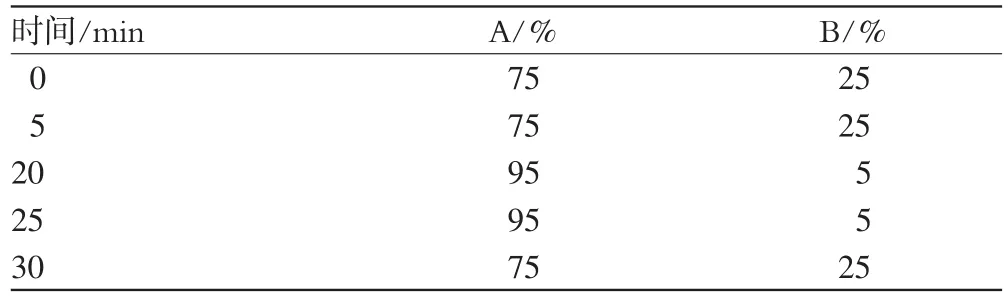
表1 梯度洗脱程序Tab 1 Gradient elution program
2.2.2 供试品溶液:取装量差异项下的本品约1.0 g,精密称定,置于具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定质量,放置1 h,超声处理30 min,放冷至室温,再称定质量,用甲醇补足减失的质量,滤过,取续滤液过0.2 μm微孔滤膜,即得。
2.2.3 阴性对照溶液:取缺白术的阴性样品,按“2.2.2”项下方法操作,即得。
2.3 系统适用性试验
分别吸取上述标准品溶液、供试品溶液及阴性对照溶液各10 μL,注入液相色谱仪,按上述色谱条件记录色谱图。结果,供试品色谱中指标成分与相邻峰的分离度分别为3.26与5.79;理论塔板数以白术内酯Ⅰ及苍术酮色谱峰计算应>3 000;阴性对照在与标准品出峰相应保留时间位置未出现杂质峰,表明本法专属性强。色谱图见图1。
2.4 方法学考察
2.4.1 线性关系考察:精密吸取标准品贮备液,分别稀释成梯度浓度的混合标准品溶液,精密吸取10 μL注入液相色谱仪,按上述色谱条件测定,记录峰面积。以峰面积积分值(Y)对进样量(X,μg)进行线性回归,得白术内酯Ⅰ的回归方程为Y=27 183.3X—2 062.1(r=0.999 9);苍术酮的回归方程为Y=2 927.3X—705.6(r=0.999 9)。结果表明,白术内酯Ⅰ、苍术酮的进样量分别在0.1~2.0、0.5~10.0 μg范围内与各自峰面积积分值呈良好线性关系。
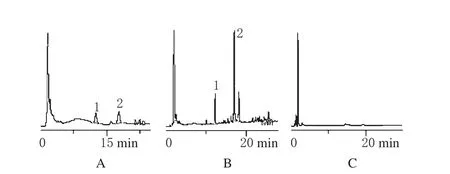
图1 高效液相色谱图A.混合标准品;B.供试品;C.阴性对照;1.白术内酯Ⅰ;2.苍术酮Fig 1 HPLC chromatogramA.mixtrue standard;B.test sample;C.negative control;1.atractylenolideⅠ;2.atractylone
2.4.2 精密度试验:精密吸取混合标准品溶液,按上述色谱条件连续进样6次,每次10 μL。结果,白术内酯Ⅰ和苍术酮峰面积的RSD分别为1.02%和1.81%,表明仪器精密度良好。
2.4.3 稳定性试验:取同一供试品溶液(批号:20071011),按上述色谱条件分别于0、2、4、6、8、12 h各进样10 μL。结果,白术内酯Ⅰ和苍术酮峰面积的RSD分别为1.39%和1.23%,表明供试品溶液在12 h内稳定。
2.4.4 重复性试验:取同一批样品(批号:20071011)共6份,分别按“2.2.2”项下方法制备供试品溶液,按上述色谱条件测定。结果,白术内酯Ⅰ和苍术酮的平均含量分别为0.060 mg·g-1和0.30 mg·g-1,RSD分别为1.12%和1.08%,表明方法重复性良好。
2.4.5 加样回收率试验:称取已知含量的样品(批号:20071011)共9份,精密称定,按照高、中、低比例分别精密加入对照品溶液(每1 mL含白术内酯Ⅰ0.04 mg和苍术酮0.20 mg),按“2.2.2”项下方法制备供试品溶液,按上述色谱条件测定样品含量,计算加样回收率,结果分别见表2、表3。
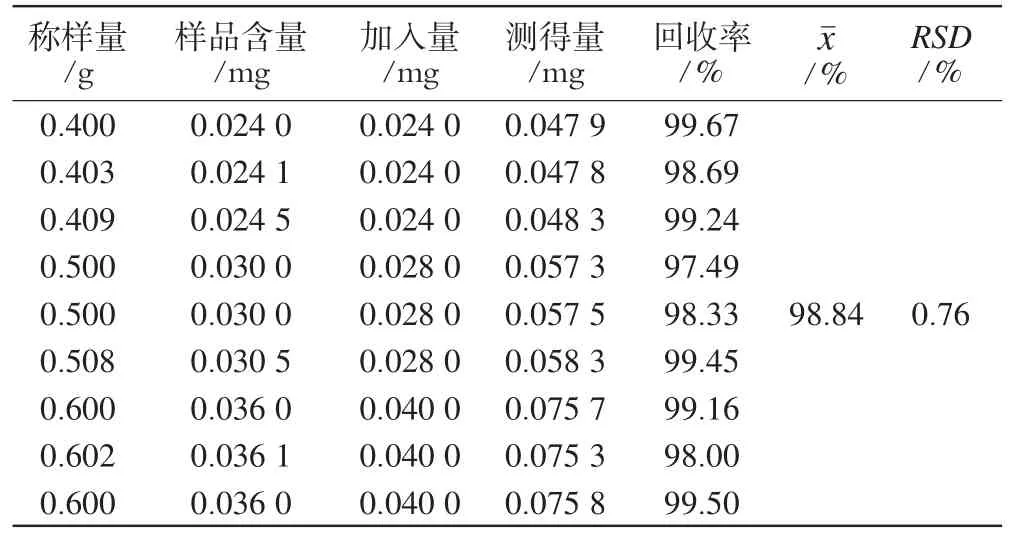
表2 白术内酯Ⅰ的回收率试验结果(n=6)Tab 2 Recovery of atractylenolideⅠ(n=6)
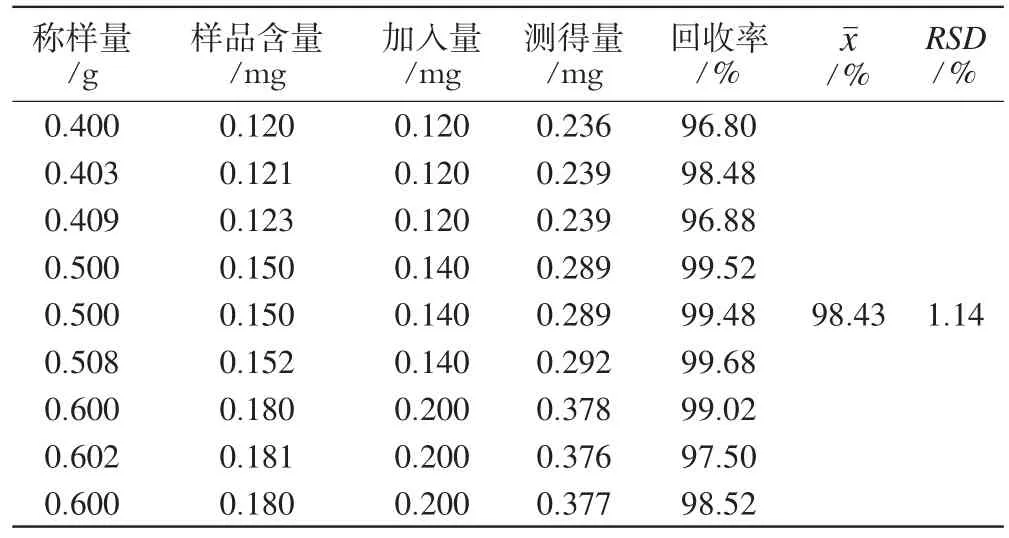
表3 苍术酮的回收率试验结果(n=6)Tab 3Recovery of atractylon(n=6)
2.5 样品含量测定
取3批肠安康颗粒,分别按“2.2.2”项下方法制备供试品溶液。分别精密吸取混合标准品溶液1 μL及供试品溶液20 μL,注入液相色谱仪,测定峰面积,以外标法计算样品含量,结果见表4。
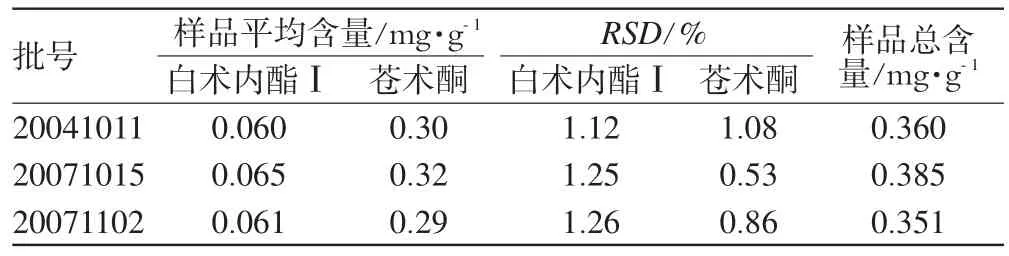
表4 样品含量测定结果(n=3)Tab 4Result of sample determination(n=3)
3 讨论
虽然《中国药典》中白术项下没有含量测定,但考虑到制剂中白术未经提取,直接将细粉入药制粒成型,有效成分含量较高,而且有相关实验室提供了白术内酯和苍术酮标准品,能够满足含量测定的需要,故最终以白术内酯Ⅰ和苍术酮为指标,建立了该制剂的含量测定方法并制定含量限度。
苍术酮不稳定,冰冻保存6个月后纯度下降,因此将苍术酮有效期定为6个月并冷冻保存。临用时再配制标准品溶液。
试验对流动相梯度洗脱程序进行了比较,选择了成分分离良好、分析时间适宜的条件。另对供试品溶液的制备条件进行了比较,最终确定文中所述制备方法。
[1]国家药典委员会编.中华人民共和国药典(一部)[S].2005年版.北京:化学工业出版社,2005:68.
[2]文红梅,李 伟,吴 皓.白术质量标准研究Ⅰ——HPLC法测定2种白术内酯的含量[J].药物分析杂志,2001,21(3):170.
[3]俞忠民,戴诗文,寿 旦,等.超微粉碎对白术中内酯成分体外溶出的影响[J].中国药房,2009,20(9):653.
Determination of AtractylenolideⅠ and Atractylone in Chang’ankang Granule by HPLC
HE Xiong-wei(The Ninth People’s Hospital of Chongqing,Chongqing 400700,China)
ABSTRCTOBJECTIVE:To develop a method for determination of atractylenolideⅠ and atractylone in Chang’ankang granule by HPLC.METHODS:The determination was performed on Yilite ODS column(250 mm×4.6 mm,5 μm).The mobile phase contained of acetonitrile-water(gradient elution)with flow rate of 1 mL·min-1and detection wavelength of 220 nm.RESULTS:The linear range of atractylenolide Ⅰwere 0.1~2.0 μg(r=0.999 9)with mean recovery of 98.84%(RSD=0.76%,n=6).The linear range of atractylone were 0.5~10.0 μg with mean recovery of 98.43%(RSD=1.14%,n=6).CONCLUSION:This method is simple,convenience and accurate for quality control of Chang’ankang granule.
Chang’ankang granule;AtractylenolideⅠ;Atractylone;HPLC;Content determination
R283.627;R927.2
A
1001-0408(2010)03-0249-02
2009-10-29
2009-12-12)
