人参皂苷Rb3在Caco-2单细胞层模型上的吸收特征研究Δ
2010-08-06赵洁杨彩华胡明刘中秋南方医科大学药学院药剂系广州市510515
赵洁,杨彩华,胡明,刘中秋(南方医科大学药学院药剂系,广州市510515)
人参皂苷Rb3为五加科人参属植物的主要活性成分之一,在缺血时可通过抑制神经元持续性钠电流的增加幅度发挥对缺血性神经元的保护作用[1],具有良好的抗脑缺血、抗血栓以及保护神经细胞作用[2]。对于人参皂苷Rb3含量的测定,目前多采用高效液相色谱-紫外分光光度(HPLC-UV)及高效液相色谱-蒸发光散射(HPLC-ELSD)检测法[3]。但这些方法受灵敏度及线性范围的限制,很难准确定量药物浓度较低的细胞样品。笔者建立了检测细胞样品中人参皂苷Rb3的液相色谱串联质谱电喷雾(LC-MS/MS)法,并研究了人参皂苷Rb3在Caco-2单细胞层模型上的吸收特征,这在国内尚未见文献报道。
1 材料
1.1 仪器
6410型液-质联用串联四极杆质谱仪(美国Agilent公司),包括Agilent 1200型高分离快速液相色谱、ESI电喷雾离子源、三重四极杆质量分析器;Gradient A10型超纯水系统、Millicell-ERS型跨膜电阻仪(美国Millipore公司);Forma SeriesⅡ型CO2培养箱(美国Thermo electron公司);TS100-F型倒置显微镜(日本Nikon公司);Eppendorf 5810R型低温高速离心机(德国Eppendorf公司);MS 3D型涡旋混匀器(德国IKA公司);插入式细胞培养仪(丹麦Nunc公司)。
1.2 试药
DMEM高糖培养基、胰蛋白(EDTA,美国Gibco公司);胎牛血清非必需氨基酸(NEAA,美国Hyclone公司);谷氨酰胺、青-链霉素双抗溶液、Hank’s液(HBSS,美国Sigma公司);鼠尾胶原(美国BD公司);人参皂苷Rb3、人参皂苷Rg2(吉林大学化学学院,纯度均≥98%);乙腈、甲酸铵均为色谱纯,水为超纯水,其余试剂均为分析纯。
1.3 细胞株
细胞Caco-2 TC7细胞株,由美国休斯敦大学胡明教授馈赠。
2 方法与结果
2.1 细胞培养
将Caco-2细胞接种于T75的细胞培养瓶中,培养条件为DMEM高糖培养基,添加1%NEAA、1%谷氨酰胺、10%胎牛血清、1%青-链霉素双抗溶液,通入5%CO2(相对湿度90%),置于37℃培养箱中培养,按每1 mL 2×105个接种于预先以鼠尾胶原(4.36 mg·mL-1)涂布的含有聚碳酸酯膜的内衬皿上。种板后第2天换液,之后隔天换液,19~21 d后测其跨膜电阻,当电阻值>420 ohm时,表明细胞分化完全并已形成致密的单细胞层,符合要求,可用于药物转运试验。
2.2 药物的跨膜转运试验
试验前以37℃的Hank’s平衡盐溶液(HBSS液,pH 7.4)轻轻荡洗细胞单层3次,测其跨膜电阻,若符合试验要求,则每孔加入2 mL 37℃HBSS液,置于空气摇床上继续孵育1 h,除去细胞表面的附着物,弃去HBSS液。药物从绒毛面(AP)侧至基底面(BL)侧的转运试验操作为:于AP侧加入人参皂苷Rb3的HBSS液(C010 μg·mL-1、pH7.4)2.5 mL,同时于BL侧加入空白的HBSS液(pH7.4)2.5 mL。置于37℃转速为50 r·min-1的空气摇床上,分别于载药后1、2、3、4 h于BL侧采样0.5 mL,并于采样侧补充等体积空白HBSS液,试验平行3份。药物从BL侧至AP侧的转运则将药物加入BL侧,AP侧加入空白的HBSS液,其它步骤同AP侧至BL侧的转运试验操作。
2.3 细胞样品处理
取上述细胞样品30 μL,精密加入内标溶液(每1 mL人参皂苷Rg2含0.5 μg)10 μL,流动相加至100 μL,涡旋混合,4 ℃下,13 000 r·min-1离心30 min,取上清液20 μL进样,以样品与内标峰面积比进行定量分析。
2.4 LC-MS/MS分析
2.4.1 色谱条件 色谱柱:Agilent RR HT ZORBAX Eclipse XDS-C18(50 mm×4.6 mm,1.8 μm);流动相:乙腈-1 mmol·L-1甲酸铵水溶液(34∶66);流速:0.4 mL·min-1;柱温:30 ℃;进样量:20µL。
2.4.2 质谱条件 采用电喷雾离子化方式(ESI),以多重离子反应(MRM)、负离子模式进行检测。检测条件:人参皂苷Rb3为m/z1077.7→m/z783.4,Fragmentor为 200 V,Collision Energy为58 V;内标人参皂苷Rg2为m/z783.6→m/z475.1,Fragmentor为270 V,Collision Energy为45 V;离子源参数:雾化气温度为350 ℃,气流为11 mL·min-1,气压为40 psi,毛细管电压为4 000 V。
2.5 方法学验证
2.5.1 HBSS溶液中人参皂苷Rb3标准曲线的制备 取空白HBSS溶液30 μL,精密加入不同浓度的人参皂苷Rb3标准品溶液10 μL,使其终浓度分别为50、80、200、400、1 000、2 000 ng·mL-1,按“2.3”项下方法操作。以样品浓度(C)为横坐标,样品与内标峰面积之比(R)为纵坐标,进行线性回归。得回归方程R=2.865 7C-0.249 7(r=0.9903)。结果表明,人参皂苷Rb3检测浓度在50~2 000 ng·mL-1范围内与样品与内标峰面积之比呈良好线性关系。最低检测限为20 ng·mL-1。
2.5.2 方法的专属性 在本试验条件下,细胞中的杂质不干扰人参皂苷Rb3、内标人参皂苷Rg2的检测,基线噪声小,人参皂苷Rb3与人参皂苷Rg2的保留时间分别为3.42、3.68 min。本法具有较好的专属性。LC-MS/MS图谱见图1。
2.5.3 方法回收率试验 取空白HBSS溶液30 μL,精密加入不同浓度的人参皂苷Rb3对照品溶液10 μL,使其终浓度分别为80、400、2 000 ng·mL-1,按“2.3”项下方法操作,测定HBSS溶液中人参皂苷Rb3的回收率,每个浓度重复5次。人参皂苷Rb3在HBSS溶液中的回收率试验结果见表1。
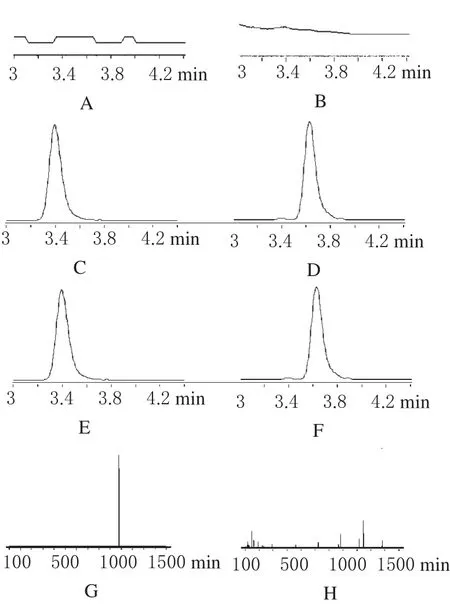
图1 LC-MS/MS图A、B.空白HBSS溶液;C.空白HBSS溶液加入人参皂苷Rb3;D.空白HBSS溶液加入人参皂苷Rg2;E.孵育4 h的人参皂苷Rb3细胞样品;F.孵育4 h的人参皂苷Rg2细胞样品;E.Rb3标准品;F.Rg2标准品Fig 1 LC-MS/MS chromatogramsA,B.blank HBSS solution;C.blank HBSS solution spiked with ginsenoside Rb3;D.blank HBSS solution spiked with ginsenoside Rg2;E.cell sample after incubating with Ginsenoside Rb3for 4 hours;F.cell sample after incubating with Ginsenoside Rb2for 4 hours;E.standard ginsenoside Rb3;F.standard Ginsenoside Rg2

表1 人参皂苷Rb3在HBSS溶液中的回收率试验结果(n=5)Tab 1 Recovery of ginsenoside Rb3in HBSS solution(n=5)
2.5.4 方法精密度(RSD)试验 取空白HBSS溶液30 μL,精密加入不同浓度的人参皂苷Rb3对照品溶液10 μL,使其终浓度分别为80、400和2 000 ng·mL-1,按“2.3”项下方法操作,每天进行5样本测定作为日内RSD,连续测定3 d,计算日间RSD,测定日内和日间变异情况。结果,人参皂苷Rb3在80、400、2 000 ng·mL-1水平下,日内和日间RSD均<15%,符合生物样本的测定要求。
2.6 人参皂苷Rb3的跨膜双向转运特征研究
以10 μmol·L-1的人参皂苷Rb3HBSS溶液通过Caco-2单细胞层模型,考察其从AP侧至BL侧及BL侧至AP侧的转运量随时间变化情况。药物表观渗透系数的大小反映了药物透过单层细胞的能力以及药物吸收的速度及程度。其值可由下式计算:Papp=ΔQ/(Δt·A·C0)。式中,ΔQ为在Δt时间内药物透过的量;A为单细胞层面积,本试验中为4.2 cm2;C0为药物初始浓度;Papp的单位以cm·s-1表示。结果,显示,10 μmol·L-1的人参皂苷Rb3从AP侧至BL侧的Papp为3.22×10-6cm·s-1,BL侧到AP侧的Papp为6.0×10-6cm·s-1,PBL-AP/PAP-BL比值为1.86。人参皂苷Rb3渗透系数测定结果见表2。
表2 人参皂苷Rb3渗透系数测定结果(±s,n=3)Tab 2 Apparent permeability coefficient(Papp)of ginsenoside Rb3across the Caco-2 cell monolaye(r±s,n=3)

表2 人参皂苷Rb3渗透系数测定结果(±s,n=3)Tab 2 Apparent permeability coefficient(Papp)of ginsenoside Rb3across the Caco-2 cell monolaye(r±s,n=3)
浓度/μmol·L-1 10 Papp/×10-6(cm·s-1)AP-BL 3.22±1.68 BL-AP 6.0±4.71 PBL-AP/PAP-BL 1.86
3 讨论
人参皂苷的检测方法,文献多以HPLC-UV以及HPLC-ELSD法为主,这些方法受灵敏度及线性范围的限制,无法满足细胞转运研究定量的要求。因此,笔者建立LCMS/MS法测定人参皂苷Rb3,在流动相中添加1 mmol·L-1甲酸铵,能够改善人参皂苷Rb3峰形、提高进样的响应值和重现性。
关于人参皂苷Rb3的吸收机制研究国内尚未见文献报道。本研究采用Caco-2单细胞层模型研究人参皂苷Rb3透过单细胞层的双向转运特征,结果显示,人参皂苷Rb3从AP侧至BL侧以及BL侧至AP侧的转运量均随时间的增加呈线性升高。其双向转运Papp值均在10-6数量级,表明其经肠道吸收较差。PBL-AP/PAP-BL为1.86,外排大于吸收,提示人参皂苷Rb3的转运可能存在外排转运蛋白的参与。在肠道中存在P-糖蛋白(P-gp)、多药抗药性相关蛋白(MRPs)等外排转运蛋白,这些转运蛋白可以将进入BL侧的药物外排至AP侧,使吸收减少[4]。为考察人参皂苷Rb3的转运是否有外排转运蛋白参与,本研究采用了高灵敏度的LC-MS/MS检测方法,并选用较低浓度的人参皂苷 Rb3(10 μmol·L-1)为研究对象考察其在Caco-2单细胞层模型上的双向转运特征,避免了可能存在的外排蛋白被饱和现象的影响。结果表明,人参皂苷Rb3外排大于吸收,这是否由外排转运蛋白引起,且哪种转运蛋白参与人参皂苷Rb3的外排,有待继续深入研究。
[1]江炜炜,姜正林,柯开富.人参皂苷Rb3对缺血及正常神经元持续性钠电流的影响[J].药学与临床研究,2007,15(6):444.
[2]杨志刚.中药三七对神经系统和免疫系统的影响[J].中国药房,2008,19(18):1 424.
[3]朱 洁,杨 蓉,张洪彬.HPLC-ELSD法测定三七叶中人参皂苷Rb3、Rc、Rb1的含量[J].中草药,2004,35(12):1 365.
[4]Patel J,Buddha B,Dey S,et al.In virtro interaction of the Hiv protease inhibitor ritonavir with herbal constituents:changes in P-gp and CYP3A4 activity[J].Am J Ther,2004,11(4):262.
