甘蔗茎尖胚状体脱毒苗快繁技术研究
2010-09-10余坤兴刘丽敏刘红坚游建华戴友铭
李 松,余坤兴,刘丽敏,淡 明 ,刘红坚,杨 柳,谭 芳,游建华,戴友铭
(1.中国农业科学院甘蔗研究中心,南宁 530007;2.广西壮族自治区甘蔗研究所,南宁 530007;3.广西大学,南宁530005)
甘蔗是中国最主要的糖料作物,其种植面积占糖料总面积的85%左右,蔗糖产量占食糖产量的90%以上。甘蔗属于无性繁殖且长期连作作物,易受各种病害的积累且传播快,尤其是目前应用化学药物无法防治的甘蔗宿根矮化病(RSD)和花叶病等病害严重发病,种性退化,产量、质量急剧下降。茎尖培养去除甘蔗宿根矮化病和花叶病,生产脱毒健康种苗是恢复甘蔗优良种性、提高甘蔗工农效益最有效的技术措施[1]。甘蔗迅速大量繁殖试管苗,可通过两种方式:一种是诱导嫩叶外植体产生愈伤组织,由愈伤组织分化植株(Lee,T.S.G,1986;Lee,T.S.G,1987;Daniela Cidade et al,2007)[2,3,4];另一种是培养茎顶生长点附近的芽(顶芽、腋芽),使之大量分蘖繁殖。繁殖一定数量后,诱导芽长出根,形成完整植株(Hu,C.Y et al,1983;S Lakshmanan P et al,2006;Imtiaz Ahmed Khan et al,2006)[5,6,7]。我国利用甘蔗外植体进行良种快繁的研究工作起步较早,20世纪70年代通过愈伤组织[8]、腋芽[9]等进行甘蔗良种快繁,并大面积应用于生产;1994年许莉萍[10]报道了茎尖培养去除甘蔗花叶病毒。对甘蔗茎尖培养去除甘蔗宿根矮化病的研究工作开展较晚,但进展较快,并已进入推广应用阶段[11]。但是甘蔗茎尖培养扩繁量小,成本高,不利于在生产上大面积推广应用。本研究着重于以茎尖细胞培养及体细胞胚胎发生途径,实现深度去病去毒和大幅度提高扩繁量。
1 材料与方法
1.1 试验材料
供试品种选用目前广西当家甘蔗品种新台糖22号,由广西甘蔗研究所生物技术研究室提供。
1.2 试验设计
1.2.1 组培苗繁育方法 设茎尖培养诱导胚状体后分化成苗(处理A)、茎尖直接分化成苗(处理B)与腋芽直接分化成苗(处理C)3种繁育方法。
茎尖培养诱导胚状体后分化成苗方法,即从田间取回生长健壮的新台糖22号宿根植株,将蔗茎砍成单芽段,在30℃条件下培养20d左右,经常规消毒后剥取1~2mm的茎尖分生组织在黑暗条件下进行愈伤组织诱导,培养基为:MS+2,4-D 2.5mg/L+NAA 0.1mg/L;待愈伤组织诱导形成后转入胚状体诱导培养基,配方为:MS+2,4-D 1.5mg/L+6-BA 0.5mg/L+NAA 0.1mg/L;胚状体形成后转入分化培养基,在自然光照条件进行绿芽分化,培养基配方为:MS+6-BA 1.0mg/L+NAA 0.1mg/L;对所得绿苗进行试验研究。以上培养温度为27±1℃,光照为自然散射光。
茎尖直接分化成苗方法,即如上所述方法获取甘蔗的茎尖在MS+6-BA 1.0mg/L+NAA 0.1mg/L滤纸桥上进行分化培养;对分化培养获得的茎尖组培苗进行试验研究。培养条件与茎尖培养诱导胚状体后分化成苗方法相同。
腋芽直接分化成苗方法,即上述相同新台糖22号材料,将蔗茎砍成单芽段,经用清水洗净、75%酒精擦表皮后,用0.2%的升汞消毒12min,无菌水冲洗3次,接种在MS+6-BA 1.0mg/L+NAA 0.1mg/L进行腋芽培养。所获得的腋芽组培苗进行试验研究。培养条件与茎尖培养诱导胚状体后分化成苗方法相同。
1.2.2 组培苗繁殖影响因素设计 以春植蔗为材料,于8月5日、10月5日、12月5日3个生长时间段进行取样处理接种,每个时间段观察不同时期接种各种繁育方法对外植体成活情况的影响。以8月5日接种单芽为单位获得的活外植体经1.2.1分化成苗后,进行以下研究:
(1)不同激素水平的不同繁育方式组培苗快繁研究:采用二因素,6-BA 五水平:0、0.5、1.0、1.5、2.0mg/L;NAA四水平:0、0.01、0.05、0.1mg/L进行试验,以筛选不同类型组培苗培养的最适繁殖培养基。以供体单芽为单位,取生长基本相近的芽系苗,每个培养基处理为3瓶苗,每瓶1个单芽株系苗,设3次重复,增殖5代后进行组培苗快繁数据收集。
(2)不同激素水平组培苗生根试验:采用二因素NAA和ABA各四水平:0、2.5、5.0、7.5mg/L进行试验,每种培养基处理为5瓶苗,4次重复。培养30d后进行组培苗生根数据收集。
1.2.3 不同处理方式的脱毒效果试验 12月15日从田间选择生长一般,明显感染花叶病的蔗株,采回后取蔗茎中下段蔗汁进行PCR检测证实含RSD后,将带RSD的甘蔗侧芽按1.2.1的三种繁育方式进行培养,每个处理接种30个芽,获得的组培苗以每个侧芽为单位建立株系苗,定量比较其脱毒效果。
1.3 测定项目与方法
1.3.1 外植体成活率 外植体接种培养一段时间后,部分外植体因真菌、细菌、褐化等污染因素导致死亡,外植体成活率即成活外植体数占接种总数的百分率。接种后每天上午观察一次,因人为操作而非材料因素造成的真菌、细菌污染不列入统计范围。
1.3.2 组培苗繁殖速度与质量 内容主要有:增殖速度、假茎高度、假茎粗、叶片长度、每瓶苗鮮重等。以接种外植体单芽为基数,在1.2.2(1)培养条件下增殖至第5代,对上述内容进行统计:增殖速度,处理A、B、C在6-BA 0mg/L+NAA 0-0.1mg/L配比培养条件下统计全部苗数,其余配比培养条件下的苗数,各配比取有代表性的瓶苗,其中,处理A取10瓶苗,处理B、C取总瓶数的1/4进行统计,平均每瓶苗的株数,然后乘增殖总瓶数,累加得出其增殖总苗数(增殖速度)。
假茎高度、假茎粗、叶片长度、每瓶苗鮮重,处理A、B、C均以6-BA 1.5mg/L+NAA 0.1mg/L配比相同培养条件下统计。随机抽取100株苗,测定假茎高度、假茎粗、叶片长度,其中假茎高度,用30cm长的直尺测定,以基部起至+1叶肥厚带止,取平均值;假茎粗,用游标尺测蔗苗假茎中部,取平均值;叶片长度,用30cm长的直尺每株苗+1叶叶片长度,取平均值;每瓶苗鮮重,不同处理各取20瓶有代表性的瓶苗,洗净培养基,在阴凉处自然风干水分后用电子分析天平称重,取平均值。
1.3.3 不正常组培苗 内容主要有:白化苗、细弱小苗、玻璃化苗、疯长苗。以瓶为单位对1.2.2(1)的各处理试验瓶苗进行统计。白化苗,即蔗苗完全失绿呈白色或部分失绿呈白绿相间,每瓶苗中有1株以上白化苗均入统计范围;细弱小苗,即蔗苗假茎比正常苗小一倍以上,增殖速度极慢,叶片细长偏黄,一瓶苗约有1/3以上蔗苗出现此现象均列入统计范围;玻璃化苗,即蔗苗肿胀失绿,叶片皱缩成纵向卷曲,增殖能力降低,一瓶苗约有1/3以上蔗苗出现此现象均列入统计范围;疯长苗,即蔗苗增殖速度较快,蔗苗矮小,高度为正常苗一半左右,一瓶苗约有1/2以上蔗苗出现此现象均列入统计范围。
1.3.4 不同激素水平对组培苗生根的影响 内容主要有:生根率、每瓶苗生根率、每株苗根数、移栽成活率等。生根率,即生根瓶苗数占试验瓶苗总数的百分率;每瓶苗生根率,即组培苗转接生根试验后20d,随机抽取50瓶生根苗,以有2片叶以上(含2片叶)的蔗苗为标准苗,长有1条根(含1条)以上的列入统计范围,取平均值;移栽成活率,所有参试生根苗进行移栽,根据1.3.2与每瓶苗生根率计算移栽生根苗数,移栽后约30d进行分株假植育苗,并统计假植苗数,假植苗数占移栽生根苗数的成分率为移栽成活率。
1.3.5 RSD检测、花叶病检测 对1.2.3不同处理试验苗采用PCR技术进行RSD、花叶病病源检测,检测方法参照邓展云[12]、李利君[13],每个处理随机抽取10瓶进行检测,空白对照为样品提取缓冲液,阳性对照和阴性对照分别为经鉴定已感染RSD、花叶病病毒和未感染RSD、花叶病病毒的甘蔗植株,由广西甘蔗研究所生物技术研究室提供。根据显色结果,并与空白、阴性及阳性对照比较,判定是否感染病毒。每个样品均重复试验3次,若三者均为阳性则记为阳性,三者均为阴性则记为阴性,阳性、阴性均有出现则记为不能确定。
1.4 数据分析
数据处理用SPSS统计软件,利用LSD(Least-significant difference)最小显著差数法和Duncan(Duncan's multiple range test)新复极差法进行单因素方差分析(One-Way ANOVA)作图比较。
2 试验结果与分析
2.1 不同时期接种对外植体成活的影响
接种时期与培养方式不同,外植材料的成活率也不同,而且引起外植体死亡的因素也不同。处理A与处理B不同时期接种成活率相近,3个时间段平均成活率分别为49.14%和48.58%、77.04%;引起芽死亡的原因也相同,均为褐化(见图1)。处理C不同时期接种成活率不同,以8月5日成活率最高,其次为10月5日;引起芽死亡的原因主要是材料带菌(见图1、2)。经差异性分析,处理A与B成活率差异不显著(Sig=0.86>0.05),处理A、B与处理C成活率差异达极显著水平(Sig<0.01)。

图1 不同处理的外植体成活率
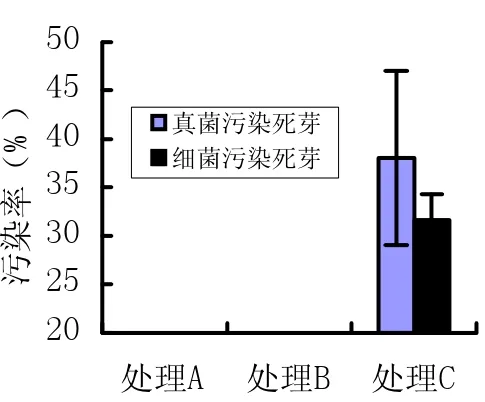
图2 不同时期接种外植体死亡情况
2.2 不同处理在不同激素水平下对组培苗繁殖的影响
2.2.1 增殖速度 不同激素水平对组培苗的增殖速度影响较大,但同一激素水平对不同处理组培苗的增殖速度影响程度相近(见表1)。试验结果表明,组培苗增殖速度最高的为处理A(为2589倍),其次是处理B(297倍),最低为处理C。经差异分析,处理间差异达极显著水平(Sig<0.01);6-BA和NAA对甘蔗组培苗增殖培养均具有明显的效果,其中6-BA与NAA同时存在时,组培苗增殖苗数较多,6-BA与NNA独立存在时,6-BA增殖效果远高于NAA,在参试培养基中,以6-BA 1.5mg/L+NAA 0.01~0.1mg/L增殖效果较好。

表1 不同激素水平组培苗快繁情况
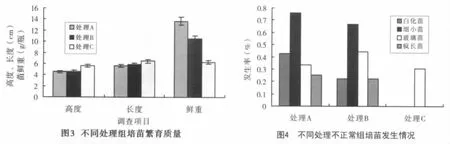
2.2.2 组培苗质量 以6-BA 1.5mg/L+NAA 0.1mg/L激素配比培养条件下对各处理试管苗质量进行测定。处理不同,蔗苗质量不同(图3)。假茎高度以处理C最高,为5.56 cm,其次为处理B,为4.53 cm,处理A为4.49 cm,与处理C差异极显著(Sig<0.01);各处理叶片长度、假茎粗的表现与假茎高度相同(Sig>0.05);每瓶苗鮮重,以处理A最高,达13.7g,其次为处理B,为10.5 g,处理C只有6.3 g,差异极显著(Sig<0.01)。在试验过程中发现,若不及时转接新培养基,处理A部分蔗苗会出现枯黄,处理B、C极少出现此现象。
2.2.3 不同处理对组培苗(不正常苗)生长的影响 甘蔗组培繁殖过程中,绝大部分为生长正常的苗,但也有一小部分为不正常生长的苗。从外观上分类,本试验中不正常生长的苗类型有白化苗、细弱小苗、玻璃化苗、疯长苗4种情况(见图4),不正常苗发生率最高的是处理A,其次为处理B。玻璃化苗各处理之间均未达到显著水平(Sig<0.01),但白化苗、细弱小苗、疯长苗处理A和处理B与处理C相比都达到了极显著水平(Sig<0.01)。
2.3 不同激素水平对组培苗生根及移栽成活率的影响
2.3.1 不同处理不同激素水平对组培苗生根的影响 试验结果(见表2)表明,不同处理间组培苗生根差异不显著,生根率处理A为75.3%,处理B为76.9%,处理C为76.6%。NAA和ABA对甘蔗组培苗生根具有明显的作用,NAA和ABA单独使用时,NAA的生根效果好于ABA;NAA和ABA同时一起使用时,两者对生根具有一定的累加效应,但效果不明显。在16个培养基中,以NAA 7.5mg/L+ABA 2.5mg/L生根率最高,达95.0%,为最佳生根培养基。

表2 不同激素水平组培苗生根情况
2.3.2 不同处理不同激素水平对组培生根苗室外移栽成活率的影响 将已完全长根的组培苗冼净后移栽到室外丛栽苗圃,移栽前统计苗根系质量情况,结果见图5。试验结果表明,处理C根系优于处理B和处理A,但各处理之间差异不显著(Sig>0.05),处理B和处理A的根质量相似,差异不明显(Sig>0.05);3种类型的瓶苗室外移栽成活率均较高(图6),差异不明显。

2.4 不同处理对组培苗去除RSD、花叶病的效果
不同处理对组培苗去除RSD、花叶病的效果不同(见表3)。试验结果表明,在去除RSD方面,处理A能去除RSD,去除率95%;其次为处理B,RSD去除率为70%;处理C无法去除RSD,与处理A和处理B差异极显著(Sig<0.01)。
在去除花叶病方面,处理A去除率达100%;其次为处理B,花叶病去除率为75%;处理C无法去除花叶病,与处理A和处理B差异极显著(Sig<0.01)。

表3 不同处理试管苗对RSD和花叶病脱毒效果
3 结论
3.1 不同时期接种对外植体成活的影响
两种茎尖外植体在不同时间段接种,外植体死亡因素的相同,主要是褐化引起。甘蔗茎尖分生组织接种在培养基上,不到24h就开始陆续出现褐化,72h后褐化率达100%。茎尖接种在诱导培养下暗培养2周左右,未褐化的组织4周长出乳白色致密胚性愈伤组织,小部分褐化较轻的组织也能长出乳白色致密胚性愈伤组织;然后转入胚状体诱导培基1周后,逐渐长出米黄色的胚性细胞团进而分化出苗,从接种到出现再生苗约需30~40d时间;甘蔗茎尖接种在分化培养基上,褐化情况与甘蔗茎尖愈伤组织培养相似,存活的茎尖40d左右长出绿芽,60d左右分化成丛芽;腋芽外植体接种在分化培养基上,褐化程度较轻,个别较重的对苗的成活影响也不大,因褐化原因没有引起腋芽死亡,引起腋芽外植体死亡的主要因素是真菌、细菌污染。腋芽由于有叶组织的保护及未有损伤,没有产生褐变,故其成活率较高,产生的污染主要是外植体组织内的真菌、细菌引起,大部分是在培养20d以后陆续发生。因此,若用茎尖进行脱毒苗繁育,在接种及培养前期,对茎尖进行处理,以降低褐化程度,可提高成活率。
3.2 不同处理对组培苗繁殖速度与质量的影响
茎尖分生细胞是种质细胞,通过诱导产生大量的胚性细胞,因此一个茎尖经诱导后分化再生较多的植株;而茎尖和腋芽直接分化出苗,以芽繁芽,其繁殖速度较低。在相同的培养条件下,由于不同处理其蔗苗繁殖速度不同,其蔗苗的质量也有所不同。本试验茎尖胚性细胞苗增殖较快,每瓶苗的数量较多,平均每株苗的营养、光、气等条件相对较低,因此其增殖苗相对较细,且在繁殖过程中因培养中营养不足出现蔗苗枯黄的现象;腋芽苗增殖较慢,平均每株苗的营养、光、气等条件相对较好,苗较粗壮;茎尖苗质量处于茎尖胚性细胞苗与腋芽苗之间。因此,为提高组培苗质量,茎尖胚性细胞苗在繁殖过程中,适当降低每瓶苗的基本苗数,改善培养条件,并可以提高繁育速度。
3.3 不同处理对组培苗(不正常苗)生长的影响
本试验组培苗出现的不正常苗有白化苗、细弱小苗、玻璃化苗和疯长苗。茎尖胚性细胞分化长成的苗,4种不正常生长状态的苗的发生率高于茎尖苗和腋芽苗;茎尖苗其不正常苗发生情况与茎尖胚性细胞苗相似;腋芽分化的苗,在发生形态上是以芽长芽,只有玻璃化苗发生。4种生长不正常苗在生根试验中,白化苗、细弱小苗、玻璃化苗均能正常生根,但玻璃化苗所长根系质量较低,而疯长苗在生根培养基中仍处于增殖状态,很少有根的发生。上述不正常生长苗是否属于变异正在进行研究之中。因此,在组培繁育过程中,适当降低激素水平与培养代数,可减少不正常苗的发生率。
3.4 不同处理不同激素水平对组培苗生根及移栽成活率的影响
本试验结果,同一甘蔗品种不同供体器官,在相同培养繁育条件下,不同处理间组培苗生根率、根系质量及室外移栽成活率等差异不显著。因此,基因型相同的不同供体器官繁殖的组培苗,对生根培养基的反应相同。
3.5 不同处理对组培苗去除RSD、花叶病的影响
甘蔗宿根矮化病病原菌和病毒在植物体内的传播有两种方式,一种是通过胞间连丝传播,另一种是随着营养物质流在维管束系统传播。茎尖分生组织生长活跃,且维管束系统尚未形成,宿根矮化病菌和病毒颗粒几乎不能到达生长点。因此,茎尖培养脱毒效果与茎尖剥离大小有关,剥离越小,其脱毒效果越好,但成活率越低。本试验结果,甘蔗茎尖胚性细胞苗与茎尖苗均有去除RSD、花叶病的作用,腋芽苗不能去除RSD、花叶病。
4 讨论
茎尖分生细胞是种质细胞,从理论上看,通过茎尖分生细胞培养诱导胚性细胞团是一条理想的快繁途径,可获得大量的胚状体及再生植株。本研究表明,利用甘蔗茎尖诱导胚性细胞团分化再生植株,不仅试管苗扩繁增殖量远高于茎尖快繁和腋芽快繁,无性系变异不明显,而且其脱毒效果好,能较彻底地去除供体中的甘蔗宿根矮化病和花叶病。因此,甘蔗茎尖体细胞培养诱导胚性细胞分化再生植株途径解决了甘蔗目前脱毒试管苗生产中存在扩繁量小、成本高的难题,有利于甘蔗脱毒健康种苗在生产中大面积推广应用。
[1]黄诚梅,李杨瑞,谭裕模,等.甘蔗脱毒技术及其检测方法[J].甘蔗,2002,9(4):1-5.
[2]Lee,T.S.G.Multiplication of sugarcane by apex culture[J].Tumalba,1986,36:231-235.
[3]Lee,T.S.G.Micropropagation of sugarcane(Saccharum spp.)[J].Plant Cell,Tissue and Organ Culture,1987,10:47-55
[4]Daniela Cidade,Aline Castellar,Andrea Lips,et al.In vitro morphogenesis patterns from shoot apices of sugarcane are determined by light and type of growth regulator[J].Plant Cell Tiss Organ Cult 2007,90:181-190.
[5]Hu,C.Y,P.J.Wang.Meristem,shoot tip and bud culture[A].In:Handbook of Plant Cell Culture(Eds.)[C]:D.A.Evans.,W.R.Sharp.,P.V.Ammarito and Y.Yamada.Vol.-I:MacMillan,New York,1983:177-227.
[6]Lakshmanan P,Geijskes J.R,Wang L,et al.Developmental and hormonal regulation of direct shoot organogenesis and somatic embryogenesis in sugarcane(Saccharum spp.interspecific hybrids)leaf culture[J].Plant Cell Rep,2006,25:1007-1015.
[7]Imtiaz Ahmed Khan,Umar Dahot M,Shafqat Yasmn et al.Effect of sucrose and growth regulators on the micropropagation of sugarcane clones[J].Pak.J.Bot,2006,38(4):961-967.
[8]曾吉恕.甘蔗体细胞培养中的胚状体发生[J].植物生理与分子生物学学报,1979,5(4):411-416.
[9]何新民,何红,曾慧,等.利用生物技术快繁甘蔗良种的研究[J].甘蔗,1994,1(4):3-7.
[10]许莉萍,陈如凯,李跃平.利用愈伤组织培养和茎尖培养去除甘蔗花叶病毒[J].福建农业大学学报,1994,23(3):253-256.
[11]曾慧,游建华,何为中,等.甘蔗健康脱毒种苗生产技术方法研究初报[J].中国糖料,2003(4):16-19.
[12]邓展云,王伯辉,刘海斌,等.广西甘蔗宿根矮化病的发生及病原检测[J].中国糖料,2004(3):35-38.
[13]李利君,周仲驹,谢联辉.利用斑点杂交法和RT-PCR技术检测甘蔗花叶病毒[J].福建农业大学学报,2000,29(3):342-345.
