甜菜蔗糖磷酸合成酶基因的克隆及序列分析
2010-09-10刘大丽马龙彪
刘大丽 ,马龙彪 ,郝 慧
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.中国农业科学院北方糖料作物资源与利用重点实验室/中国农业科学院甜菜研究所,哈尔滨150080)
甜菜是我国重要的糖料经济作物之一。甜菜的品质主要取决于可溶性糖的含量和种类[1]。蔗糖是甜菜体内有机物运输的主要形式,也是碳水化合物贮藏和积累的主要形式[2]。在我国北方,甜菜单产不高,块根蔗糖含量大幅下降,已成为制约我国甜菜糖业发展的重要问题。
植物蔗糖磷酸合成酶 (Sucrose phosphate synthase,SPS,EC=2.4.1.14)在蔗糖合成过程中扮演着重要角色,它主要通过异构调节和磷酸化修饰在酶水平调节蔗糖合成[3]。SPS最初在小麦中被发现并得到纯化[4],随后在玉米和菠菜中也纯化了SPS,它是由分子量为117~138kDa的亚基构成的二聚体或四聚体[5]。SPS是一种低丰度蛋白,它能催化UDP-glucose+D-fructose 6-phosphate=UDP+sucrose 6(F)-phosphate反应,而这种催化蔗糖生成的反应由于SPS的内在特性事实上又是不可逆的,因此,SPS是蔗糖合成过程中最为关键的酶之一[6,7]。本研究主要利用RT-PCR技术克隆获得了甜菜蔗糖磷酸合成酶(BvSPS)基因片段,并对其序列进行了一系列的生物信息学分析。
1 材料和方法
1.1 实验材料及试剂
实验所用的甜菜试管苗由黑龙江省高校重点实验室提供。pMD18-T载体 (TaKaRa);大肠杆菌DH5α(Keygen);RNA 电泳所需试剂:20×MOPS:8.87%(m/v) MOPS、1.36%(m/v) NaAc、0.744%(m/v) EDTA-2Na,pH=7.0;变性液:Formamide/10×MOPS/Formaldehyde=15/5/8。未特殊注明的试剂均为进口分析纯。
1.2 RNA的提取与浓度测定
实验利用BIOZOL(BioFlux)试剂提取甜菜总RNA。称取1g甜菜试管苗幼嫩叶片组织于5mL BIOZOL试剂中,室温温育15min;离心;将上层清液中加入1/5体积的氯仿,冰浴15 min;再次离心,将上层清液中加入等体积异丙醇,于-20°C放置30min;离心后,将沉淀于1mL 70%乙醇中洗涤两次,晾干后,溶于DEPC水中,储存于-70°C备用。利用紫外分光光度计,分别在OD260和OD280条件下测定RNA的含量和纯度,并将样品的浓度稀释成1μg/μL备用。取2μg总RNA,加入15.8μL变性液,电泳缓冲液为1×MOPS,经1.0%琼脂糖电泳,进一步确定RNA质量。
1.3 引物设计
根据甜菜BvSPS基因的序列(Genbank accession no.X81975)信息,利用Primer premier 5.0设计上游引物(5'-3'):ATG GCG GGA AAT GAT TGG AT;下游引物(5'-3'):TTA AGC TTT GGA GAG TTT TG,扩增BvSPS基因的CDS长度为3138bp。扩增引物由上海生工合成。
1.4 RT-PCR
实验在12μL的反应体系中加入 3μg RNA、10μM Oligo dT以及RNase free H2O于 65°C反应 5min,并立即置于冰上;向第一步变性反应液中加入5×RT Buffer,20mM dNTPs,10U RNase Inhibiter以及20U的Rever Tra Ace (ToYoBo),总体积为 20μL。 反应条件为 42℃ 60min;99°C 5min;4℃ 5min。 所得的反转录产物保存于-20℃备用。 PCR 扩增:50μL 的反应体系中, 分别加入 2μL cDNA 模板,5μL 10×Taq Buffer、4μL 10mM dNTPs、1μL 20μM 上游引物和下游引物,0.5μL rTaq(TaKaRa)。 PCR 扩增条件为:94°C 预变性 5min;94°C(30s),52°C(45s),72°C(3min),30 个循环;最后 72℃延伸 10min。 扩增产物于 1.0%琼脂糖凝胶中进行电泳,并利用 GeneSnap 6.08(f)进行检测。
1.5 载体构建及序列分析
将扩增产物进行电泳,回收;将pMD18-T载体和BvSPS回收片段按照摩尔比1∶5进行连接,转化到DH5α感受态细胞中,通过Amp抗性及蓝白斑筛选出待测阳性克隆。待测阳性克隆经过提质粒,酶切鉴定,从而进一步确定重组子。利用ORF Finder,PSORT(Prediction of Protein Localization Sites),ExPASy等各种生物信息学软件,对BvSPS基因的ORF区域、分子量、等电点等信息进行预测及序列分析。
2 结果与分析
2.1 甜菜BvSPS基因CDS全长的获得
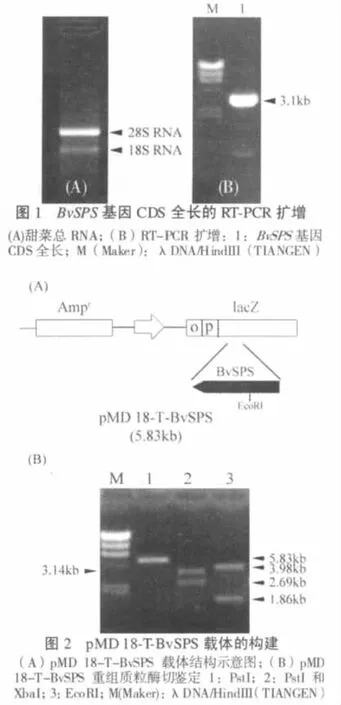
实验以甜菜试管苗为材料,利用BIOZOL试剂提取了甜菜总RNA。如图1A所示,电泳后28S rRNA和18S rRNA在紫外灯下清晰可见,并且,28S rRNA的亮度是18S rRNA的2倍左右,这说明RNA基本上没有被降解,且无弥散。同时,加样孔附近没有杂带,说明产物中没有DNA存在;在18S rRNA下方存在一些较为模糊的条带,这可能是由tRNA,5.8S RNA和5S rRNA组成的迁移较快的条带。这些结果都说明了实验获得了较高纯度和得率的甜菜总RNA。
以甜菜总RNA为模板,利用逆转录酶成功获得了cDNAs。通过RT-PCR扩增,实验在3.1kb左右的位置获得了目的片断(图1B)。这与BvSPS基因的CDS全长的大小3.138kb相一致。
2.2 pMD 18-T-BvSPS重组质粒的构建
将PCR获得的BvSPS基因片段进行回收,与pMD 18-T连接,并转化到DH5α感受态细胞中,涂布于含有Amp、IPTG和X-gal的LB固体培养基上。挑取白斑克隆,提质粒。通过对BvSPS基因序列的限制性内切酶分析,选取没有酶切位点的PstI和XbaI以及在1292bp位置上有一个酶切位点的EcoRI来对重组质粒进行酶切鉴定(图2A);而这3种限制性内切酶在T载体上均有一个酶切位点。
如图2B所示,经过PstI单酶切重组质粒,获得了5.83kb左右的片段,这与T载体(2.69kb)和BvSPS全长(3.14kb)加起来的总长基本一致;同时,利用T载体两侧的PstI和XbaI酶切位点酶切重组质粒,获得了两条位于3.14kb和2.69kb左右位置的条带,分别是BvSPS基因和T载体。为了更进一步的确认基因的正确性以及目的基因的插入方向,实验利用EcoRI酶切重组质粒,并获得了3.98kb和1.86kb左右的两条片段,根据EcoRI在BvSPS基因内部以及T载体上的位置,可以确定BvSPS基因被逆向插入到T载体上。
2.3 BvSPS基因的序列分析
根据BvSPS基因在Genbank中的登录号X81975,获得该基因的碱基及其开放读码框的氨基酸序列信息(表1)。BvSPS基因的cDNA全长为3138bp,它编码了1045个氨基酸;通过ExPASy软件分析,由这些氨基酸所组成的蛋白的分子量为118.18kDa,等电点为6.15;通过PSORT软件预测该蛋白定位于细胞核;该蛋白编码的甜菜蔗糖磷酸合成酶(EC=2.4.1.14)可以催化UDP-glucose+D-fructose 6-phosphate=UDP+sucrose 6(F)-phosphate反应,因而对蔗糖合成起着至关重要的作用。

表1 BvSPS基因及所编码蛋白的生物信息
3 讨论
蔗糖是甜菜根中糖积累的主要形式,是甜菜品质形成的重要因子,而甜菜蔗糖磷酸合成酶(BvSPS)在蔗糖代谢中起着重要作用,它的活性直接反映了甜菜体内蔗糖合成的能力。通过克隆BvSPS基因,可以进一步地将其构建于含有强启动子或根特异表达启动子的植物表达载体上,再重新转化到甜菜体内,利用密码子的偏爱性,使其在甜菜体内或其贮糖根部更加强效的表达,以期提高甜菜根的含糖量及甜菜品质。
[1]Fiew S,Willenbrend J.Sucrose synthase and sucrose phosphate synthase in sugar beet plants(Beta vulgaris L.ssp.altisima)[J].J Plant Physiol,1987,131:153-162.
[2]Farrar J,Pollock C,Gallagher J.Sucrose and the integration of metabolism in vascular plants[J].Plant Sci,2000,154:1-11.
[3]Huber SC,Huber JL.Role of sucrose phosphate synthase in sucrose metabolism in leaves[J].Plant Physiol.,1992,99:1275-1278.
[4]Hawker J S.Enzymes concerned with sucrose synthesis and transformations in seeds of maise,broad bean and castor bean[J].Phytochem,1971,10(10):2313-2322.
[5]Klein R R,Crafts Brandner S J,Salvucci M E.Cloning and developmental expression of the sucrose phosphate synthase gene from spinach[J].Planta,1993,190(4):498-510.
[6]Lunn J E,Macrae E.New complexities in the synthesis of sucrose[J].Curr Opin Plant Biol,2003,6(3):208-214.
[7]Cumino A,Curatti L,Giarrocco L,et al.Sucrose metabolism:Anabaena sucrose-phosphate synthase and sucrose-phosphate phosphatase define minmal functional domains shuffled during evolution[J].FEBS Lett,2002,517(1-3):19-23.
