山梨醇催化脱水制备异山梨醇的反应动力学
2010-09-09谢毓胜余定华李致贤
谢毓胜,余定华,孙 鹏,李 恒,李致贤
(1.南京工业大学化学化工学院,江苏南京210009;2.南京工业大学生物与制药工程学院,
江苏南京210009;3.南京工业大学材料化学工程国家重点实验室,江苏南京210009)
山梨醇催化脱水制备异山梨醇的反应动力学
谢毓胜1,余定华2,3,孙 鹏2,李 恒2,李致贤2
(1.南京工业大学化学化工学院,江苏南京210009;2.南京工业大学生物与制药工程学院,
江苏南京210009;3.南京工业大学材料化学工程国家重点实验室,江苏南京210009)
以浓硫酸为催化剂,对山梨醇催化脱水制备异山梨醇进行了研究。考察了催化剂用量(m(浓硫酸)∶m(山梨醇))、反应温度、反应压力对山梨醇催化脱水制备异山梨醇反应性能的影响。实验结果表明,较佳的反应条件为:m(浓硫酸)∶m(山梨醇)= 1∶100、反应压力3kPa(绝压)、反应温度403K,在此条件下反应90m in后,异山梨醇的收率达到80%。提出了山梨醇催化脱水制备异山梨醇的均相动力学模型,根据实验数据拟合得到动力学参数,山梨醇两步脱水反应的活化能分别为47.92, 51.00kJ/mol,指数前因子分别为21 655.0,3 487.9m in-1。对均相动力学模型的统计检验结果表明,该模型能很好地描述山梨醇催化脱水制备异山梨醇的反应过程。
山梨醇;异山梨醇;1,4-失水山梨醇;浓硫酸;催化脱水;动力学模型
葡萄糖的加氢产物山梨醇是重要的生物质转化平台化合物之一,其二次脱水产物异山梨醇具有特殊的分子结构——两个反位连接的四氢呋喃环和分别处于面内(C2)和面外(C5)的两个羟基,因此异山梨醇作为新型生物基材料广泛应用于食品、化妆品、医药、塑料及聚合物等领域。在2003年, Kricheldorf等[1]对以异山梨醇为单体的聚合物的性能和用途进行了综述。近年来的研究热点则是将异山梨醇作为共聚单体用于聚醚、聚酯、聚氨酯、聚碳酸酯等聚合物的改性。异山梨醇参与聚合的特点是改善聚合物的高温性能和抗冲击性[2,3]。异山梨醇在多种聚合物中的广泛应用推动了以山梨醇为原料生产异山梨醇的研究。
异山梨醇的制备方法主要是通过山梨醇两步脱水[4]:经一步脱水得到1,4-失水山梨醇后再进一步脱水得到异山梨醇。催化剂大多为酸性催化剂,其中常用的液体酸包括硫酸[5]、磷酸和对甲苯磺酸[6];固体酸包括HY、HZSM-5分子筛和酸性离子交换树脂等[7]。由于熔融的山梨醇具有黏度大和反应活性高等特点,因此山梨醇催化脱水反应的目标产物异山梨醇的收率偏低。对山梨醇催化脱水反应性能的优化有赖于反应工艺条件的研究以及在此基础上建立的反应动力学模型,但这方面的工作鲜见报道。
本工作以浓硫酸为催化剂,考察了催化剂用量(m(浓硫酸)∶m(山梨醇))、反应温度、反应压力、搅拌转速等因素对山梨醇催化脱水反应性能的影响;提出了山梨醇脱水制备异山梨醇的反应动力学模型,通过实验验证了该模型的适应性,为异山梨醇生产工艺的优化和规模放大提供了理论依据。
1 实验部分
1.1 试剂
山梨醇(纯度99.9%)、浓硫酸(纯度99.5%):国药集团化学试剂有限公司;去离子水:自制。山梨醇及其脱水产物的基本物化性质见表1。

表1 山梨醇及其脱水产物的物理化学性质Table1 Physicochem ical properties of sorbitol and its dehydration products
1.2 实验方法
反应器采用三口烧瓶,磁力搅拌,用油浴加热,温度控制精度为±0.5℃。烧瓶一口接温度计,一口接冷凝管和真空系统,一口为取样口。称取150g山梨醇装入烧瓶中,加热熔化,继续升温至反应所需温度,缓慢加入计量的浓硫酸,启动真空泵控制系统达到反应所需压力。在反应条件下为防止反应液暴沸,先预反应10m in,然后开始对脱水反应计时,并定时取样分析。
取样时停止抽真空,用移液枪取0.5~1.0g试样。取样后重新密封实验装置,继续抽真空至所需压力。取样时间大约30s,不计入反应时间。
1.3 分析方法
试样的预处理:准确称量试样,然后用去离子水稀释到50mL。采用戴安公司U-3000型高效液相色谱仪对试样进行分析。分析条件:HPX-87H有机酸柱,示差检测器,以0.005m ol/L的硫酸水溶液为流动相,流量0.5mL/m in,柱温65℃。
2 结果与讨论
2.1 搅拌转速对山梨醇催化脱水反应的影响
由于熔融的山梨醇黏度非常大,因此为了研究山梨醇催化脱水反应生成异山梨醇的反应动力学,有必要对反应器搅拌转速进行研究以消除扩散效应对反应的影响。
搅拌转速对山梨醇催化脱水初始反应速率的影响见图1。由图1可见,随搅拌转速的增加,山梨醇的初始反应速率增加,在搅拌转速等于25r/s时,山梨醇的初始反应速率达到最大值;再继续增加搅拌转速,山梨醇的初始反应速率基本保持不变。所以可认为,在搅拌转速大于25r/s时,消除了扩散对山梨醇催化脱水反应的影响[8]。在动力学研究和以下实验中,搅拌转速定为25r/s。

图1 搅拌转速对山梨醇催化脱水初始反应速率的影响Fig.1 Effect of stirring speed on initial reaction rate of sorbitol catalytic dehydration. Reaction conditions:383K,3kPa(absolute pressure), m(concentrated sulfuric acid)∶m(sorbitol)=1∶100.
2.2 m(浓硫酸)∶m(山梨醇)对山梨醇催化脱水反应的影响
m(浓硫酸)∶m(山梨醇)对山梨醇催化脱水反应的影响见图2。由图2a可见,反应60m in后, m(浓硫酸)∶m(山梨醇)不同时的山梨醇转化率均可达到97%(即达到平衡转化率),m(浓硫酸)∶m(山梨醇)只影响山梨醇的初始反应速率,这与催化剂活性物种的数量相一致。由图2b可见, m(浓硫酸)∶m(山梨醇)不同时的1,4-失水山梨醇收率随反应时间的变化趋势完全一致,即随反应时间的延长,1,4-失水山梨醇的收率先增加后降低,这符合连续反应的动力学特征。由图2c可见,随反应时间的延长,异山梨醇的收率增加;当m(浓硫酸)∶m(山梨醇)=1∶100时,异山梨醇的收率最大。这主要是由于浓硫酸的强酸性和高的催化活性所致,当浓硫酸用量过大时,易导致积碳和聚合等副反应的发生而使异山梨醇的收率降低;当浓硫酸用量过小时,具有催化活性的酸性位少导致反应速率较慢,异山梨醇的收率降低。综合考虑,选择m(浓硫酸)∶m(山梨醇)=1∶100较适宜。
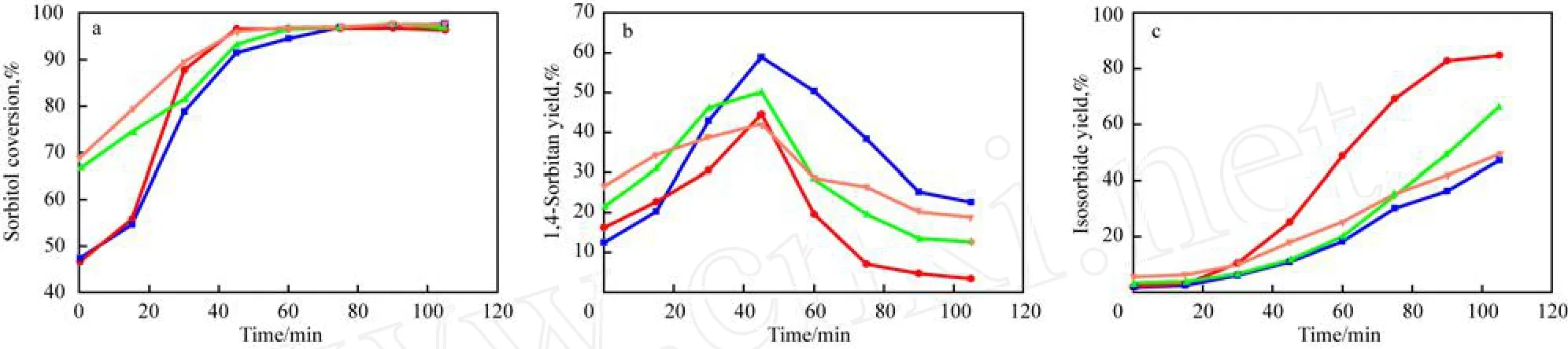
图2 m(浓硫酸)∶m(山梨醇)对山梨醇催化脱水反应的影响Fig.2 Effect of m(concentrated sulfuric acid)∶m(sorbitol)on sorbitol catalytic dehydration. Reaction conditions:403K,3kPa(absolute pressure). m(Concentrated sulfuric acid)∶m(Sorbitol):■ 0.5∶100;● 1.0∶100;▲ 1.5∶100;∀ 2.0∶100
2.3 反应压力对山梨醇催化脱水反应的影响
反应压力对山梨醇催化脱水反应的影响见图3。由图3a可见,随反应压力的降低,山梨醇达到平衡转化率的时间缩短,说明反应压力影响山梨醇的转化率,在反应压力为0.775kPa(绝压)时,反应进行30m in就已经达到平衡。由于反应压力降低,加快了反应生成水的挥发,且随抽真空的过程一同将水分离出去,所以加快了山梨醇催化脱水反应的进行。从图3b可看出,在不同的反应压力下,随反应时间的延长,1,4-失水山梨醇的收率先增加后降低。这与催化剂用量对1,4-失水山梨醇收率的影响规律相同,说明1,4-失水山梨醇是中间产物。从图3c可看出,反应压力越低,异山梨醇达到最大收率的时间越短,当反应压力为3kPa(绝压)时,反应100m in异山梨醇收率达到80%。
虽然降低反应压力能提高山梨醇的转化率和异山梨醇的收率,但如果延长反应时间到足够长,不同反应压力下的山梨醇催化脱水反应所能达到的山梨醇平衡转化率和异山梨醇平衡收率基本一致,说明反应压力对山梨醇催化脱水反应的影响主要在动力学方面,而对热力学基本无影响。
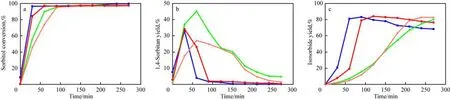
图3 反应压力对山梨醇催化脱水反应的影响Fig.3 Effect of reaction absolute pressure on sorbitol catalytic dehydration. Reaction conditions:403K;m(concentrated sulfuric acid)∶m(sorbitol)=1∶100. Absolute pressure/kPa:■ 0.775;● 3;▲ 12;▼ 101.3
2.4 反应温度对山梨醇催化脱水反应的影响
反应温度对山梨醇催化脱水反应的影响见图4。由图4a可见,随反应温度从383K升至413K,山梨醇达到平衡转化率的反应时间从120m in缩短到30m in,且转化率均达到97%以上,说明反应温度对山梨醇转化率的影响显著,即升高反应温度可加快山梨醇催化脱水的反应速率。由图4b可见,1,4-失水山梨醇收率随反应时间的延长先增加后降低;随反应温度的升高, 1,4-失水山梨醇收率达到最大值时的反应时间缩短,且1,4-失水山梨醇收率的降幅增大。这表明升高反应温度有利于1,4-失水山梨醇进一步脱水。由图4c可见,当反应温度为383K时,反应120m in异山梨醇的收率仅有20%;当反应温度升高到403K和413K时,反应90m in后异山梨醇的收率均达到80%。
综上所述,m(浓硫酸)∶m(山梨醇)、反应压力和反应温度对山梨醇催化脱水制备异山梨醇的反应速率均有明显影响,且影响产物的收率。山梨醇催化脱水反应的较佳条件为:m(浓硫酸)∶m(山梨醇)=1∶100、3kPa(绝压)、403K,在此条件下反应90m in后,异山梨醇的收率达到80%。

图4 反应温度对山梨醇催化脱水反应的影响Fig.4 Effect of reaction temperature on sorbitol catalytic dehydration. Reaction conditions:absolute pressure3kPa,m(concentrated sulfuric acid)∶m(sorbitol)=1∶100. Reaction temperature/K:■ 383;● 393;▲ 403;▼ 413
3 反应动力学
3.1 动力学模型
山梨醇为链式多元醇,所有羟基皆可参与脱水反应,所以脱水反应有多种可能[6]。山梨醇催化脱水的主反应是脱去一分子水得到1,4-失水山梨醇,再脱去一分子水得到异山梨醇。山梨醇脱水的主要反应见图5。
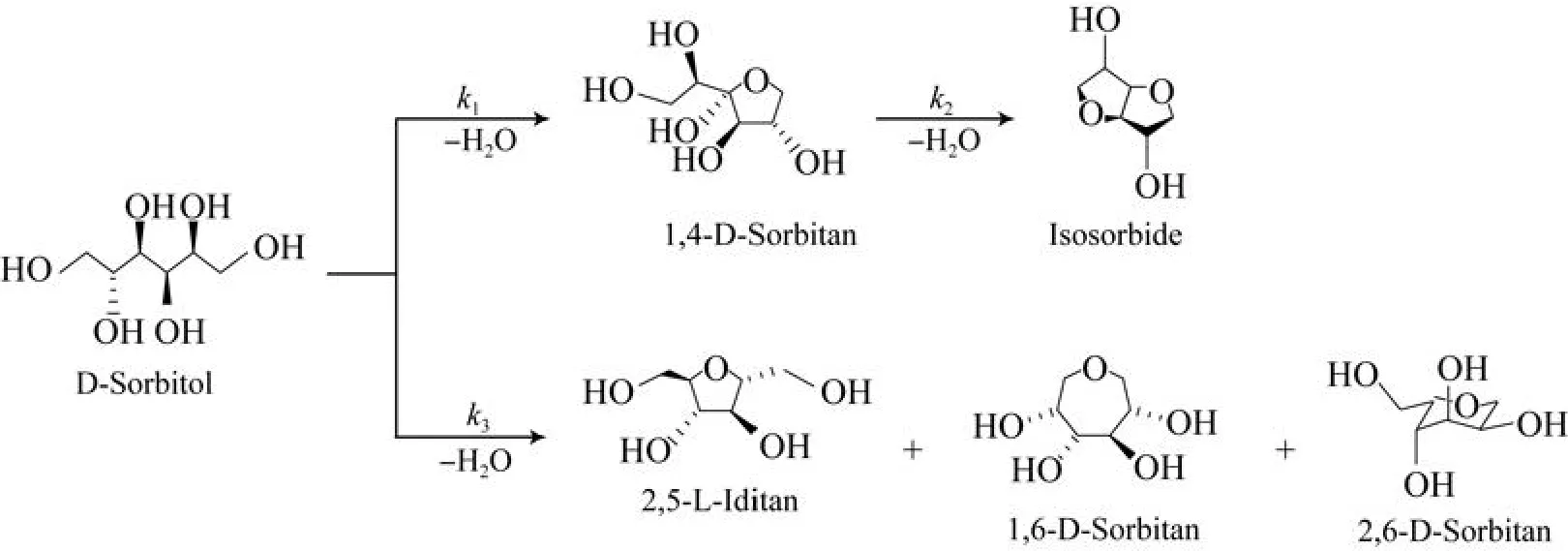
图5 山梨醇催化脱水反应Fig.5 Sorbitol catalytic dehydration.
根据山梨醇脱水反应实验数据进行碳平衡计算发现,副反应产物所占比率大于10%,所以在动力学研究时不能忽略副反应。为了简化起见,把副反应归结于一个反应项里,则山梨醇脱水反应为平行反应加串连反应的复杂反应形式[9]。忽略山梨醇分子间脱水反应,山梨醇脱水反应为分子内脱水,属于单分子反应。假设山梨醇所有脱水反应都为一级反应,把副反应归结于一个反应项里用k3cSBT表示。选用幂函数形式动力学模型,提出山梨醇催化脱水反应动力学模型:
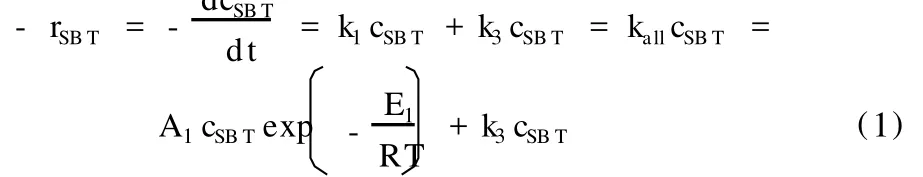
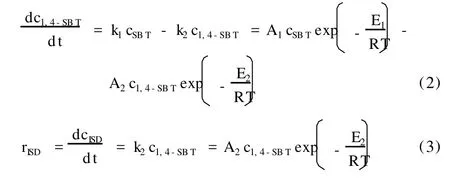
3.2 动力学参数的拟合
在减压条件下山梨醇脱水反应激烈,不易于动力学实验数据的测定,因此在常压、m(浓硫酸)∶m(山梨醇)=1∶100、3个温度(393,403,413K)条件下进行反应动力学实验,得到山梨醇、异山梨醇和1,4-失水山梨醇的浓度(c)~时间(t)曲线。由c~t曲线通过多项式拟合微分法计算得到各物质

3.3 动力学模型的检验
异山梨醇和山梨醇浓度的实验值与计算值的比较见图9。由图9可看出,计算值和实验值基本相符合。对山梨醇脱水反应动力学模型进行严格的统计检验[11],统计检验结果表明,动力学模型参数的残差分布基本符合正态分布,数据相关系数均大于0.95,统计重要值小于0.05,表明所提出的动力学模型具有可靠性。
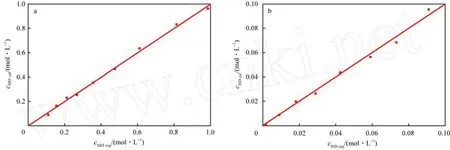
图9 山梨醇(a)和异山梨醇(b)浓度的实验值与计算值的比较Fig.9 Comparison between experimental values and calculated values for concentrations of sorbitol(a)and isosorbide(b).
4 结论
(1)以浓硫酸为催化剂,山梨醇催化脱水制备异山梨醇的适宜反应条件为:m(浓硫酸)∶m(山梨醇)=1∶100,反应压力3kPa(绝压),反应温度413K,在此条件下反应90m in后,异山梨醇的收率达到80%。
(2)减压有利于加快山梨醇脱水反应速率,但并不改变山梨醇转化率和异山梨醇的收率,即压力对反应动力学的影响较大,对热力学的影响较小。
(3)提出了山梨醇脱水反应动力学模型,得到动力学参数。对山梨醇脱水反应动力学模型进行统计检验表明,该模型能很好地描述山梨醇脱水制备异山梨醇反应过程,可指导工业生产。

1 Kricheldorf H R,Chatti S,Schwarz G,et al.M acrocycles27: Cyclic A liphatic Polyesters of Isosorbide.J Polym Sci,Part A: Polym Chem,2003,41(21):3 414~3 424
2 Kricheldorf H R,Behnken G,Sell M.Influence of Isosorbide on Glass2Transition Temperature and Crystallinity of Poly(Butylene Terephthalate).J Macromol Sci,PartA:Pure Appl Chem,2007, 44(7):679~684
3 Gohil R M.Properties and Strain Hardening Character of Polyethy2 lene Terephthalate Containing Isosorbide.Polym Eng Sci,2009,49 (3):544~553
4 A tlas Chem ical Industries,Inc.Purification of Isosorbide.US Pat Appl,US3160641.1964
5 A rcher2Daniels2M idland Company.Process for the Production of Anhydrosugar A lcohols.US PatAppl,US6849748.2005
6 A tlas Chem ical Industries,Inc.Separation of Hexitans.US Pat Appl,US3484459.1969
7 E I Du Pont de Nemours and Company.Integrated Continuous Process forAnhydro SugarA lcoholM anufacture.US PatAppl,US 6864378,2005
8 王胜年,洪学伦,王树东等.C r-Zn催化剂上甲醇水蒸气转化反应动力学Ⅰ.本征动力学.石油化工,2001,30(4):259~262
9 傅献彩,沈文霞,姚天扬等编.物理化学(下册).第5版.北京:高等教育出版社,2005.181~193
10 H斯科特·福格勒.化学反应工程.第3版.李术元,朱建华译.北京:化学工业出版社,2005.198~206
11 张威,刘志军,李艳红.数值分析与科学计算.北京:清华大学出版社,2008.258
(编辑 李治泉)
Reaction Kinetics of Sorbitol Catalytic Dehydration to Isosorbide
Xie Yusheng1,Yu D inghua2,3,Sun Peng2,Li Heng2,L i Zhixian2
(1.College of Chem istry and Chem ical Engineering,Nanjing University of Technology,Nanjing Jiangsu210009,China; 2.College of L ife Science and Pharmacy,Nanjing University of Technology,Nanjing Jiangsu210009,China;3.State Key Laboratory ofM aterials2O riented Chem ical Engineering,Nanjing University of Technology,Nanjing Jiangsu210009,China)
W ith concentrated sulfuric acid as catalyst,dehydration of sorbitol to isosorbide and its kinetics w ere studied.Effects of catalyst dosage,reaction temperature and reaction pressure on the dehydration w ere investigated.U nder optim um reaction conditions:m(concentrated sulfuric acid)∶m(sorbitol)1∶100,3kPa(absolute pressure),403K,90m in,yield of isosorbide could reach80%. A homogeneous reaction kinetics model for sorbitol catalytic dehydration to isosorbide was established. In the two2step reaction for sorbitol dehydration,activation energy and pre2exponential factor for sorbitol to1,42sorbitan are47.92kJ/mol and21 655.0m in-1,and those for1,42sorbitan to isosorbide are 51.00kJ/mol and3 487.9m in-1,respectively.Statistical test showed that the proposed model could well fit the reaction process.
sorbitol;isosorbide;1,42sorbitan;concentrated sulfuric acid;catalytic dehydration; kinetics m odel
book=3,ebook=74
1000-8144(2010)03-0285-06
TQ013.2
A
2009-10-21;[修改稿日期]2009-12-18。
谢毓胜(1981—),男,江西省赣州市人,硕士生,电邮leastno@163.com。联系人:余定华,电话025-83172094,电邮bio2 tech@njut.edu.cn。
国家自然科学基金项目(20906051);江苏省自然科学基金项目(BK2009478);南京工业大学学科基金重点项目。
