聚合物强化超滤技术分离Hg2+和Cd2+的研究
2010-09-09曾坚贤郑立锋孙霞辉贺勤程湖南科技大学化学化工学院湖南湘潭411201
曾坚贤,郑立锋,孙霞辉,贺勤程 (湖南科技大学化学化工学院,湖南 湘潭 411201)
聚合物强化超滤技术分离Hg2+和Cd2+的研究
曾坚贤*,郑立锋,孙霞辉,贺勤程 (湖南科技大学化学化工学院,湖南 湘潭 411201)
以聚丙烯酸钠为络合剂,研究Hg2+和Cd2+混合溶液的络合超滤分离行为.考察了pH值、负载比(LR)及外加盐浓度对混合体系分离的影响.结果表明,当pH值从5增大到7.5时,2种离子分离系数(S)逐渐下降,最适pH值为5;当LR从0.01增大到2时,S逐渐升高到最大值,此后迅速降低,LR=1.5时S达到最大值;Na2SO4的加入影响S值.控制混合溶液pH=5及LR=1.5,当体积浓缩因子为15时,截留液汞浓度(Cr,Hg)从30mg/L线性递增至444.9mg/L,截留液镉浓度(Cr,Cd)仅从30mg/L升高至35.4mg/L,S值约为227.浓缩液随着洗涤水体积增大,Cr,Hg基本不变,而Cr,Cd下降至5.24mg/L.收集各渗透液,调整至pH=6及LR=0.033予以浓缩,浓缩13倍时,Cr,Cd从27.37mg/L升高到354.7mg/L.
Hg2+;Cd2+;聚丙烯酸钠;络合;超滤
Abstract:Polymer-enhanced ultrafiltration was investigated to separate selectively Hg2+and Cd2+from aqueous solutions by using poly (acrylic acid) sodium salt as a complexing agent. Effects of pH, loading ratio (LR) and the added salt on separation coefficient (S) were investigated. When pH increased from 5 to 7.5, S decreased gradually. Controlling pH=5 was helpful to achieve the selective separation. At LR between 0.01 and 2, S increased with LR, reached a maximum value, and then decreased rapidly. It was preferable for the selective separation to control LR=1.5. S changed in the present of sodium sulfate. A concentration experiment was carried out at pH=5 and LR=1.5. When volume concentration factor (VCF) reached 15, mercury concentration in the retentate (Cr,Hg) increased linearly from 30 mg/L to 444.9 mg/L, whereas cadmium concentration in the retentate (Cr,Cd) changed only from 30 mg/L to 35.4 mg/L. S was about 227. Then, the final concentrated solution was used to study the process of washing. With increasing the washing water volume, Cr,Hgdid not change, but Cr,Cddecreased rapidly to 5.24 mg/L. Further, another concentration experiment was performed at pH=6 and LR=0.033 by using all permeate solutions. At VCF=13, Cr,Cdincreased from 27.37 mg/L to 354.7 mg/L.
Key words:Hg2+;Cd2+;poly (acrylic acid) sodium salt;complexation;ultrafiltration
从废水中分离重金属离子具有实际意义[1-4],聚合物强化超滤技术在该领域中展示了良好应用前景[5-9],该技术先以大分子水溶性聚合物络合目标金属离子,再借助超滤膜予以截留,使得被“绑定”在聚合物上的金属离子获得分离浓缩[10-13].近年来,一些研究者尝试采用该技术选择性分离金属离子[14-16],但大多基于操作条件的优化,鲜见以单一溶液与混合溶液的对比研究,混合溶液浓缩及进一步洗涤分离更少见报道.
聚丙烯酸钠(PAASS)对Hg2+和Cd2+络合容量分别为1.0g Hg2+/g PAASS和0.033 g Cd2+/g PAASS,且Hg2+截留系数在较低pH值时才下降,Cd2+截留系数在pH5~6变化明显,Hg2+对PAASS具有更强的亲和能力[17-18].本研究以PAASS为络合剂,考察操作参数对Cd2+和Hg2+混合溶液分离特性的影响,并与单一溶液比较,研究混合溶液浓缩行为,考察浓缩液洗涤及渗透液浓缩过程.
1 材料与方法
1.1材料
2种中空纤维超滤膜由天津膜天膜工程技术有限公司提供,型号为UEIP-503和UEOS-503,截留分子量分别为2×104和6×103,前者仅用于预处理PAASS,后者用于其他实验.膜的其他特性参数见文献[19].
所有药品均采用分析纯.PAASS(日本和光纯药工业株式会社),平均分子量2.5×105;硝酸汞(江苏泰兴化学试剂厂);硝酸镉(沈阳化学试剂厂);硫酸钠(上海金山化工厂);1mol/L硝酸和氢氧化钠用于调节溶液pH值.
1.2实验装置与仪器
实验装置如图1所示.原料液加入料液罐中,经泵驱动进入膜组件,在压差推动下,渗透液径向透过超滤膜,截留液返回料液罐.跨膜压差由水银压差计测定,其变化范围为5~50kPa;以电子天平测量一定时间内渗透侧流出的液体质量,并换算成膜通量[L/(m2·h)].未作说明时,超滤体系参数均为:压差为22.2kPa,流量为60L/h,温度为25℃,外加盐浓度为0.

图1 实验装置示意Fig.1 Schematic diagram of the experimental apparatus 1.恒温槽;2.料液罐;3.泵;4.阀门;5.水银压差计;6.膜组件
Mettler Toledo 320-S型pH计(梅特勒托利多仪器有限公司),测定各溶液pH值;AA-670型原子吸收分光光度计(日本岛津株式会社),测定Cd2+浓度[20];752N型紫外可见分光光度计(上海精密科学仪器有限公司),用于PAASS溶液预处理过程及双硫腙分光光度法测定Hg2+浓度[20].
1.3实验方法
以硝酸汞和硝酸镉的1种或2种配制单一或混合金属离子溶液,混合溶液Hg2+和Cd2+质量浓度相等,未说明时Hg2+和Cd2+浓度均为10mg/L.负载比(LR)定义为金属离子浓度总和与聚合物浓度的比值,即:单一金属离子溶液LR=(gHg2+或gCd2+)/g PAASS;混合金属离子溶液LR=(gCd2++gHg2+)/g PAASS.PAASS使用前需预处理,以除去低分子量部分,其过程为:以UEIP-503膜过滤较高浓度PAASS溶液,加入去离子水洗涤,移走渗透液,采用752N紫外可见分光光度计在波长207nm定时测定渗透液PAASS浓度[19],至检测不到溶质,即预处理结束,截留液用于UEOS-503膜实验.操作参数对金属离子截留系数和分离系数影响:在特定条件下,将一定量PAASS与单一或混合金属离子溶液充分混合后搅拌1h,然后进行超滤实验.混合溶液浓缩、截留液洗涤及渗透液浓缩:控制pH=5,Hg2+和Cd2+离子浓度均为30mg/L,PAASS浓度为40mg/L,料液总体积为30L,最大浓缩因子为15,最终浓缩液为2L;将该浓缩液用于洗涤研究,洗涤液为pH=5硝酸溶液,每次加入0.5L洗涤液,获得0.5L渗透液后再加入下批洗涤液,洗涤液总用量为4.5L;收集各阶段渗透液,调整pH=6和LR=0.033,超滤浓缩Cd2+.
金属离子截留系数(Ri)及分离系数(S)是描述离子分离程度的重要指标,采用如下公式计算:

式中:Cp,i、Cr,i分别为渗透液和截留液中金属离子 (Hg2+或Cd2+)的浓度; Cp,Cd、Cp,Hg分别为渗透液中Cd2+和Hg2+浓度;Cr,Cd、Cr,Hg分别为截留液中Cd2+和Hg2+浓度;RCd、RHg分别为Cd2+和Hg2+的截留系数.S越大意味着RCd越小而RHg越大,表明2种离子分离程度越明显.
2 结果与讨论
2.1操作参数对金属离子截留系数和分离系数的影响
2.1.1pH值的影响 pH值显著影响金属离子络合特性,因而对混合体系离子分离起重要作用.由图2可见,在低LR下,当pH值从5增大到7.5时,混合溶液与单一溶液RHg相同,表明离子混合不影响PAASS对Hg2+络合行为.当pH值从5增大到6时,混合溶液较单一溶液有更高RCd;pH值超过6时,混合溶液与单一溶液RCd相同且接近1.这一现象可解释为,由于LR值远低于Hg2+在pH5时的临界负载比(LRCr=1)[17],过量PAASS能完全络合Hg2+,混合溶液与单一溶液络合情形相同.Cd2+却有不同现象,混合体系LR为0.033,对每单一金属离子为0.0165,尽管Hg2+存在已占据部分络合位,但Hg2+高临界负载比使得未参与络合的PAASS浓度较单一Cd2+时高,故混合溶液较单一溶液有更高RCd.在高LR下,混合溶液较单一溶液有更高RHg,且前者RHg接近1,不随pH值变化;混合溶液较单一溶液RCd低.表明Hg2+加入削弱了Cd2+与PAASS的络合作用,这可能是高LR使得PAASS不能完全“捕获” Hg2+和Cd2+,此时发生2种离子竞争络合位的反应.Hg2+对PAASS具有更强亲和能力,优先与络合位结合,Cd2+络合剩余络合位,故RHg升高且接近1,而RCd下降.由表1可见,在LR=0.033下,pH>6时S非常低,此时PAASS不能将Hg2+和Cd2+分离,只能同时浓缩;当LR=1.5时,S随pH值增大而下降,表明升高pH值不利于混合体系分离.选取pH5适宜Hg2+和 Cd2+分离.
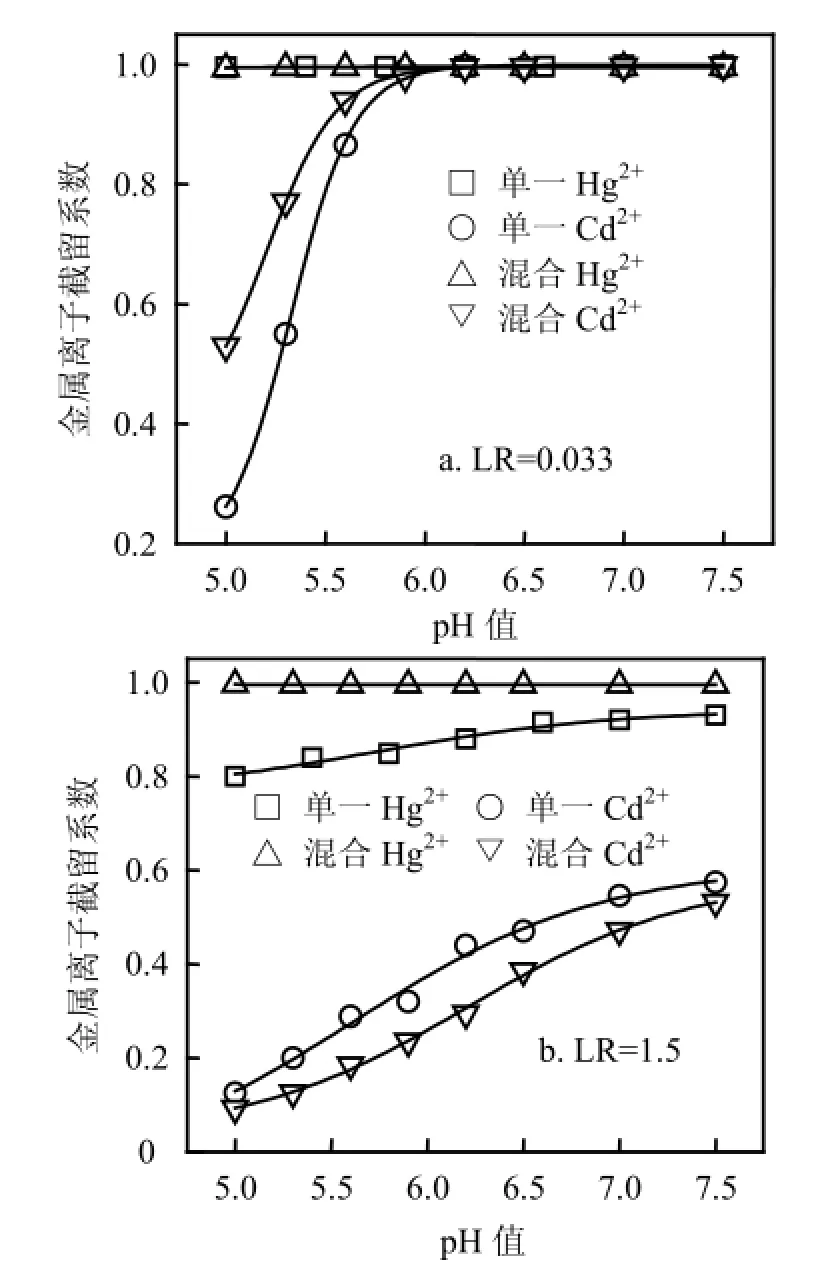
图2 不同LR下pH值对混合溶液及单一溶液Ri的影响Fig.2 Effect of pH value on rejection coefficients for mixture and single solutions at different LR values
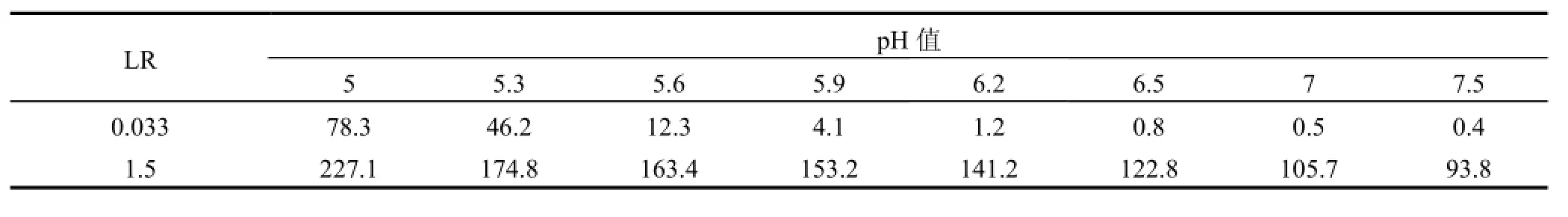
表1 不同LR下pH值对S的影响Table 1 Effect of pH value on separation coefficient at different LR values
2.1.2LR值的影响 LR值是影响Ri的另一重要因素,当溶液中有不同离子共存时,改变LR使得络合效应发生变化,进而影响分离程度.
由图3可见,当混合溶液LR低于单一Hg2+溶液临界负载比(LRCr=1)时,混合体系RHg维持在1左右,而RCd较单一Cd2+体系更高;反之,混合体系RHg升高而RCd降低.这些现象可解释为,低LR下混合溶液中聚合物浓度较高,尽管Hg2+占据了部分络合位,但剩余络合位仍高于单一Cd2+体系,故RCd升高;高LR下聚合物浓度较低,Hg2+和Cd2+竞争络合位,前者对PAASS具有强的亲和能力,使得RHg升高而RCd降低.此外,在高LR下,当pH值从5增大到6时,RCd下降幅度逐渐增大.在LR=2下,当pH值为5时,RCd由单一溶液0.105降低至混合溶液0.052,下降50.5%;当pH值为6时,RCd由单一溶液0.236下降至混合溶液0.067,下降71.6%.从表2可以看出,当LR从0.01增大到1.5时,S逐渐升高并达到最大值,表明适当提高金属离子浓度有利于分离,进一步增大LR至2,S迅速降低.这可解释为,当LR<1.5时,混合溶液RHg维持在1左右,RCd随LR增大而下降,因而S不断升高.当LR增大到2时,RCd不断降低的同时RHg也下降,故S迅速变小.因此,控制LR = 1.5可使Hg2+和Cd2+分离效果良好.2.1.3外加盐浓度的影响 外加盐干扰金属离子与聚电解质竞争反应,改变离子间分离程度.由图4a可见,随着盐浓度增大,混合及单一溶液RHg下降相对平缓,最大下降2%,表明汞络合物对盐浓度变化不敏感.单一溶液RCd随盐浓度增大迅速降低,最大下降11.5%,混合溶液RCd下降较为缓慢,最大下降3.5%.可见,盐浓度增大导致RHg和RCd的下降幅度不一样,这将影响两者的分离,从表3可以看出,此时S随Na2SO4浓度增大而略有升高,意味着在较高pH值和较低LR下,外加盐在一定程度上有助分离.由图4b可见,混合及单一溶液RHg最大下降分别为3.6%和5.5%,盐浓度对RHg的影响较图4a略微增大;混合溶液较单一溶液有稍低RCd值,盐浓度对Cd2+的影响程度降低.可见,在此条件下,外加盐使RHg下降幅度稍微增大,RCd下降幅度变小,S随Na2SO4浓度增大而下降较快,外加盐不利于分离.2.2 混合溶液的浓缩
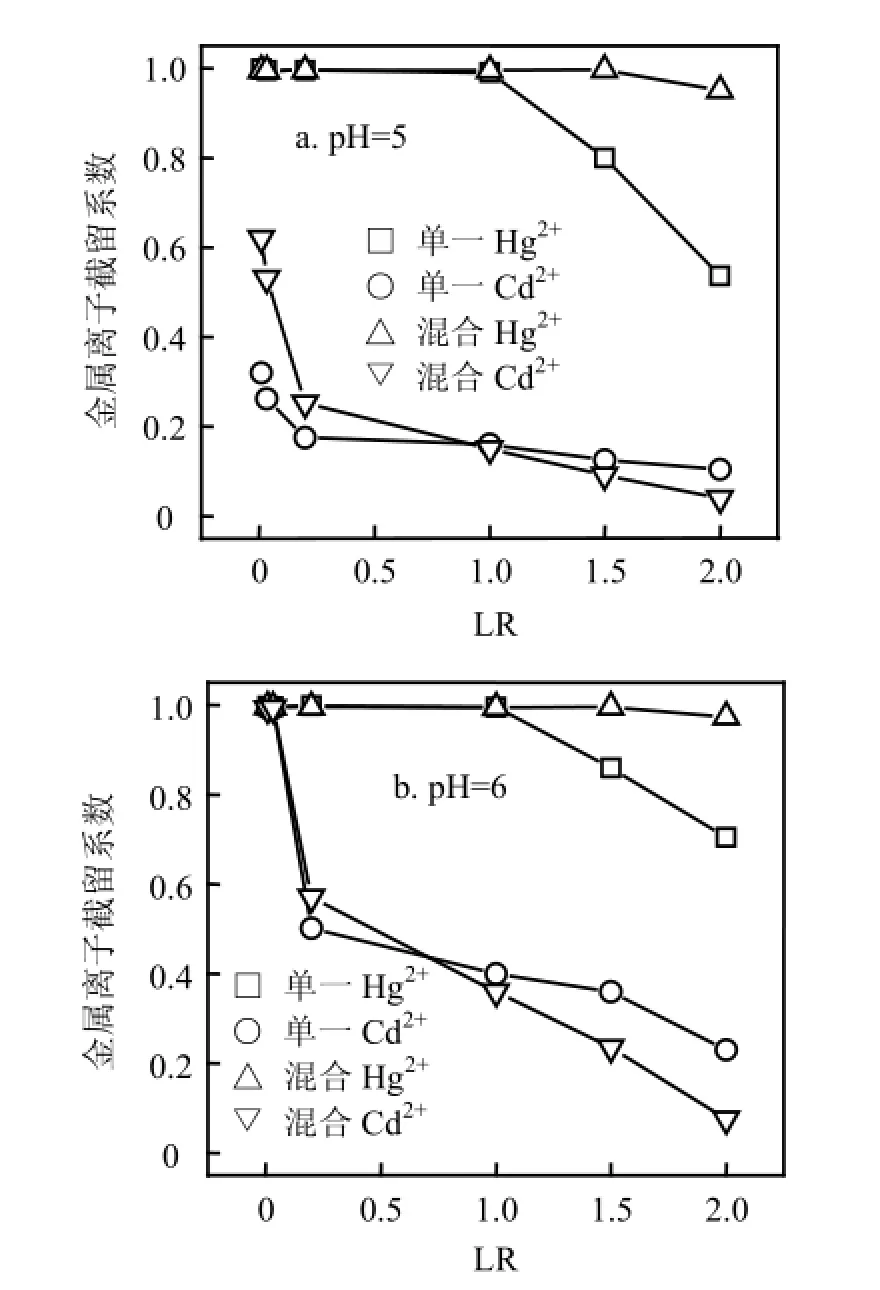
图3 不同pH值下LR对混合溶液及单一溶液Ri的影响Fig.3 Effect of loading ratio on rejection coefficients for mixture and single solutions at different pH values
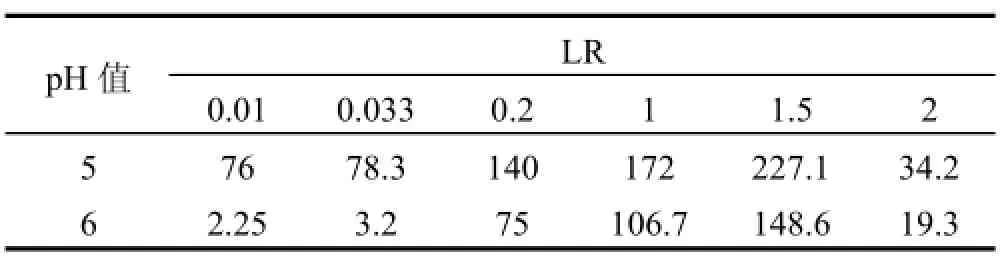
表2 不同pH值下LR对S的影响Table 2 Effect of loading ratio on separation coefficient at different pH values

图4 不同pH值和LR下Na2SO4浓度对混合溶液及单一溶液Ri的影响Fig.4 Effect of Na2SO4concentration on rejection coefficients for mixture and single solutions at different pH and LR values

表3 不同pH值和LR下Na2SO4浓度对S的影响Table 3 Effect of Na2SO4concentration on separation coefficient at different pH and LR values
为提高金属离子分离程度,在pH=5和LR=1.5下将Hg2+和Cd2+混合溶液超滤浓缩,考察体积浓缩因子(以VCF表示,定义为原料液体积与截留液体积之比)对Cr,Hg、Cr,Cd、S、Ri及膜通量(J)的影响.由图5可见,随着VCF增大,Cr,Hg线性递增,当VCF为15时,Cr,Hg高达444.9mg/L,表明Hg2+已被有效浓缩.Cr,Cd随VCF增大略有升高,料液浓缩15倍时Cr,Cd仅为35.4mg/L,即Cd2+浓缩程度非常小.2种金属离子在一定程度上实现了分离.S基本不变,约为227,浓缩操作不影响2种离子分离程度,这从聚电解质络合机理可获得解释.在整个浓缩过程中,RHg非常接近1,而RCd很低,这与Cr,Hg和 Cr,Cd变化一致.另外,随着VCF增大, J略有下降,VCF=15时J下降率为19.4%,表明在此研究条件下膜污染轻微.
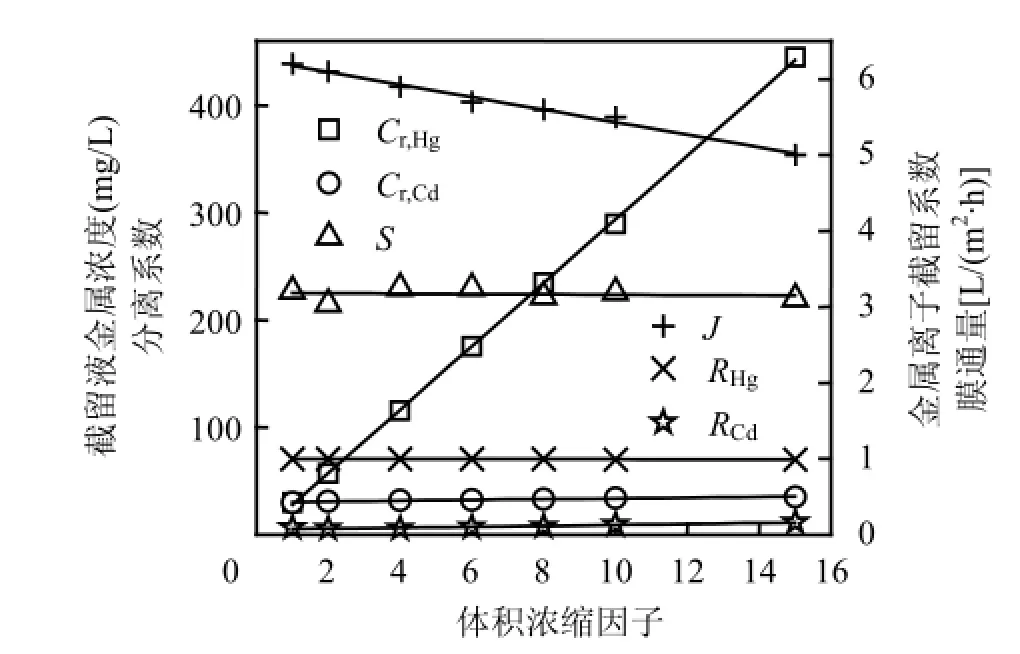
图5 VCF对Cr,Hg、Cr,Cd、S、Ri及J的影响Fig.5 Effect of volume concentration factor on metal concentrations in the retentate, separation coefficient, metal rejection coefficient and permeate flux
2.3截留液洗涤及渗透液的浓缩
超滤浓缩后得2L截留液,其Hg2+和Cd2+浓度分别为444.9,35.4mg/L,为了进一步分离金属离子,需对截留液予以洗涤;另外,渗透液中含大量Cd2+需进行浓缩.考察洗涤过程对Cr,Cd、Cr,Hg和J的影响.由图6可见,随着洗涤水体积增大, Cr,Cd不断下降,Cr,Hg则基本不变.当洗涤水体积为3.5L,即为初始截留液体积1.75倍时,Cr,Cd下降幅度明显变小,洗涤结束后为5.24mg/L,这部分Cd2+被PAASS捕获,不以游离态存在.另外,体系膜通量在此过程中基本不变,大致与浓缩结束时相等.为了浓缩Cd2+,收集浓缩及洗涤过程中渗透液,得料液体积32.5L,其Cd2+浓度为27.37mg/L,调整pH6及LR=0.033,络合平衡后超滤浓缩,考察渗透液体积对RCd和J的影响.由图7可见,整个过程中RCd接近1,当渗透液体积为30L,截留液体积为2.5L,即浓缩13倍时,截留液镉浓度为354.7mg/L,镉获得有效浓缩.此外,该过程膜通量变化规律与混合溶液的浓缩过程类似.

图6 洗涤水体积对Cr,Cd、Cr,Hg和J的影响Fig.6 Effect of washing water volume on metal concentrations in the retention and permeate flux

图7 渗透液体积对RCd和J的影响Fig.7 Effect of permeate volume on cadmium rejectioncoefficient and permeate flux
3 结论
3.1当pH值从5增大到7.5时,在低LR下,混合溶液较单一溶液RCd高,RHg相等且接近1;在高LR下,混合溶液较单一溶液有更高RHg,而RCd降低;降低pH可以提高S值,选用pH5有利于分离.3.2当LR从0.01增大到2时,如果混合溶液LR低于Hg2+临界负载比,混合溶液较单一溶液RCd为高,RHg不变;反之,混合溶液较单一溶液RHg升高而RCd降低;适当增大LR可提高S,当LR=1.5时S达到最大值.
3.3在pH=6和LR=0.033下,当Na2SO4浓度从0增大到0.1mol/L时,RHg和RCd下降幅度不同,S略有升高;在pH=5和LR=1下,RHg和RCd下降幅度随盐浓度增大分别变大和变小,S下降.
3.4在pH=5和LR=1.5下浓缩Hg2+和Cd2+混合体系,VCF=15时Cr,Hg从30mg/L呈线性递增至444.9mg/L, Cr,Cd仅从30mg/L升高至35.4mg/L, RHg接近1而RCd非常低,S约为227,膜通量衰减缓慢.
3.5将浓缩液洗涤,随着洗涤水体积增大,截留液中Hg2+浓度基本不变,而Cd2+浓度下降至5.24mg/L.收集各渗透液,调整至pH=6及LR= 0.033予以浓缩,截留液中镉可浓缩至354.7mg/L.通过控制适宜pH及LR,Hg2+和Cd2+混合体系可有效分离.
[1] 黄瑾辉,曾光明,方瑶瑶,等.基于复配胶团的强化超滤处理含镉废水 [J]. 中国环境科学, 2007,27(3):317-321.
[2] 王春峰,李健生,王连军,等.粉煤灰合成NaA型沸石对重金属离子的吸附动力学 [J]. 中国环境科学, 2009,29(1):36-41.
[3] Borbély G, Nagy E. Removal of zinc and nickel ions by complexation–membrane filtration process from industrial wastewater [J]. Desalination, 2009,240(1-3):218-226.
[4] Guan B H, Ni W M, Wu Z B, et al. Removal of Mn(II) and Zn(II) ions from flue gas desulfurization wastewater with water-soluble chitosan [J]. Separation and Purification Technology, 2009,65(3): 269-274.
[5] Cañizares P, Pérez A, Camarillo R, et al. Simultaneous recovery of cadmium and lead from aqueous effluents by a semicontinuous laboratory-scale polymer enhanced ultrafiltration process [J]. Journal of Membrane Science, 2008,320(1/2):520-527.
[6] Llanos J, Pérez A, Cañizares P. Copper recovery by polymer enhanced ultrafiltration (PEUF) and electrochemical regeneration [J]. Journal of Membrane Science, 2008,323(1):28-36.
[7] Korus I, Loska K. Removal of Cr(III) and Cr(VI) ions from aqueous solutions by means of polyelectrolyte-enhanced ultrafiltration [J]. Desalination, 2009,247(1-3):390-395.
[8] Trivunac K, Stevanovic S. Removal of heavy metal ions from water by complexation-assisted ultrafiltration [J]. Chemosphere, 2006,64(3):486-491.
[9] Molinari R, Gallo S, Argurio P. Metal ions removal from wastewater or washing water from contaminated soil by ultrafiltration-complexation [J]. Water Research, 2004,38(3):593-600.
[10] Bessbousse H, Rhlalou T, Verchère J F, et al. Sorption and filtration of Hg (II) ions from aqueous solutions with a membrane containing poly(ethyleneimine) as a complexing polymer [J]. Journal of Membrane Science, 2008,325(2):997-1006.
[11] Molinari R, Poerio T, Argurio P. Chemical and operational aspects in running the polymer assisted ultrafiltration for separation of copper(II)–citrate complexes from aqueous media [J]. Journal of Membrane Science, 2007,295(1/2)139-147.
[12] Li C W, Cheng C H, Choo K H, et al. Polyelectrolyte enhanced ultrafiltration (PEUF) for the removal of Cd (II): Effects of organic ligands and solution pH [J]. Chemosphere, 2008,72(4): 630-635.
[13] Cañizares P, Lucas A D, Pérez A, et al. Effect of polymer nature and hydrodynamic conditions on a process of polymer enhanced ultrafiltration [J]. Journal of Membrane Science, 2005,253(1/2): 149-163.
[14] Molinari R, Argurio P, Poerio T, et al. Selective separation of copper(II) and nickel (II) from aqueous systems by polymer assisted ultrafiltration [J]. Desalination, 2006,200(1-3):728-730.
[15] Cañizares P, Pérez Á, Camarillo R, et al. Selective separation of Pb from hard water by a semi-continuous polymer-enhanced ultrafiltration process (PEUF) [J]. Desalination, 2007,206(1-3): 602-613.
[16] Rether A, Schuster M. Selective separation and recovery of heavy metal ions using water-soluble N-benzoylthiourea modified PAMAM polymers [J]. Reactive and Functional Polymers, 2003,57(1):13-21.
[17] 曾坚贤,叶红齐.聚合物强化超滤过程处理含Hg2+废水 [J]. 化学工程, 2008,36(12):58-62.
[18] 曾坚贤,叶红齐.络合-超滤耦合技术处理Cd2+模拟废水的研究[J]. 高校化学工程学报, 2008,22(5):883-887.
[19] 曾坚贤,叶红齐,刘 辉,等.聚丙烯酸钠在中空纤维超滤膜表面的吸附研究 [J]. 高校化学工程学报, 2007,21(4):563-568.
[20] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002: 265-266.
Separation of Hg2+and Cd2+by using polymer-enhanced ultrafiltration.
ZENG Jian-xian*, ZHENG Li-feng, SUN Xia-hui, HE Qin-cheng (College of Chemistry and Chemical Engineering, Hunan University of Science and Technology, Xiangtan 411201, China). China Environmental Science, 2010,30(6):780~785
X703.5
A
1000-6923(2010)06-0780-06
曾坚贤(1970-),男,湖南涟源人,副教授,博士,主要从事膜法水处理技术的研究.发表论文21篇.
2009-11-12
国家自然科学基金资助项目(20976040);湖南省科技计划资助项目(2009SK3036)
* 责任作者, 副教授, zengjianxian@163.com
