灵菌红素对有害藻类的除藻活性研究
2010-09-09刘伯雅魏东芝鲁思然周文瑜沈亚领王金辉华东理工大学生物反应器工程国家重点实验室上海007国家海洋局东海环境监测中心上海007武汉大学生命科学学院湖北武汉4007
刘伯雅,魏东芝,鲁思然,周文瑜,沈亚领*,徐 韧,王金辉(.华东理工大学生物反应器工程国家重点实验室,上海 007;.国家海洋局东海环境监测中心,上海 007;.武汉大学生命科学学院,湖北 武汉4007)
灵菌红素对有害藻类的除藻活性研究
刘伯雅1,魏东芝1,鲁思然3,周文瑜1,沈亚领1*,徐 韧2,王金辉2(1.华东理工大学生物反应器工程国家重点实验室,上海 200237;2.国家海洋局东海环境监测中心,上海 200137;3.武汉大学生命科学学院,湖北 武汉430072)
研究了沙雷氏菌的天然产物灵菌红素对引起海洋赤潮和淡水水华的有害藻类的除藻活性和光解性质.结果表明,5.0μg/mL灵菌红素能够在24h内将新月菱形藻、中肋骨条藻、水华鱼腥藻和微小平列藻培养液中的藻类全部杀死,除藻活性高达100%.5.0μg/mL灵菌红素在30000lx光强下36h完全分解,不会给自然环境带来二次污染.
灵菌红素;除藻;赤潮;水华;光解
Abstract:Prodigiosin (PG), a secondary metabolite (red pigment) produced by Serratia marcescens and other bacteria, possesses a lot of bioactivity. However, its algicidal effect was not researched in detail. The algicidal activity of prodigiosin against harmful algae, causing red tide and fresh water bloom, and its light decomposition were studied. The algicidal concentration of prodigiosin for completely killing harmful algae in 24 hours including Nitzschia closterium, Skeletonema costatum, Anabena flosaquae and Merismopedia spp. were 5.0 μg/mL. When 5.0 μg/mL prodigiosin was exposed under the light of 30000lx for 36 h, all prodigiosin was photodecomposed. The light sensistivity of prodigiosin will not bring secondary pollution to the natural environment.
Key words:prodigiosin;algicidal effect;red tide;water blooms;photodecomposition
由于海洋、湖泊、水库等水体的富营养化,各种藻类大量繁殖导致赤潮和水华的暴发.黏土[1]、硫酸铜[2]、有机农药[3-4]、溶藻病毒[5]、溶藻细菌[6]、滤食性鱼类[7]、水生植物[8]以及植物化感作用[9]等各种物理、化学、生物方法被应用于赤潮和水华的治理.但物理、化学方法均不可避免地将造成环境二次污染.生物方法总体上尚处于初期研究阶段,仍有不少问题需要解决.因此,开发一种见效快、用量少、对环境友好、储存和运输方便的除藻剂成为解决赤潮和水华问题的迫切需要.
灵菌红素(prodigiosin)是一类天然红色素家族的总称, 是由多种放线菌(Streptomyces)和细菌(Serratia, Pseudomonas)产生的一类次级代谢产物[10-11].韩国科学家在海边土壤里筛选到一株能生产灵菌红素的海洋细菌,并将其命名为Hahella chejuensis KCTC2396,该细菌生产的抗生素具有强烈的细胞溶解酶活性,对海洋赤潮藻C.polykrikoides具有较好的除藻活性[12].日本科学家在海边筛选到一株能生产灵菌红素类似物PG-L-1的海洋细菌MS-02-063,通过实验发现,该灵菌红素类似物对H.akashiwo、H.circularisquama、C.polykrikoides、Gyrodinium impudicum和Alexandrium tamarense具有一定的除藻活性[13].
本实验通过黏质沙雷氏菌发酵生产灵菌红素,并对其进行分离纯化及鉴定,进而研究灵菌红素对新月菱形藻、中肋骨条藻、水华鱼腥藻和微小平列藻的除藻活性以及光解特性.
1 材料与方法
1.1材料
实验所用黏质沙雷氏菌(Serratia marcescens)为本实验室保藏.新月菱形藻(Nitzschia closterium)和中肋骨条藻(Skeletonema costatum)由中国海洋大学微藻种质库提供.水华鱼腥藻(Anabena flos-aquae)和微小平列藻(Merismopedia spp.)由中国科学院水生生物研究所淡水藻种库提供.
NLF 22 30L生物反应器(瑞士比欧生物工程公司);752型紫外光栅分光光度计(上海精密科学仪器有限公司);高速冷冻离心机(Eppendorf公司);高效液相色谱仪(Agilent Technologies, Inc.); Agilent orbax SB-C18色谱柱; Micromass LCT TOF质谱仪;水冲式真空泵(郑州长城科工贸有限公司); SPX-300B-G光照培养箱(上海博迅实业有限公司医疗设备厂);XB-K-25血球计数板(浙江省玉环县求精医用仪器厂); CoolPIX 4500显微镜(Nikon).
葡萄糖为工业级,酵母粉和蛋白胨购自OXOID公司,其余试剂均为分析纯.
黏质沙雷氏菌种子培养基(g/L):酵母粉1,蛋白胨2,甘油12.6,(NH4)2SO46, K2HPO410, NaCl 0.5, MgSO40.5.以NaOH调pH值至7.2.
发酵培养基(g/L):蛋白胨30,葡萄糖5,K2HPO40.2, ZnSO40.5, MnSO40.04, NaCl 0.5.以NaOH调pH值至7.2.
1.2实验方法
1.2.1发酵培养参数控制 通过流加氨水闭环控制pH在7.0,通过调节通气量及增大转速来维持菌体生长所需的氧气,维持DO大于20%.
1.2.2海洋赤潮微藻的培养 新月菱形藻和中肋骨条藻采用改良的f/2培养液在光照培养箱中培养,培养箱内温度23℃,光强为3000lx,采用12h光暗循环培养模式.每天定时摇晃4~5次.
1.2.3淡水水华微藻的培养 水华鱼腥藻和微小平列藻采用BG11培养液在光照培养箱中培养,其他条件同海洋赤潮微藻.
1.2.4灵菌红素的分离纯化 在黏质沙雷氏菌发酵液中添加硫酸铵使其浓度为200g/L,充分搅匀后置于4℃冰箱内隔夜存放,第2d7000r/min离心15min,收集菌体和蛋白沉淀物,按体积比1:10将离心沉淀物混匀于酸性甲醇溶液中进行灵菌红素萃取,旋转蒸发浓缩去溶剂,浓缩液用乙酸乙酯溶解,低温静置,除去不溶物杂质,得到灵菌红素的乙酸乙酯溶液,以氯仿与乙酸乙酯混合液(体积比2:1)为流动相, 经过第1次硅胶柱层析,灵菌红素洗脱液浓缩去溶剂,再经过第2次硅胶柱层析梯度洗脱,流动相为正己烷与乙酸乙酯混合溶液(体积比 5:1),除去黄色素等杂质;再以正己烷与乙酸乙酯混合溶液(体积比 1:1)为流动相洗脱灵菌红素,洗脱液经过蒸发浓缩得到灵菌红素样品.
将得到的样品进行紫外全波长扫描、高效液相色谱分析和TOF-MS质谱鉴定.
高效液相色谱检测条件:仪器为高效液相色谱仪;流动相为10%的50mmol/L三乙胺+90%乙腈,用磷酸调节pH值至6.0;检测波长为535nm;色谱柱为Agilent orbax SB-C18(250 mm×4.6mm, 5μm);柱温40℃;流速1mL/min;进样量10μL.
1.2.5灵菌红素除藻实验 将分离纯化得到的灵菌红素样品用极少量甲醇溶解,再用纯水稀释至不同的浓度梯度, 添加0.6mL灵菌红素稀释液至达到对数生长期的藻液29.4mL中,摇匀,各藻的初始藻细胞密度均为1.0×105个/mL.因为灵菌红素具有光解的特性,为了最大限度的发挥灵菌红素的除藻作用效果,本实验将添加灵菌红素的藻液首先置于培养箱中黑暗条件下培养12h,然后继续按照光暗循环模式培养,定时取样,显微镜下计数,只计数没有发生裂解的完整的藻细胞,确定灵菌红素的除藻活性.将不添加灵菌红素的藻液作为对照.
1.2.6灵菌红素光解实验 将装有5.0μg/mL灵菌红素溶液的试管分别暴露于3000lx和30000lx灯光下, 观察灵菌红素水溶液的颜色变化,测定水溶液里灵菌红素含量.
1.3分析方法
1.3.1藻细胞的计数和形态观察 将培养容器内的藻液混匀,取一滴至血球计数板的计数室内计数.将血球计数板置于Nikon显微镜下观察,放大倍数为400倍.除藻活性(%)=[(初始培养液中活藻细胞密度-灵菌红素作用后培养液中活藻细胞密度)/初始培养液中活藻细胞密度]×100
1.3.2灵菌红素的测定 采用分光光度法测定灵菌红素浓度.1mL发酵液加入9mL酸性甲醇(pH 3)中, 振荡后离心,测上清的OD535值,由标准曲线得灵菌红素的浓度.标准曲线:Y=3.939X+ 0.0265(R2=0.9996),其中Y为灵菌红素浓度;X为灵菌红素溶液OD535测定值.光解率(%)=[(初始灵菌红素浓度–残留灵菌红素浓度)/初始灵菌红素浓度]×100.
2 结果
2.1灵菌红素的分离及鉴定
将样品经过分离纯化后进行高效液相色谱分析,见图1.与空白进样结果对比可知,6.2min, 535nm处的峰值为样品溶质峰.由此可判断硅胶柱二次层析后的样品纯度较高,>95%.

图1 灵菌红素HPLC分离图谱Fig.1 The HPLC analysis of prodigiosin
最终分离得样品通过紫外全波长扫描仪(图2),质谱仪测定确为灵菌红素.样品在碱性和酸性条件下的最大吸收波长分别为466nm和535nm.样品的质谱分析结果表明m/z=324(图3),其分子量323恰好是灵菌红素分子对应的分子量,进一步证实样品为灵菌红素.紫外全波长扫描和质谱分析结果与文献[14-15]报道一致.
2.2灵菌红素对新月菱形藻的除藻活性

图2 碱性与酸性条件下的紫外全波长扫描图谱Fig.2 The scan map of alkaline and acidic prodigisoin in all-wavelengh
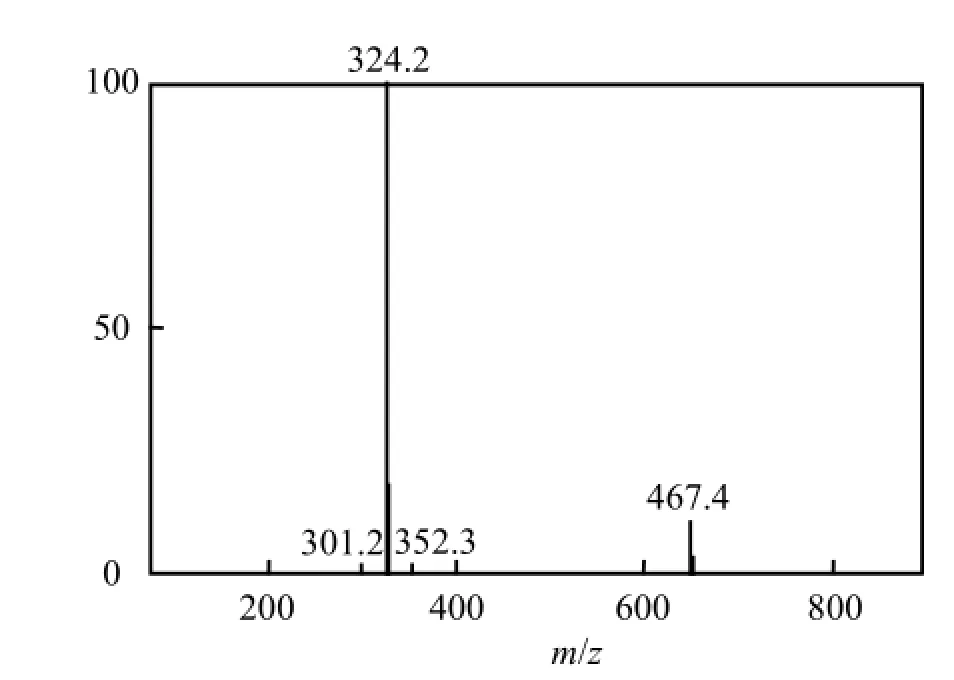
图3 灵菌红素的TOF MS图谱Fig.3 The TOF MS analysis of prodigiosin
由图4可见,添加5.0μg/mL灵菌红素12h后,除藻活性接近80%,添加10.0μg/mL灵菌红素12h后,除藻活性达到100%,藻类几乎全部裂解死亡.将除藻活性达到100%的藻液重新接种到新鲜培养基中培养5d,镜检观察未发现形态完好的新月菱形藻细胞,由此可进一步确证,裂解的藻细胞已经死亡.
未添加灵菌红素的新月菱形藻经过3d的培养, 藻细胞密度由初始的1.0×105个/mL增殖到5.35×105个/mL,藻液中未发现裂解的藻细胞.

图4 灵菌红素对新月菱形藻的除藻活性Fig.4 Algicidal effects of prodigiosin against Nitzschia closterium
2.3灵菌红素对中肋骨条藻的除藻活性

图5 灵菌红素对中肋骨条藻的除藻活性Fig.5 Algicidal effects of prodigiosin against Skeletonema costatum
由图5可见,添加7.0μg/mL灵菌红素0.5h后,除藻活性接近100%,添加1.0μg/mL灵菌红素18h后, 除藻活性达到100%,中肋骨条藻几乎全部裂解死亡.将除藻活性达到100%的藻液重新接种到新鲜培养基中培养5d,镜检观察未发现形态完好的中肋骨条藻细胞.与图4对比,低浓度灵菌红素在短时间内可将中肋骨条藻全部杀死,这表明中肋骨条藻对灵菌红素的敏感性比新月菱形藻强.
未添加灵菌红素的中肋骨条藻经过3d的培养, 藻细胞密度由初始的1.0×105个/mL增殖到2.0×105个/mL,藻液中未发现形态遭到破坏的中肋骨条藻细胞.
受灵菌红素作用前与作用后2h的中肋骨条藻藻细胞的形态学观察表明,正常的中肋骨条藻细胞透镜形或圆柱形,壳面圆而鼓起,轮廓圆滑,而受灵菌红素作用后的藻细胞质浓缩,细胞破裂,轮廓不清晰,形态上发生了很大变化.
2.4灵菌红素对水华鱼腥藻的除藻活性
由图6可见,添加5.0μg/mL灵菌红素6h后,除藻活性超过75%,24h后, 除藻活性可达100%.而添加1.5μg/mL灵菌红素12h后,除藻活性也达到90%.将除藻活性达到100%的水华鱼腥藻培养液重新接种到新鲜培养基中培养5d,未发现细胞增殖.
未添加灵菌红素的水华鱼腥藻经过3d的培养,藻细胞密度由初始的1.0×105个/mL增殖到2.95×105个/mL.
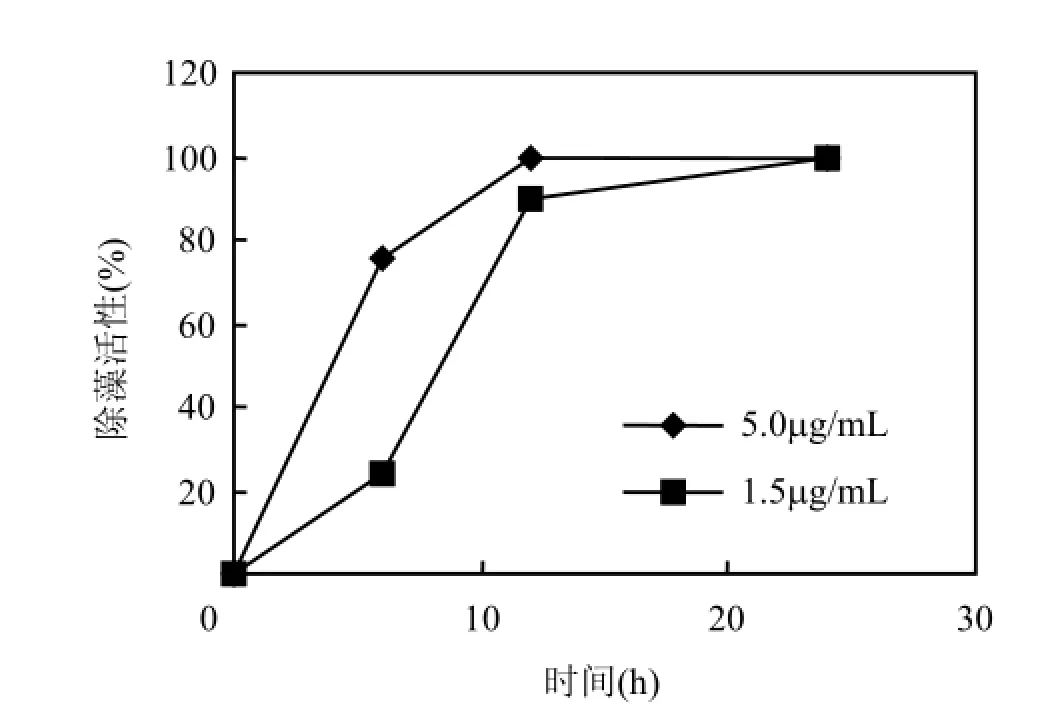
图6 灵菌红素对水华鱼腥藻的除藻活性Fig.6 Algicidal effects of prodigiosin against Anabena flos-aquae
2.5灵菌红素对微小平列藻的除藻活性
由图7可见,添加5.0μg/mL灵菌红素24h后,除藻活性达到100%,添加1.5μg/mL灵菌红素24h后,除藻活性接近80%.将除藻活性达到100%的微小平列藻培养液重新接种到新鲜培养基中培养5d,未发现形态完好的藻细胞.
而未添加灵菌红素的微小平列藻经过3d的培养, 藻细胞密度由初始的1.0×105个/mL增殖到2.74×105个/mL.
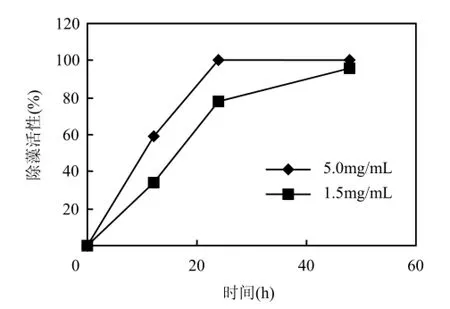
图7 灵菌红素对微小平列藻的除藻活性Fig.7 Algicidal effects of prodigiosin against Merismopedia spp.
受灵菌红素作用前与作用后12h的微小平列藻藻细胞的形态学观察表明,正常的微小平列藻呈圆形或椭圆形,两两排在一起, 轮廓圆滑,呈深绿色;而受灵菌红素作用后的藻细胞破裂,胞质外泄, 轮廓不清晰,藻体颜色变浅, 细胞开始凋亡.
2.6灵菌红素的光解性质
灵菌红素水溶液在光的照射下,红色逐渐变浅,最终褪去.由图8所示,在光强为30000lx的强光照射36h后,5.0μg/mL灵菌红素几乎完全分解,随着照射光强度减小,灵菌红素分解速率变慢,在光强为3000lx的灯光照射48h后,超过60%的灵菌红素被光解.

图8 灵菌红素的光解率变化Fig.8 Photodecomposition of prodigiosin
2.7讨论
本研究发现,由陆生细菌黏质沙雷氏菌所生产的次级代谢物灵菌红素不仅对引起我国东海赤潮的有害藻类新月菱形藻和中肋骨条藻有很好的除藻效果,而且对引起淡水水华的有害藻类水华鱼腥藻和微小平列藻也具有较好的除藻效果.其中灵菌红素对引起淡水水华的藻类的除藻研究在国内尚属首次.由于灵菌红素的光解特性,经过灵菌红素处理的藻液首先置于培养箱中在黑暗条件下培养12h,然后再进行光暗循环模式培养.5.0μg/mL灵菌红素能够在24h内将新月菱形藻、中肋骨条藻、水华鱼腥藻和微小平列藻培养液中的藻类全部杀死,除藻活性高达100%.随着灵菌红素浓度的降低,其除藻活性也在降低.另外,从图4、图5、图6和图7中可以看到,灵菌红素对各种藻类作用12h后,其除藻活性与时间的比值减小,在24h之后继续减小,说明灵菌红素除藻活性随时间延长有所降低,这是由于经过灵菌红素处理的藻液在12h黑暗模式培养之后,进入光照模式培养,藻液中的灵菌红素在12h之后逐步光解,浓度下降所致.而未添加灵菌红素的藻液经过3d培养,藻细胞均大量增殖.
Landsberg[16]和Yamasaki等[17]分别发现了多环旋沟藻和米氏凯伦藻能够分泌活性氧(ROS),可以推测,大多数海洋藻类可能都能够分泌活性氧.活性氧对于某些海洋藻类来说,可能是重要的生长因子或有丝分裂刺激物[18].Kim等[19]认为活性氧合成酶类似于NADPH氧化酶. NADPH氧化酶能够被灵菌红素类似物抑制[20].因此, 灵菌红素也可能对NADPH氧化酶和ROS合成酶起到抑制作用, 进而抑制藻细胞分泌活性氧,最终导致藻类细胞的裂解死亡.灵菌红素除藻机理有待深入研究.
3 结论
3.1由黏质沙雷氏菌发酵生产的天然红色素经分离、纯化,鉴定为灵菌红素.
3.2灵菌红素具有高效的除藻活性.5.0μg/mL灵菌红素能够在24h内将新月菱形藻、中肋骨条藻、水华鱼腥藻和微小平列藻培养液中的藻类全部杀死,除藻活性高达100%.随着灵菌红素浓度的降低,其除藻活性也在降低.
3.3灵菌红素具有光解特性.在光强为30000lx灯光照射下,5.0μg/mL灵菌红素能够在36h内完全分解.而在光强为3000lx的灯光照射下,灵菌红素在14h内可分解大约50%.
[1] Choi H G, Kim P J, Lee W C, et al. Removal efficiency of Cochlodinium polykrikoides by yellow loess [J]. Korean Fish. Soc., 1998,31:109-113.
[2] 李建宏,郜子厚.铜离子对蓝藻Spimhnamaxinla光合作用的抑制机理 [J]. 植物生理学报, 1997,23(1):77-82.
[3] 秦文第,强继业,夏更寿.氨基甲酸酯类农药对水华鱼腥藻的毒性效应 [J]. 安徽农业科学, 2005,33(3):391-392.
[4] 王翠红,徐建红,辛晓芸,等.六种有机磷农药及三种重金属离子对小球藻的毒性研究 [J]. 河南科学, 1999,17(A06):l08-110.
[5] Garry R T, Hearing P, Cosper E M. Characterization of a lytic virus infectious to the bloom-forming microalga Aureococus anophagefferens (Pelagophyceae) [J]. Phycol., 1998,24:616-621.
[6] Iwata Y, Sugahara I, Kimura T, et al. Properties of an algicidal bacterium (Flavobacterium sp.) against Karenia mikimotoi isolated from Ise Bay, Japan [J]. Nippon Suisan Gakkaishi, 2004,70:537-541.
[7] 王 嵩,王启山,张丽彬,等.大型水库围隔放养鲢鱼、鳙鱼控藻的研究 [J]. 中国环境科学, 2009,29(11):1190-1195.
[8] 邵林广.水浮莲净化富营养化湖泊试验研究 [J]. 环境与开发, 2001,16(2):28-29.
[9] 陈卫民,张清敏,戴树桂.苦草与铜绿微囊藻的相互化感作用 [J].中国环境科学, 2009,29(2):147-151.
[10] 盛 磊,王 勇.灵菌红素的制备与抗菌效果观察 [J]. 农垦医学, 1998,20(4):203-204.
[11] Melvin M S, Tomlinson J T, Saluta G R, et al. Double-Strand DNA cleavage by copper-prodigiosin [J]. Am. Chem. Soc., 2000, 122(26):6333-6334.
[12] Jeong H, Yim J H. Genomic blueprint of Hahella chejuensis, a marine microbe producing an algicidal agent [J]. Nucleic Acids Research, 2005,33(22):7066-7073.
[13] Nakashima T, Miyazaki Y, Matsuyama Y. Producing mechanism of an algicidal compound against red tide phytoplankton in a marine bacterium γ-proteobacterium [J]. Applied Microbiology and Biotechnology, 2006,73(3):684-690.
[14] Hubbard R, Rimington C. The biosynthesis of prodigiosin, the tripyrrylmethene pigment from Bacillus prodigiosus (Serratia marcescens) [J]. Biochem., 1950,46(2):220-225.
[15] Wasserman H H, McKeon J E, Smith L A, et al. Studies on prodigiosin and the bipyrrole precursor, [J]. Tetrahedron, 1966, 22(suppl.8):647-662.
[16] Landsberg J H. The effects of harmful algal blooms on aquatic organisms [J]. Rev. Fish Sci., 2002,10(2):113-390.
[17] Yamasaki Y, Kim D I, Matsuyama Y. Production of superoxide anion and hydrogen peroxide by the red tide dinophytoplankton Karenia mikimoto [J]. Biosci. Bioeng., 2004, 97:212-215.
[18] Oda T, Moritomi J, Kawano I. Catalase- and superoxide dismutase-induced morphological changes and growth inhibition in the red tide phytoplankton Chattonella marina [J]. Bioscience, biotechnology, and biochemistry, 1995,59:2044-2048.
[19] Kim D, Nakamura A, Okamoto T. Mechanism of superoxide anion generation in the toxic red tide phytoplankton Chattonella marina: possible involvement of NAD(P)H oxidase [J]. Biochimica et Biophysica Act, 2000,1524:220-227.
[20] Nakashima T, Iwashita T, Fujita T. A prodigiosin analogue inactivates NADPH oxidase in macrophage cells by inhibiting assembly of p47phox and Rac [J]. The Journal of Biochemistry, 2008,143(1):107-115.
致谢:本论文的除藻活性研究工作由东海环境监测中心徐韧主任、王金辉科长以及其他科室成员等协助完成, 在此表示感谢.
Algicidal activity of prodigiosin against harmful algae
. LIU Bo-ya1, WEI Dong-zhi1, LU Si-ran3, ZHOU Wen-yu1, SHEN Ya-ling1*, XU Ren2, WANG Jin-hui2(1.State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China;2.East China Sea Environmental Monitoring Center, State Oceanic Administration, Shanghai 200137, China;3.College of Life Science, Wuhan University, Wuhan 430072, China). China Environmental Science, 2010,30(4):477~482
X52
A
1000-6923(2010)04-0477-06
刘伯雅(1983-),男,河北任丘人,华东理工大学硕士研究生, 主要从事微生物学研究.
2009-08-19
国家“863”项目(2007AA092004);上海市重点学科建设项目(B505)
* 责任作者, 教授, ylshen@ecust.edu.cn
