Fe0-厌氧微生物体系处理活性艳蓝X-BR的试验研究
2010-09-09肖利平邓志毅汤文琪湘潭大学环境工程系湖南湘潭411105
郭 燕,肖利平,邓志毅,汤文琪 (湘潭大学环境工程系,湖南 湘潭 411105)
Fe0-厌氧微生物体系处理活性艳蓝X-BR的试验研究
郭 燕,肖利平*,邓志毅,汤文琪 (湘潭大学环境工程系,湖南 湘潭 411105)
采用零价铁(Fe0)-厌氧微生物处理体系,以蒽醌染料活性艳蓝X-BR为处理对象,通过摇床试验研究了Fe0投加量、pH值等因素对染料脱色的影响,并对比了该染料在3种不同处理体系中的脱色效果.结果表明,在Fe0-厌氧微生物体系中,Fe0投加量和pH值均存在最适宜值,当两者分别控制在400mg/L和7,染料初始浓度和反应时间分别为100mg/L和68h时,该体系脱色率可达到90%以上;与相同反应条件下的纯Fe0、纯厌氧微生物体系相比,该体系的脱色率提高近40%.根据紫外-可见光谱分析,Fe0可有效促进厌氧微生物对X-BR及其中间产物的降解,实现完全脱色.其脱色符合准一级动力学,当染料初始浓度由50mg/L增至800mg/L时,反应速率常数k值由0.0470h-1降至0.0102h-1.
厌氧微生物;零价铁;活性艳蓝X-BR;染料
Abstract:An anthraquinone dye, reactive brilliant blue X-BR, was treated by an integrated Fe0-anaerobic biological system. Through shake flasks tests, the effects of some factors, such as Fe0dose, pH, etc., on the decolorization of X-BR were studied. The decolorization effects of the dye in three different treatment systems were compared as well. The Fe0concentration and pH had optimal values during the decolorization of X-BR in Fe0-anaerobic biological system. When Fe0dose, initial pH value and X-BR concentration were 400mg/L, 7 and 100 mg/L respectively, the decolorization rate of X-BR in the integrated system could reach up to 90% after 68 h reaction. Compared with pure Fe0and pure microorganism treatment systems, it could be improved about 40% under the same experimental conditions. In addition, the analysis result of UV-vis spectrogram indicated that Fe0could promote effectively biodegrading of anthraquinone dye X-BR and its intermediate products. The decolorization kinetics of X-BR was in accordance with pseudo first-order reaction dynamics and the reaction rate constant reduced from 0.0470h-1to 0.0102h-1with the dye concentration increased from 50mg/L to 800mg/L.
Key words:anaerobic microorganism;zero-valent iron;reactive brilliant blue X-BR;dye
蒽醌类活性染料具有稳定的多环芳香结构,不易被氧化,可生化性差,脱色慢,常规方法难以有效处理,是目前染料废水治理的难点之一[1-2].生化法虽然在处理染料废水中有明显优势[3-5],但单纯的好氧生物处理工艺往往难以直接氧化分解染料分子;而厌氧工艺存在着脱色时间较长、微生物的适应能力差等缺陷,处理效率较低[6].由于Fe0还原法可有效破坏染料的发色和助色基团,同时提高废水可生化性,近年来一直受到国内外学者广泛关注[7-8].但该法受染料结构的影响较大,且存在着要求水样pH值较低、运行过程易板结等缺陷.厌氧微生物在降解废水的过程中能创造一个微酸性的环境,有利于不断更新Fe0表面,使其保持较强的还原能力;Fe0腐蚀过程产生的活泼H2还可作为电子供体被厌氧微生物用来降解有机污染物,从而有效提高系统的处理效率[9],目前以Fe0和厌氧微生物组成的联合体系在一些难降解有毒有机废水的处理中得到了较好的效果[10-12].前期研究表明[13],在葡萄糖共基质条件下,Fe0-厌氧微生物联合体系能有效提高偶氮染料活性艳红X-3B的脱色效果,显著缩短反应时间.鉴于此,本研究采用Fe0-厌氧微生物体系处理蒽醌染料活性艳蓝X-BR废水,考察了Fe0投加量、pH值等因素对该系统脱色效果的影响,探讨了Fe0和厌氧微生物联合作用处理蒽醌染料废水的过程及相关脱色动力学.
1 材料与方法
1.1材料
污泥取自湖南某造纸厂IC厌氧反应器,污泥总悬浮固体(TSS)为5.28g/L,挥发性悬浮固体(VSS)为4.18g/L,VSS/TSS=0.79;蒽醌染料活性艳蓝(X-BR,最大吸收波长为598nm)购自江苏某染料有限公司.还原性铁粉Fe0为分析纯,比表面积0.97m2/g;其他试剂均为分析纯.
1.2实验方法
1.2.1污泥的培养与驯化 在葡萄糖共基质条件下对污泥进行培养驯化,维持葡萄糖营养液(COD:N:P=200:5:1)浓度500mg/L,逐渐增加X-BR染料浓度至100mg/L后维持稳定.驯化后污泥VSS/TSS=0.80.
1.2.2染料的脱色实验 采用间歇摇床实验,分别考察了Fe0投加量(0~3200mg/L)、污泥接种量(0~2800mg/L)(按VSS计算,下同)、pH值(4~9)、葡萄糖浓度(0~1000mg/L)及X-BR初始浓度(50~800mg/L)对X-BR脱色的影响,并比较了优化条件下Fe0-厌氧微生物体系与纯Fe0体系、纯厌氧微生物体系对染料的脱色过程及效果.在每个影响因素实验中,分别取数个有效容积为250mL的医用血清瓶,在各反应瓶内依次加入微量元素营养液0.5mL,其组成为(g/L):H3BO30.3, ZnSO4·7H2O 0.1, CuSO4·5H2O 0.01, NiCl2·6H2O 0.02,MnCl2·4H2O 0.03, (NH4)6Mo7O24·4H2O 0.03, CoCl2·6H2O 0.2;NaHCO3缓冲溶液500mg/L;N、P营养液10mL,其组成为(g/L):尿素 5.4, KH2PO42.19,CaCl2·2H2O 0.05,MgSO4·7H2O 0.1;并根据试验设计,加入不同浓度的葡萄糖、驯化污泥、Fe0和X-BR染料,维持废水的总体积为250mL,调节初始pH值后充氮密封,置于(35±1)℃恒温摇床上, 120r/min进行实验,在不同反应时间从各反应瓶内取样分析,每次取样量为5mL,取样时保持充分摇匀,以维持取样前后体系中各物质浓度基本不变.
1.3分析方法
染料脱色率按照下述方法进行分析、计算:取样品6000r/min离心,再经孔径为0.45μm的微孔滤膜过滤后,在UV2100型紫外–可见光谱仪上测定样品在波长200~700nm范围内的变化情况;相同样品经稀释后,采用722-S型可见分光光度计在X-BR最大吸收波长下测量样品吸光度,用式(1)计算染料脱色率E:
式中: A0、A1分别为脱色前、脱色后样品稀释m倍和n倍后的吸光度.
污泥TSS与VSS采用重量法测定[14].
2 结果与讨论
2.1Fe0投加量对X-BR脱色率的影响
由于Fe0表面是决定化学反应活性部位的重要因素,而且还会影响Fe0腐蚀产H2的速率和体系的pH值[11],因此,Fe0投加量是影响体系中染料脱色的关键因素.维持葡萄糖浓度500mg/L,污泥接种量1400mg/L,X-BR染料100mg/L,初始pH值为7.0,考察了Fe0投加量对X-BR脱色的影响,结果见图1.
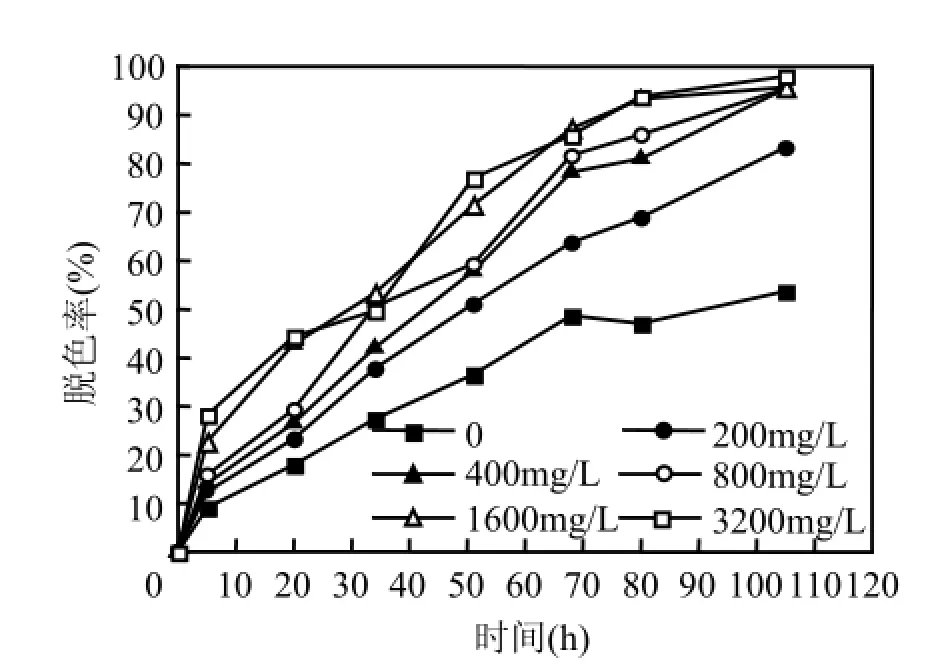
图1 Fe0投加量对活性艳蓝X-BR脱色的影响Fig.1 Effect of Fe0dose on the decolorization of X-BR
由图1可见,在厌氧生物处理系统中加入Fe0明显提高了整个体系的脱色效果.当Fe0投加量从0增加到400mg/L时,反应100h后,X-BR脱色率从50%增加到90%左右,增幅约为40%,这可能是由于Fe0在厌氧条件下会发生如下反应: Fe0+ 2H2O→Fe2++2OH–+H2,持续缓慢释放H2,不断供给厌氧微生物降解X-BR所需的电子,从而增强了厌氧微生物对X-BR的适应性和处理能力.然而Fe0投加量并非越多越好,当其由400mg/L增至3200mg/L时,体系脱色率的增幅仅为5%左右,与Fernandez等[11]的研究结果一致,表明Fe0−厌氧微生物联合体系降解X-BR的过程中,Fe0投加量存在最适宜值.这主要是由于Fe0投加量较低时,腐蚀产生的H2有限,难以为厌氧微生物提供足够的电子供体;而投加量高时,会产生更多的H2和OH–,引起体系pH值上升(表1),使得反应过程中产生的部分Fe2+可能生成Fe(OH)2沉淀,影响了Fe0的持续溶出[7],或沉积在微生物表面,降低生物活性[15],对提高染料生物脱色的贡献不大.因此,Fe0最适宜投加量应控制在400mg/L.
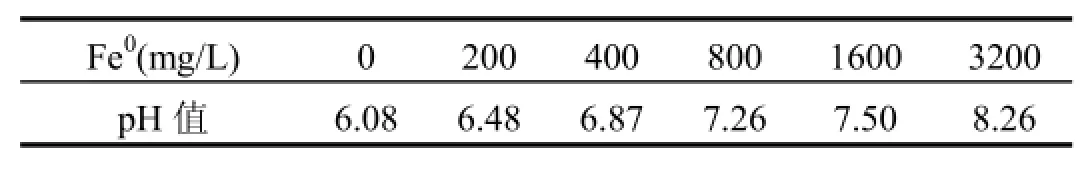
表1 反应105h时各体系pH值Table 1 pH of different systems at the HRT=105h
2.2污泥接种量对X-BR脱色率的影响
控制葡萄糖浓度500mg/L,Fe0投加量400mg/L,X-BR染料100mg/L,初始pH7.0,考察了污泥接种量对X-BR脱色的影响,结果见图2.
由图2可见,当污泥接种量由175mg/L增加到2800mg/L,X-BR脱色率达到90%所需时间从90h缩短到24h;而未投加污泥的体系反应90h时脱色率仅70%.表明污泥接种量会显著影响体系的脱色率;接种量不足,导致厌氧微生物的数量较少,体系对X-BR的脱色速率慢,处理时间长;而增加接种量,可有效增加厌氧菌的数量,从而促进了体系中X-BR的脱色效果.但污泥接种量从1400mg/L增加到2800mg/L时,X-BR脱色率仅增加约5%.可见生物量增大到一定程度,Fe0表面由于污泥淤积,腐蚀产H2能力下降,导致生物降解所需电子供体不足,从而对整个系统的脱色效果贡献不大.因此,污泥接种量宜控制在1400mg/L左右.

图2 污泥接种量对活性艳蓝X-BR脱色的影响Fig.2 Effect of biomass on the decolorization of X-BR
2.3pH值对X-BR脱色率的影响
微生物生长存在一个适宜的pH范围,而且Fe0表面腐蚀与pH值密切相关,不同的pH值使得溶液中铁呈不同形态.在葡萄糖浓度500mg/L,Fe0投加量400mg/L,污泥接种量1400mg/L,X-BR染料100mg/L的条件下,考察了pH值对X-BR脱色的影响,结果见图3.

图3 pH值对活性艳蓝X-BR脱色的影响Fig.3 Effect of pH on the decolorization of X-BR
由图3可见,当pH4.0~9.0时,都能实现X-BR的脱色.其中初始pH值为7.0和9.0的体系中X-BR脱色速率较快,反应40h后,染料脱色率均达到90%左右,比初始pH4.0和pH6.0体系高约20%.表明该体系中X-BR的脱色以厌氧微生物为主,而且在中性或偏碱性条件下更有利于这些微生物的生长.反应初期pH9.0体系虽使Fe0的溶出受一定抑制,但X-BR易附着[16],同时体系中厌氧微生物保持较高的活性,从而获得了较高的吸附脱色率.而当初始pH4.0,反应4h时体系可以达到约60%的脱色率,这主要是由于在酸性条件下,X-BR易水解[16],且Fe0的溶出加快,通过Fe0的化学作用及吸附等手段提高了体系对X-BR脱色率.
2.4葡萄糖浓度对X-BR脱色率的影响
有研究表明[6],外加易降解的共基质底物(如葡萄糖)可有效促进染料的降解.因此,在Fe0投加量400mg/L,污泥接种量1400mg/L,X-BR染料100mg/L,初始pH值7.0的条件下,考察了葡萄糖浓度对X-BR脱色的影响,结果见图4.
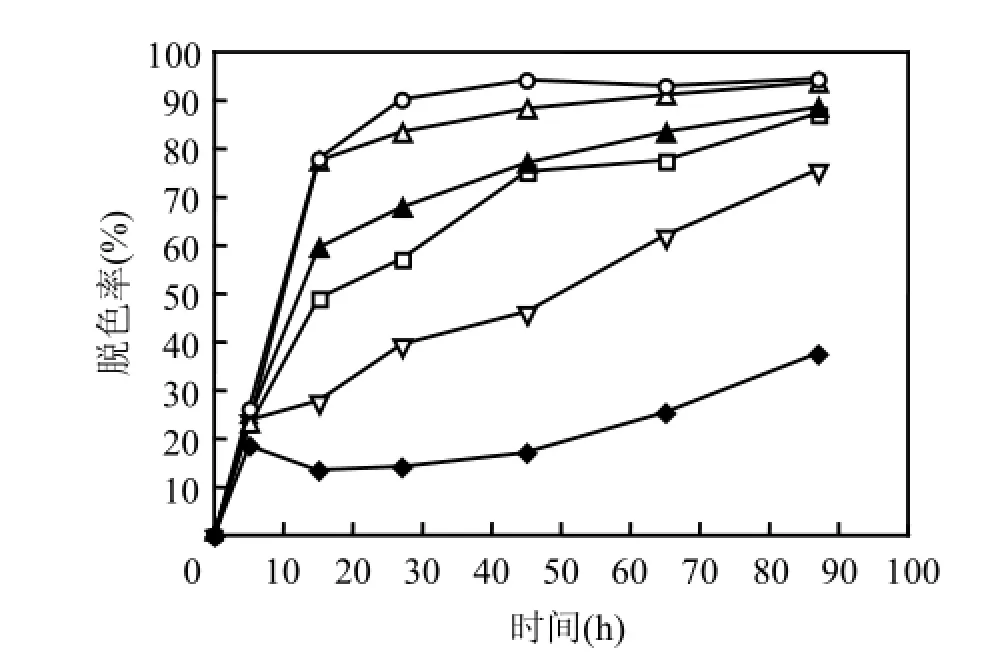
图4 葡萄糖浓度对活性艳蓝X-BR脱色的影响Fig.4 Effect of initial glucose concentration on thedecolorization of X-BR

由图4可见,在不添加葡萄糖、Fe0的纯厌氧微生物体系中,反应90h后,也可达到约40%的脱色率,说明体系中的厌氧微生物能以该染料作为碳源和能源来获取生长所需要的营养.反应3h内,各体系脱色率相差不大,因为短时间内X-BR脱色以Fe0和微生物的物理吸附为主,厌氧微生物对染料有一段适应期,葡萄糖不是微生物的生长限制因子.当葡萄糖浓度从0增加到500mg/L时,经28h的处理,X-BR脱色率从40%增加到约90%,增幅达到50%左右,表明添加葡萄糖作为共基质底物,可有效提高厌氧混合菌种对染料废水的适应性和脱色效果,这与其他研究者结论一致[16-17];另一方面葡萄糖代谢还可产生挥发酸,有利于维持体系pH值平衡,发挥Fe0和厌氧微生物的协同作用.但当葡萄糖浓度由500mg/L增加至1000mg/L时,X-BR脱色率的增幅仅为5%,这可能是由于葡萄糖量的增加,碳源比例改变,影响菌群中染料脱色降解菌的优势地位[18].因此,葡萄糖浓度宜控制在500mg/L左右.
2.5X-BR初始浓度对其脱色的影响及其脱色动力学
当葡萄糖浓度为500mg/L,Fe0投加量为400mg/L,污泥接种量1400mg/L,初始pH值7.0时,不同X-BR初始浓度对其脱色率的影响如图5所示.
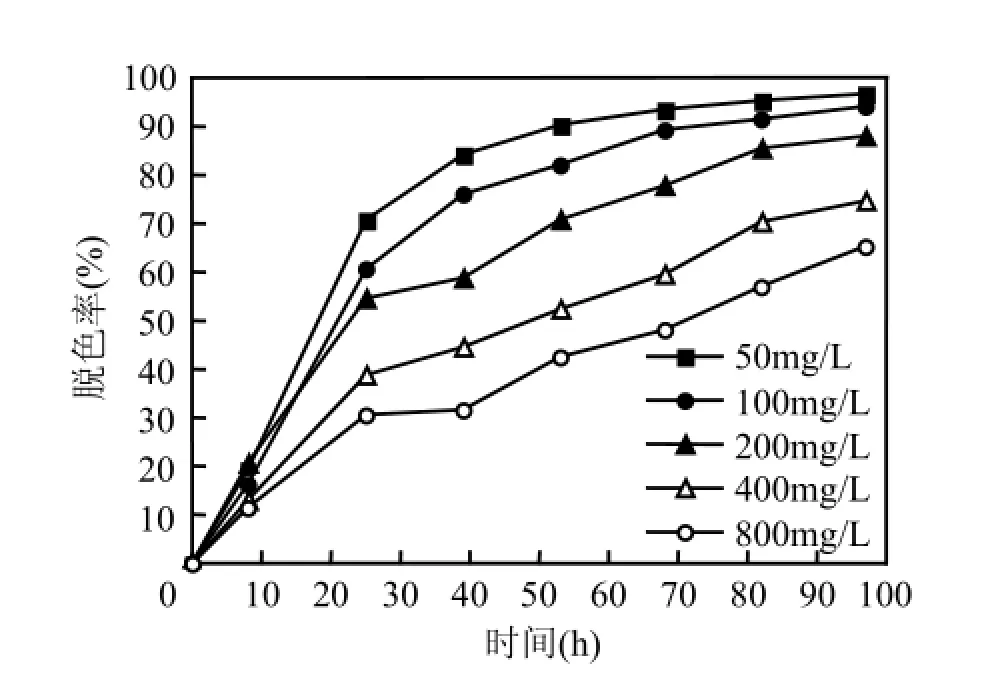
图5 X-BR浓度对活性艳蓝X-BR脱色的影响Fig.5 Effect of initial dye concentration on thedecolorization of X-BR
由图5可见,初始浓度在50~800mg/L范围内,X-BR脱色率随初始浓度增加而减小.X-BR初始浓度对系统的脱色率影响很大.这主要是由于染料浓度越高,对体系中厌氧微生物的抑制作用越强,导致了脱色率的大幅下降.
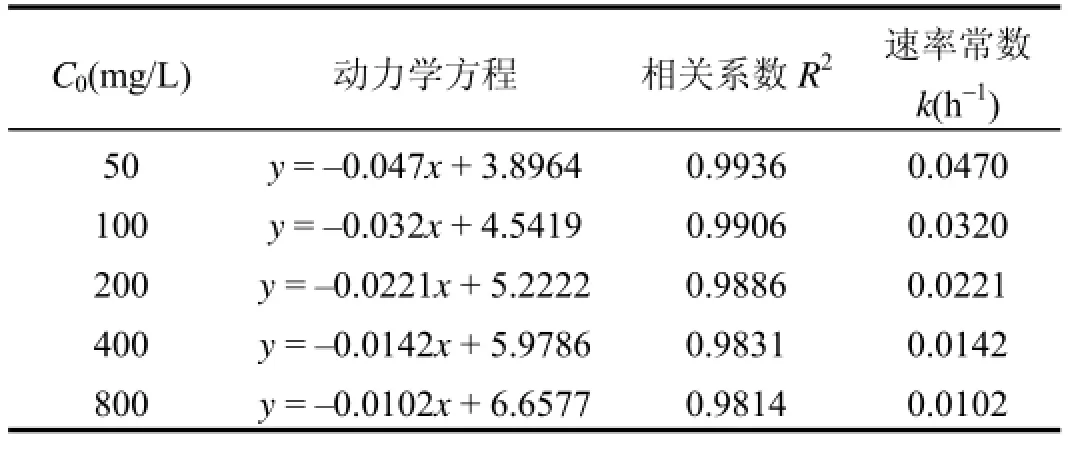
表2 不同初始浓度X-BR的动力学特征Table 2 X-BR decolorizing kinetics of different initial concentration
根据图5中不同初始浓度X-BR的处理结果,以色度对应的反应物浓度的对数lnC与反应时间t作图,并进行线性回归(表2),由表2可见,X-BR脱色符合准一级动力学,拟合相关系数均在0.98以上, k值随初始浓度的增加而下降.
2.6不同体系对X-BR脱色效果的比较
进水葡萄糖和染料浓度分别为500,100mg/L,初始pH7.0时,比较了Fe0−厌氧微生物、纯Fe0和纯厌氧微生物3种体系对X-BR的脱色效果,其中纯Fe0体系中仅投加400mg/L的Fe0粉,纯厌氧微生物体系中仅投加1400mg/L的厌氧污泥,而Fe0−厌氧微生物体系中则投加浓度分别为400,1400mg/L的Fe0和厌氧污泥混合物.
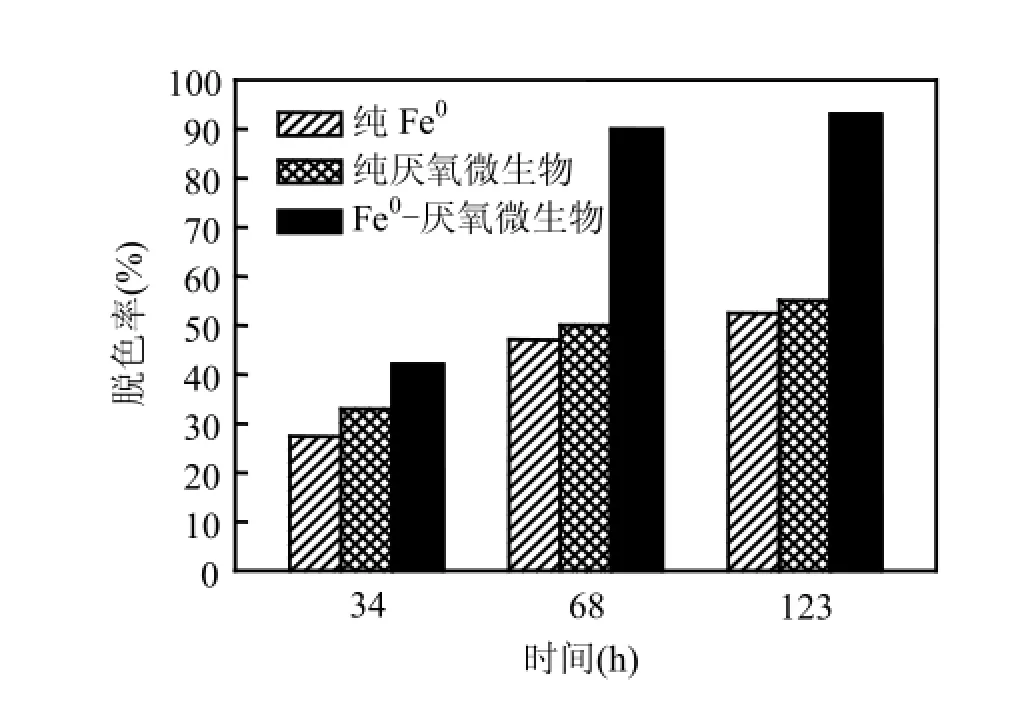
图6 3种体系中X-BR的脱色效果Fig.6 Decolorization of X-BR in three different treatment systems
由图6可见,反应68h后,Fe0−厌氧微生物体系中X-BR脱色率约为90%,比纯Fe0、纯厌氧微生物体系提高40%左右,表明Fe0可有效促进厌氧微生物降解活性艳蓝X-BR.
由图7可见,0h时为原水的吸收光谱,X-BR在200~700nm有3个特征吸收峰,分别为250, 292,598nm,其中250,292nm分别是苯甲酮和醌在紫外区的吸收带,598nm处则是蒽醌结构与其环上取代基形成2-磺酸-1,4-二氨基蒽醌大共轭发色体系在可见光区的吸收带.经3种体系处理后,在598nm处的特征峰均呈下降趋势.其中纯Fe0体系240~700nm间未出现吸光度上升,说明该体系中X-BR的脱色以Fe0及其形成的氢氧化物的吸附絮凝作用为主,这与Epolito等[8]利用Fe0处理蒽醌染料RB4的研究结果不同,RB4降解过程中会在485nm处产生一个吸收峰,并呈现先上升后下降趋势,表明形成了某种中间产物继而再被还原降解.纯厌氧微生物体系在250,450nm处均出现先上升后下降,说明该体系降解X-BR的过程中产生了苯环结构的中间产物,而且随反应时间的延长,该产物能被厌氧微生物缓慢降解.当反应时间达到123h时,仅Fe0−厌氧微生物体系中样品在可见区的特征峰消失,而紫外区吸收峰减弱到0.5以下,说明X-BR染料的蒽醌结构及其在脱色过程形成的部分中间产物都能被该体系有效降解.
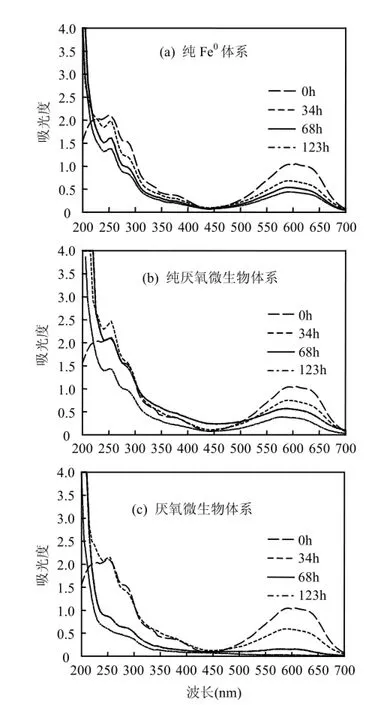
图7 3种体系中X-BR降解过程的紫外−可见光谱分析Fig.7 UV-vis spectrogram of X-BR degradation in three different treatment systems
结合UV-vis分析结果,可推测联合体系降解X-BR表现为:厌氧微生物首先利用葡萄糖作为碳源和能源生长,逐步适应染料废水的环境,同时产生小分子有机酸,营造微酸性的环境,促进Fe0的不断溶出,并参与降解Fe0还原过程中形成的中间产物,Dinh等[9]的研究得出了类似的结论;而Fe0则通过吸附和化学还原作用使部分X-BR脱色,并产生H2,为厌氧微生物提供电子供体,提高其活性.这与Zhang等[19]研究Fe0/ Fe2+/Fe3+降解硝基苯的过程所获得的结论相同.因此,在联合体系中,X-BR及其中间产物的降解主要是通过吸附、絮凝、化学和生物还原等作用来实现.
3 结论
3.1Fe0−厌氧微生物体系降解X-BR的过程中,Fe0投加量和pH值均存在最适宜值,为约400mg/L和7~9.
3.2当Fe0投加量为400mg/L,污泥接种量1400mg/L,葡萄糖浓度500mg/L,初始pH值7.0,X-BR初始浓度为100mg/L时,反应68h后,Fe0-厌氧微生物体系对X-BR的脱色率能达到90%左右,比相同条件下纯Fe0、纯厌氧微生物体系提高了约40%.
3.3Fe0可通过吸附、化学作用和提供电子等手段,有效促进厌氧微生物对X-BR及其中间产物的降解,实现该染料的完全脱色.
3.4在Fe0−厌氧微生物体系中,X-BR脱色反应符合准一级动力学.当初始浓度由50mg/L增加至800mg/L时,反应速率常数k由0.0470h−1降至0.0102h−1.
[1] 洪 颖,陈国松,张红漫,等.蒽醌类染料废水处理的研究进展[J]. 工业水处理, 2004,24(10):1-4.
[2] Itoh K, Kitade Y, Yatome C. A Pathway for biodegradation of an anthraquinone dye, C.I. disperse red 15, by a yeast st-rain Pichia anomala [J]. Bulletin of Environmental Contamination and Toxicology, 1996,56:413-418.
[3] Padamavathy S, Sandhya S, Swaminathan K, et al. Compari-son of decolorization of reactive azo dyes by microorganismsisolated from various sources [J]. Journal of Environmental Sciences, 2003,15(5):628-632.
[4] 张禄艳,王 竞,吕 红,等.高盐条件下染料酸性橙7的生物降解特性 [J]. 中国环境科学, 2009,29(6):640-645.
[5] Pandey A, Singh P, Iyengar L. Bacterial decolorization and degradation of azo dyes [J]. International Biodeterioration and Biodegradation, 2007,59:73-84.
[6] Kim Soo-Young, An Jin-Young, Kim Byung-Woo. The effectof reductant and carbon source on the microbial decolorizati-on of azo dyes in an anaerobic sludge process [J]. Dyes and Pigments, 2008,76:256-263.
[7] Nam S, Tratnyek P G. Reduction of azo dyes with zero-val-ent iron [J]. Water Reseach, 2000,34(6):1837-1845.
[8] Epolito W J, Yang H, Bottomley L A, et al. Kinetics of zero-valent iron reductive transformation of the anthraquinone dye Reactive Blue4 [J]. Journal of Hazardous Materials, 2008,160: 594-600.
[9] Dinh H T, Kuever J, MuBmann M, et al. Iron corrosion bynovel anaerobic microorganisms [J]. Letters to nature, 2004,427: 829-832.
[10] Wildman M J, Alvarez P J J. RDX degradation using an integrated Fe(0)–microbial treatment approach [J]. Water Science and Technology, 2001,43(2):25-33.
[11] Fernandez-Sanchez J M, Sawvel E J, Alvarez P J J. Effect of Fe0quantity on the efficiency of integrated microbial−Fe0treatment processes [J]. Chemosphere, 2004,54:823-829.
[12] Ma Changwen, Wu Yangqing. Dechlorination of perchloroethylene using zero-valent metal and microbial community [J]. Environment Geological, 2008,55:47-54.
[13] 汤文琪,肖利平,戴友芝,等.Fe0-厌氧微生物体系处理活性艳红X-3B的试验研究 [J]. 环境工程学报,2009,3(8):77-80.
[14] 国家环境保护总局水和废水监测分析方法编委会.水和废水监测分析方法. [M]. 4版.北京:中国环境科学出版社, 2002:233-237.
[15] Gu Baohua, Waston D B, Wu Liyou, et al. Microbiolog-ical characteristics in a zero-valent iron reactive barrier [J]. Environmental Monitoring and Assessment, 2002,77:293-309.
[16] 周学良.精细化学品大全 染料卷 [M]. 杭州:浙江科学技术出版社, 2000,12:492.
[17] 肖继波,胡勇有,田 静,等.活性艳蓝KN-R的生物吸附脱色研究 [J]. 中国环境科学, 2004,24(1):63-67.
[18] 方连峰,王 竞,周集体,等.醌化合物强化偶氮染料的生物脱色[J]. 中国环境科学, 2007,27(2):174-178.
[19] Zhang Wen, Chen Ling, Chen Hao, et al. The effect of Fe0/Fe2+/Fe3+on nitrobenzene degradation in the anaerobic sludge [J]. Journal of Hazardous Materials, 2007,143:57-64.
Laboratory study on the decolorization of reactive brilliant blue X-BR treated by an integrated Fe0–anaerobic
biological system.
GUO Yan, XIAO Li-ping*, DENG Zhi-yi, TANG Wen-qi (Department of Environmental Engineering, Xiangtan University, Xiangtan 411105, China). China Environmental Science, 2010,30(4):510~515
X703
A
1000-6923(2010)04−0510-06
郭 燕(1985-),女,湖南湘潭人,湘潭大学环境工程系硕士研究生,主要从事水处理新技术方面的研究.发表论文1篇.
2009-08-20
湖南省科技厅资助项目(06SK4036);湘潭大学博士启动基金(08QDZ31)
* 责任作者, 副教授, x2008huanan@163.com
