东方田鼠三个脂肪肝相关基因的克隆及分析
2010-09-09杨玉琴冯洁王学斌谢建云高诚胡建华
杨玉琴,冯洁,王学斌,谢建云,高诚,胡建华
(1.复旦大学,上海 200032;2.上海实验动物研究中心,上海市实验动物监督检验站,上海 201203; 3.上海市计划生育科学研究所,上海 200032;4.扬州大学动物科学与技术学院,扬州 225009)
研究报告
东方田鼠三个脂肪肝相关基因的克隆及分析
杨玉琴1,冯洁2,3,王学斌4,谢建云2,3,高诚2,胡建华2
(1.复旦大学,上海 200032;2.上海实验动物研究中心,上海市实验动物监督检验站,上海 201203; 3.上海市计划生育科学研究所,上海 200032;4.扬州大学动物科学与技术学院,扬州 225009)
目的 克隆CYP2E1、CYP2D 5、ECHS1三个与非酒精性脂肪肝可能相关基因的cDNA全长基因,为进一步研究非酒精性脂肪肝的发病机制提供依据。方法利用S MART技术构建东方田鼠肝脏cDNA质粒文库,通过PCR方法筛选文库,获得目的菌落,用pB luescrip t II SK通用引物M 13R测序,获得基因全长序列,并进行序列分析比较。结果筛选了CYP2E1、CYP2D5、ECHS1三个基因,并获得了它们的全长cDNA序列:CYP2E1基因cDNA全长为1685bp,有1482 bp的完整开放阅读框,编码494个氨基酸;CYP2D 5基因cDNA全长为1690 bp,有1514 bp的完整开放阅读框,编码504个氨基酸;ECHS1基因cDNA全长为1013 bp,有873 bp的完整开放阅读框,编码290个氨基酸。这三个基因的核酸序列及其推测的氨基酸序列与人、大小鼠序列高度同源。结论获得了东方田鼠CYP2E1、CYP2D 5、ECHS1三个基因全长cDNA序列,并已在Genbank中登录(GQ507485、GQ507486、GQ845171),为东方田鼠非酒精性脂肪肝模型的研究奠定了基础。
东方田鼠;cDNA序列;非酒精性脂肪肝
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是以无过量饮酒史(酒精摄入量< 20 g/d)以及肝细胞脂肪变性、气球样变、弥散性肝小叶轻度炎症和(或)肝中央静脉、肝窦周围胶原沉积等为临床病理特点的慢性肝脏疾病[1]。近年来,由于饮食结构的变化,非酒精性脂肪肝的发病率呈逐年上升趋势,统计结果显示脂肪肝患者已占到平均人口的10%~24%。脂肪肝已成为仅次于病毒性肝炎的第二位常见肝病,在发达国家已成为第一位常见肝病,且有发展至肝硬化、肝癌、肝衰竭的危险[2],成为全球普遍关注的医学问题和社会问题。但非酒精性脂肪肝的发病机制至今尚未明确,目前认为非酒精性脂肪肝病变的产生是多基因共同参与的结果。
细胞色素P450是位于滑面内质网上的一组混合功能氧化酶系,是肝脏代谢最主要的酶系之一,定位于肝微粒体,主要参与各种内源性和外源性化合物在体内的代谢过程,可能与肝脏脂肪病变有密切关系[3],其中细胞色素P4502E1(cytochrome P4502E1, CYP2E1)在肝细胞物质代谢方面起主要作用[3,4]。高脂饲料喂养的大鼠P4502E1活性明显升高[5], CYP2E1还参与肝细胞的氧应激、细胞凋亡、炎症因子形成及星状细胞激活等过程[6,7]。CPY2D 5也是细胞色素P450家族的成员,参与许多内源性化合物和外源性人造化学物质的氧化代谢反应,包括类固醇、脂肪酸、类视黄醇、胆汁酸、生物胺等[8]。烯酰辅酶A水合酶短链1(enoyl coenzym e A hydratase,short chain 1,ECHS1)也与脂肪酸代谢有密切关系,它是线粒体脂肪酸β氧化中的关键酶,在水化反应中催化烯脂酰辅酶A生成L-β-羟脂酰辅酶A,若ECHS1的表达量降低就会使脂肪酸β氧化减少或停止,使储存在肝脏中的大量的脂肪酸不能被氧化供能,在肝细胞内堆积形成脂肪肝。并且它还是参与胆固醇代谢的一个非常重要的基因[9]。
为了研究和探讨非酒精性脂肪肝在东方田鼠中的发病机制,我们首先用S MART技术构建了东方田鼠肝脏cDNA质粒文库,并通过PCR方法筛选文库获得这三个基因的cDNA全长序列,为接下来研究上述基因与非酒精性脂肪肝的关系奠定了基础。(沪)2008-0016]。
1.2 试剂
Trizo l reagent、1 kb DNA ladder m arker及2 kb DNA ladder m arker购自Gibco BRL公司;O ligo tex mRNA kits和质粒提取试剂盒购自Q iagen公司; S MARTTMcDNA质粒文库构建试剂盒为美国C lontech公司,IPTG和X-gal为上海生工生物工程技术有限公司产品;rTaq聚合酶(5 U/μL)、感受态细胞购自大连宝生物工程有限公司。
1.3 方法
1.3.1 cDNA文库构建:取东方田鼠肝脏,用异硫氰酸胍法按Gibco BRL公司Trizol reagent操作说明书提取总RNA;mRNA的纯化按照Q iagen公司O ligotexmRNA Kits操作说明进行;再按S MARTTMcDNA质粒文库构建试剂盒操作说明书建立cDNA质粒文库:取纯化后mRNA加入S MART IV O ligo nuc leotide、CDS III/3′PCR p rim er合成cDNA第一链,用LD PCR扩增26个循环合成双链cDNA,接着制备cDNA Sfi I粘性末端并纯化,加入Sfi I改造的pB luescrip t II SK克隆载体,16℃连接过夜,使目的基因连接在Sfi I改造的的pB luescrip t IISK载体上,构建东方田鼠肝脏的cDNA质粒文库。
1.3.2 PCR引物的设计与合成:参照NCB I中大小鼠CYP2E1、CYP2D 5、ECHS1三个基因序列,进行序列同源比对得到这三个基因cDNA序列的保守区,在cDNA保守区设计特异性引物(见表1),引物由上海申能博彩生物技术有限公司合成。
1 材料与方法
1.1 实验动物
实验室饲养洞庭湖种群12周龄东方田鼠4只,来源于上海西普尔-必凯实验动物有限公司[SCXK
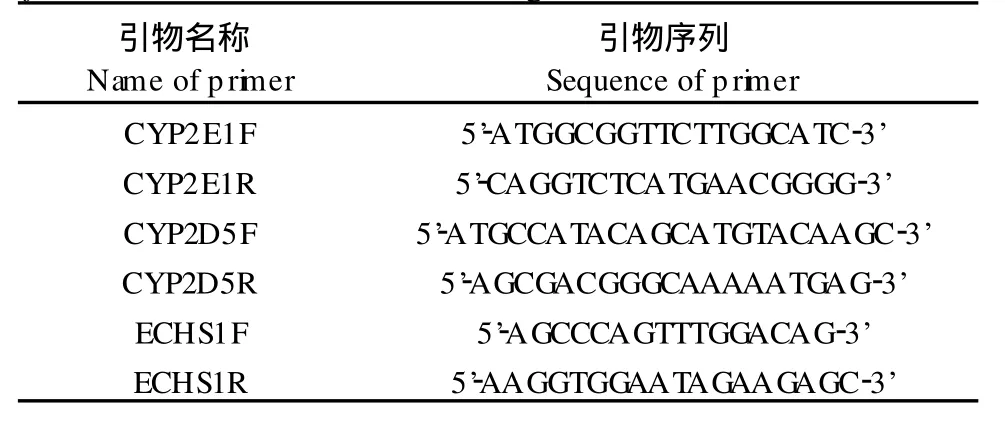
表1 筛选东方田鼠CYP2E1、CYP2D 5、ECHS1基因PCR引物Tab.1 PCR p rim er sequences fo r cloning of M icrotus fortis CYP2E1,CYP2D 5,ECHS1 genes
1.3.3 全长cDNA克隆:①东方田鼠cDNA文库的转化:取100μL感受态细胞,加入1μL东方田鼠cDNA文库,轻轻混匀后冰浴30 m in,42℃热激90 s,立即冰浴2 m in,加900μL SOC培养基,37℃250 r/m in摇45 m in,3000 r/m in离心5 m in,沉淀加入100μL SOC吹打重悬后,取出10μL菌液涂加AM P的LB琼脂板,置37℃培养箱中过夜。次日挑取白色菌落,加入5 mL LB溶液中,摇菌过夜。②目的基因的PCR筛选:把所有菌液按每30管一组分组,每管取等量菌液混合做为PCR初筛模板,取1 μL混合菌液,加入上、下游引物(20μmo l/L)各0.4 μL、M gC l21.6μL、dNTPs(2.5 mmol/L)0.4μL、PCR buffer 2μL、Taq po lym erase 0.2μL、水14μL,进行PCR扩增。程序如下:94℃变性5 m in进入循环; 95℃30 s,53℃45 s,72℃2 m in,38个循环后,72℃延伸10 m in。反应结束后,取2μL产物经1%琼脂糖凝胶电泳检测。对检出阳性条带的混合菌液,把所有单管菌液再按照上述步骤进行PCR筛选,将出现目的条带的菌液送上海英俊公司用pB luescrip t II SK通用引物M 13R CAGGAAACAGCTATGACC在AB I3730型全自动序列分析仪上测序。
1.3.4 基因序列分析:在NCB I网站中收集人类、大鼠、小鼠上述基因的cDNA全长序列,通过BLAST与测得的东方田鼠基因序列进行比对,分析同源性,并找出启动子和终止密码子。推测其氨基酸序列,并对东方田鼠上述基因的氨基酸序列与人类及大小鼠的氨基酸序列进行比对分析。
2 结果
2.1 东方田鼠肝脏cDNA文库构建
经逆转录合成,PCR扩增的双链cDNA,分布呈弥散状,符合文库构建要求。cDNA Sfi I粘性末端制备及纯化后电泳显示双链cDNA主要分布于500~4000 bp之间,呈弥散状条带,符合建库要求(图1)。该cDNA文库的滴度为1076 p fu/μL,重组率约94%,库容量达1.08×106,完整性基因的比率为77.3%。
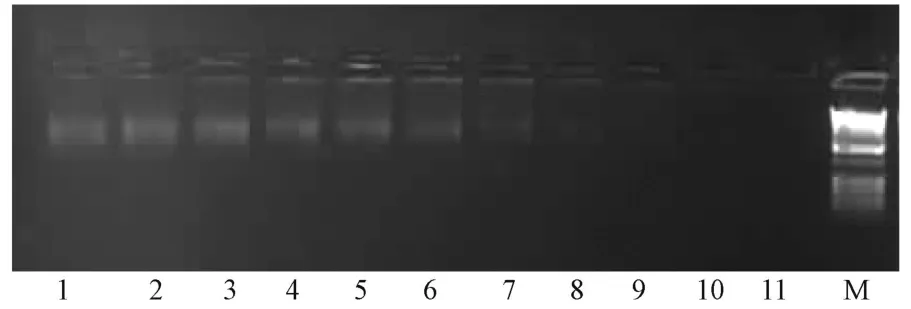
1~11:经CHROMA SP IN-400凝胶层析柱纯化cDNA;M:1kb DNA ladder图1 Sfi I消化后分级分离的cDNA电泳结果1-11:cDNA purified by CHROMA SP IN-400 gel colum n chromatography;M:1kb DNA ladderF ig.1 cDNA after Sfi I digestion and c lassified separation
2.2 三个基因全长cDNA的获取
通过两轮PCR筛选(图2),从文库中获得目的菌落。用pB luescrip t II SK通用物M 13R测序,获得了东方田鼠CYP2E1、CYP2D5、ECHS1三个基因的全长序列。
CYP2E1基因全长为1685 bp,37-39位为起始密码子ATG,其上游有统一阅读框终止密码子TGA,开放阅读框(ORE)为1482 bp,编码494个氨基酸,1513位为终止密码子TAA,其下游有加尾信号及polyA尾。CYP2D5基因全长1690 bp,92-94位为起始密码子ATG,其上游有统一阅读框终止密码子TGA,开放阅读框(ORE)含1514 bp,编码504个氨基酸,1605位为终止密码子TAA,其下游有加尾信号及po lyA尾。ECHS1基因全长为1013 bp,35-37位为起始密码子ATG,其上游有统一阅读框终止密码子TGA,开放阅读框(ORE)长度为873 bp,编码290个氨基酸,907位为终止密码子TAA,其下游有加尾信号及po lyA尾。以上三个基因已在GenBank中注册,注册号分别为GQ507485、GQ507486、GQ845171。
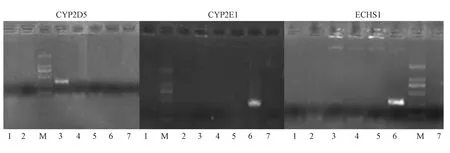
1~7:待测细菌克隆,M:2 kb DNA ladder图2 东方田鼠cDNA文库PCR筛选电泳结果1-7:the testing clone;M:2 kb DNA ladderF ig.2 The screening resu lts of M icrotus fortis liver cDNA p lasm id library
2.3 同源性分析
2.3.1 核酸水平比较:通过与其他动物CYP2E1基因比较发现,东方田鼠CYP2E1基因m RNA与人、大鼠、小鼠同源性分别为80%、90%和89%。东方田鼠CYP2D 5基因m RNA与大鼠有85%的同源性。东方田鼠ECHS1与人、大鼠、小鼠mRNA的同源性分别为85%、91%和90%。
2.3.2 氨基酸水平比较:通过相似性比较软件(B lastp)non-redundant p rotein sequences(nr)蛋白数据库比较发现,东方田鼠CYP2E1基因在氨基酸水平上与大鼠、人类和小鼠的同源性分别为96%、91%和94%;CYP2D 5基因与大鼠的同源性为87%;ECHS1基因与大鼠、人类和小鼠的同源性分别为97%、91%和85%(图3~5)。

*和○分别表示相同及相似氨基酸图3 东方田鼠与大鼠CYP2D 5氨基酸序列同源性比较*and○rep resent the identity and sim ilar am ino acid residues,respectivelyF ig.3 Comparison of the deduced am ino acid sequences of CYP2D 5 between M icrotus fortis and Ra ttus norvegicus
3 讨论
东方田鼠(M icrotus fortis)隶属于啮齿目(Roden t)、仓鼠科(Cricetidae)、田鼠亚科(M icrotinae)、田鼠属(M icrotus),是我国常见的啮齿类动物,主要分布于我国东北、西北及南方地区[10]。东方田鼠是农作物的重要害鼠,又是多种人兽共患病的自然宿主,国内外许多学者对其生态学、行为学等作了一系列研究[11]。早在上世纪五十年代,我国学者就发现东方田鼠具有天然的对日本血吸虫不感染的特性[12-14],近些年来,由于研究其对血吸虫天然不感染特性的需要,我们对东方田鼠进行了实验动物化研究,在实验室繁育过程中,我们发现东方田鼠在实验室条件饲养下具有易发生脂肪肝的倾向[15]。我们推测东方田鼠有可能作为脂肪肝的研究模型,具有潜在的应用价值。
由于目前对东方田鼠的研究还不够深入,已知的与东方田鼠相关基因序列信息非常少,无法开展对东方田鼠非酒精性脂肪肝发病机制的研究,所以需要建立cDNA文库,在此基础上有目的地筛选与非酒精性脂肪肝相关的克隆进行序列测定,以便获得东方田鼠基因表达信息,为进一步探讨东方田鼠脂肪肝的发病机理奠定基础。本文在S MART技术的基础上采用LD-PCR(长距离PCR)法构建的东方田鼠肝脏cDNA文库,该方法是基于PCR基础上的一种cDNA合成的文库构建方法,其特点是用少量总RNA经15~25轮LD-PCR(long distance PCR)扩增即获得几微克的全长双链cDNA,同时保持了原始信息,该技术产生的双链cDNA富含m RNA完整的5’非翻译区(untranslated region,UTR),也省略了合成接头的连接、甲基化等操作步骤,降低了实验过程中的错误掺入率,更易获得全长基因[16]。本实验建立的东方田鼠肝脏cDNA文库经检测库容量为1.08×106,滴度为1076 p fu/μL,重组率约94%,基因的完整性比率为77.3%,所建文库质量较好,基因的完整性也比较高。

*和○分别表示相同及相似氨基酸图4 东方田鼠与大小鼠、人类CYP2E1氨基酸序列同源性比较*and○rep resent the identity and sim ilar am ino acid residues respectivelyF ig.4 Comparison of the deduced am ino acid sequences of CYP2E1 among M icrotus fortis, Ra ttus norveicgus,M us m uscu lus and Hom o sapiens

*和○分别表示相同及相似氨基酸图5 东方田鼠与大小鼠、人类ECHS1氨基酸序列同源性比较*and○rep resent the identity and sim ilar am ino acid residues,respectivelyF ig.5 Comparison of the deduced am ino acid sequences of ECHS1 among M icro tus fortis,Ra ttus norveicgus,M us m uscu lus and Hom o sapiens
从文库筛选目的基因传统的方法为菌落原位杂交,然后通过特异性标记显色从文库中筛选出目的克隆,但上述方法存在筛库信息流量较小,工作量大、周期长,费用高等缺点,而PCR筛选方法利用了PCR反应快速、灵敏的特点,使筛选时间大大缩短,筛选的准确性明显提高[17]。因此本文在所建cDNA文库质量较高的基础上,采用基因保守区序列设计引物,通过两轮PCR筛选,得到含有目的片段的载体菌克隆,用质粒pB luescrip t II SK通用引物M 13R对出现目的条带的菌液进行测序,获得了东方田鼠与脂肪肝相关的CYP2E1、CYP2D 5、ECHS1三个基因的全长序列。
测序结果显示CYP2E1基因全长为1685bp,编码区长度为1482bp;CYP2D 5基因全长1690bp,编码区长度为1514bp;ECHS1基因全长为1013 bp,编码区长度为873 bp,并可从各自的基因序列上找到起始密码子ATG、统一阅读框、终止密码子TGA、终止密码子TAA、其下游有加尾信号及po lyA尾,三个基因均有完整的开放阅读框(ORE)。将序列与在NCB I网站中收集的人类、大鼠、小鼠该基因的cDNA全长序列进行比对,显示东方田鼠这三个基因与人类和大小鼠的同源性很高,mRNA的同源性在80%~91%之间,氨基酸的同源性在85%~97%之间。在对人及大小鼠CYP2E1、CYP2D 5和ECHS1的研究中发现,它们与肝脏的脂肪代谢中起着重要作用,但是这几个基因在东方田鼠肝脏脂肪代谢中所起的作用需要进一步研究。
本文构建的cDNA文库及获得的CYP2E1、CYP2D 5和ECHS1三个全长基因对今后开展东方田鼠脂肪肝模型和脂肪肝的机理研究等奠定了基础。
[1] M ascitelli L,Pezzetta F.D iagnosis of nonalcoholic fatty liver disease[J].JAMA,2003,290:1577.
[2] B runt EM.Nonalcoho lic steatohepatitis[J].Sem inars in L iver D is,2004,24:3-20.
[3] 范建高,钟岚,吴伟清,等.非酒精性脂肪性肝炎肝细胞内细胞色P4502E1的表达[J].肝脏,1999,2(2):205-206.
[4] Gochee PA,Jonsson JR,C louston ND,et al.Steatosis in chronic hepatitis C:association w ith increased messenger RNA exp ression of collagen I,tumor necrosis factor-alpha and cytochrome P4502E1[J].Gastroenterol Hepato l,2003,18 (4):386-392.
[5] Yeo-Pyo Y,Cassazza JP,Sohn DH,et al.Pretranslational activation of cytochrome P450ⅡE during ketosis induced by a high fat diet[J].Mol Pharmacol,1989,41:474-479.
[6] Prandota J. Important role of p rod romal viral infections responsible for inhibition of xenobiotic metabolizing enzymes in the pathomechanis m of idiopathic Reye s synd rome,Stevens-Johnson syndrome,autoimmune hepatitis,and hepatotoxicity of the therapeutic doses of acetam inophem used in genetically p redisposed persons[J].Am J Ther,2002,9(2):149-156.
[7] Lee KS,Buck M,Houglum K,et al.A ctivation of hepatic stellate cells by TGF alpha and collagen type I is m ediated by oxidative stress through c-m yb exp ression[J].J C lin Invest, 1995,96:2461-2468.
[8] Lee YH,Yano M,L iu SY,et al.A Novel cis-acting elem ent controlling the rat CYP2D5 gene and requiring cooperativity betw een C/EBPβand an Sp l factor[J].M o lec Cellu lar B io l 1994,14(2):1383-1394.
[9] 刘蓉,鞠艳芳,杨金菊,等.烯脂酰辅酶A水解酶单克隆抗体的制备与鉴定[J].细胞与分子免疫学杂志,2008, (244):387-389.
[10] 何永康,张新跃.东方田鼠的研究进展[J].中国实验动物学杂志,1998,8(2):116-119.
[11] Ho ring J,Chizhikov V,LundkvistA,et al.Khabarovsk virus:A genetically and sero logically distinct hantavirus iso lated from M icrotus fortis trapped in far eastRussia[J].Gen viro l,1996, 77:687-694.
[12] 黎申恺,朱祖林,金壁如,等.东方田鼠对日本血吸虫的不感染性[J].寄生虫学报,1965,2(1):103-105.
[13] 李浩,何艳燕,林矫矫,等.东方田鼠抗日本血吸虫现象的观察[J].中国兽医寄生虫病,2000,8(2):12-15.
[14] 孙军,林矫矫,程国锋,等.利用基因表达谱芯片研究东方田鼠和小鼠感染日本血吸虫前后基因的差异性表达[J].北京大学学报(自然科学版),2004,40(4):532-536.
[15] 周光兴,谢建云,柏熊,等.不同年龄东方田鼠组织器官的形态学观察[J].华东地区第十届实验动物科学学术交流会论文集,2008:395.
[16] Semove N,Semov A,W ang E.D igital im age analysis for rap id quantification of total and cDNA for S MARTTM-PCR[J]. B ioltechniques,2001,31:746-752.
[17] 徐军望,朱祯,李旭刚,等.快速cDNA文库筛选和淀粉合成酶基因的分离与鉴定[J].高技术通讯,2001,8:1-6.
A cqu isition and Ana lysis of Three cDNA Fu ll-L ength Sequences from the L iver of M ic ro tus fo rtis
YANG Yu-qin1,FENG Jie2,3,WANG Xue-bin4,X IE Jian-yun2,3,GAO Cheng2,HU Jian-hua2
(1.Fudan University,Shanghai 200032,China;2.ShanghaiQualityM onitoring Center of Laboratory Anim als, ShanghaiLaboratory Animal Research Center,Shanghai 201203;3.Shanghai Institute of Planned Parenthood Research,Shanghai 200032;4.Co llege of Anim al Science and Techno logy,Yangzhou University,Yangzhou 225009)
O b jective To obtain the full-length cDNA sequences of CYP2E1,CYP2D5,ECHS1,which may be related w ith non-alcoholic fatty liver disease,from M icrotus fortis.M ethods To construct M icrotus fortis liver cDNA p lasm id library using S MART technique,to get the purposed co lonies through screening libraries by PCR,and to obtain their fu ll-length cDNA sequences by sequencingw ith pB luescrip t II SK universalp rim ersM 13R.ResultsTh ree full-length cDNA sequences of M icro tus fortis,CYP2E1,CYP2D 5 and ECHS1 were obtained.The CYP2E1 cDNA was 1685 bp in length and contained a 1482 bp open reading fram e(ORF)encoding a 494 am ino acids.The CYP2D 5 cDNA was 1690 bp in length,and contained a 1514 bp ORF encoding 504 am ino acids.The ECHS1 cDNA was 1013 bp in length,and containsed an 873 bp ORF encoding 290 am ino acids.Sequence analysis revealed that the identity of the three cDNA sequences and deduced am ino acids among M icro tus fortis,Hom o sapiens,M us m uscu lus and Ra ttus norvegicus was high. Conc lusion The full-length cDNA sequences of CYP2E1,CYP2D 5,ECHS1 were obtained from M icrotus fortis liver cDNA library,and the gene sequences have been deposited in GenBank(GQ507485,GQ507486,GQ845171),which m ay lay the foundation for researchies of pathogenesis of non-alcoho lic fatty liver disease in M icrotus fortis models.
M icrotus fortis;cDNA sequence;Non-alcoho lic fatty liver d isease
Q781
A
1005-4847(2010)01-0037-07
2009-09-17
上海市科学基因资助项目(编号:071409001)。
杨玉琴(1980-)女,河北保定人,硕士生,研究方向:实验动物学。
谢建云(1968-)女,研究员,主要从事实验动物遗传学研究。E-mail:xiejianyun@hotmail.com。高诚(1961-)男,研究员,研究生导师,E-mail:gaochengdgb@126.com
